牙鲆PIK3R3-like基因的表达分析及重组表达❋
王欣桐, 王宣刚, 孙敏敏, 孔祥福, 刘金相,2, 王志刚, 于海洋❋❋
(1. 中国海洋大学海洋生命学院 海洋生物遗传学与育种教育部重点实验室, 山东 青岛 266003)(2. 青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266237)
牙鲆是一种广泛分布于亚洲沿海地区的海水增养殖鱼类,近年来牙鲆高密度集约化的养殖方式加速了细菌、病毒等病原体的传播速度,限制了牙鲆养殖业的发展。迟缓爱德华氏菌是一种革兰氏阴性肠道致病菌,能侵染人和包括牙鲆在内的多种硬骨鱼,被侵染的牙鲆常表现出腹腔积水、内脏充血和体表出血等症状,对牙鲆养殖业的健康发展造成了严重的威胁[1]。牙鲆作为低等脊椎动物,其免疫机制以先天性免疫为主,因此在基因层面对牙鲆的免疫系统及免疫反应机制进行细致深入的研究,可以针对不同病原体研制出有效的对策,避免因使用抗生素等药物引起生物耐药性及药物残留等问题,可对细菌侵染造成的牙鲆疾病进行防控、减少养殖中经济的损失。
磷脂酰肌醇3-激酶(PI3K)家族是一类脂质激酶,也是一种具有脂质底物特异性的新型细胞内传感器,能在正常和病理条件下协调和介导多种细胞行为,在细胞生长、分化、存活和骨架重排等基本细胞功能中具有关键作用[2-4],并在抗凋亡中扮演重要角色[5]。此外PI3K还在抵抗外界病原体入侵[6]、维持免疫细胞正常功能中发挥作用[7-8],通过多种方式参与生物体的先天性和适应性免疫[9],当PI3K通路受损时会导致免疫缺陷[10-11]。
根据结构特征、体外脂质底物特异性、激活机制和功能,可将PI3K家族各成员分为I~III三种类别,其中I类PI3K是由一个调节亚基和一个催化亚基组成的异二聚体,此类P13K可进一步分为IA类和IB类,IA类由受体酪氨酸激酶所激活,包括p110α(PIK3CA)、p110β(PIK3CB)和p110δ(PIK3CD);IB类则由G蛋白偶联受体激活,包括p85α(PIK3R1)、p85β(PIK3R2)和p55γ(PIK3R3)[12-16]。研究表明,PIK3R3可以通过iSH2结构域与p110催化亚基结合,在调控细胞增殖和肿瘤生长中发挥重要作用;在多种肿瘤细胞中PIK3R3的表达量显著上调,提示该基因与肿瘤相关过程有密切联系;体外敲除PIK3R3后诱导了人类卵巢细胞的凋亡,表明其具有一定的抗凋亡作用;使用无乳链球菌刺激尼罗罗非鱼后其多个组织中PIK3R3b的表达量显著上调,暗示该基因在尼罗罗非鱼抵抗外界病原体入侵中可能发挥一定作用[2, 17-19]。使用迟缓爱德华氏菌侵染后,RNA-Seq与qRT-PCR均表明在牙鲆的鳃、肾脏和血液中,PI3K家族多个基因的表达量发生显著变化,其中肾脏中PIK3R3-like在迟缓爱德华氏菌刺激后的8和48 h时的表达量与0 h相比均有显著上调,提示PIK3R3-like在牙鲆抵抗迟缓爱德华氏菌侵染中可能发挥作用[20-22]。本研究中的克隆鉴定了牙鲆的PIK3R3-like基因,发现该基因存在一长一短两个可变剪接,分别命名为PoPIK3R3-like-Ⅰ和PoPIK3R3-like-Ⅱ,并对PoPIK3R3-like的结构域、同源性和系统进化关系进行了分析。通过qRT-PCR检测了PoPIK3R3-like其在牙鲆各组织的分布情况,以及迟缓爱德华氏菌侵染后牙鲆细胞中其表达量变化。最后利用原核表达的方法得到了牙鲆PoPIK3R3-like-Ⅰ的重组蛋白,并进行了纯化,所得纯化蛋白可用于后续基因功能的研究。
1 材料与方法
1.1 实验材料
1.1.1 牙鲆 本实验中所用的一龄牙鲆(体重550~1 100 g)购买自青岛南山市场,购回后所有牙鲆均养殖于温度控制在18~20 ℃的海水中,每天饲喂商业饲料直至实验前取用。
1.1.2 迟缓爱德华氏菌 迟缓爱德华氏菌由中国水产科学研究院黄海水产研究所赠予,28 ℃下培养在LB培养基中。
1.1.3 牙鲆鳃细胞系(FG9307) 牙鲆鳃细胞系由中国海洋大学细胞工程技术实验室赠予,使用含有10%胎牛血清、1%非必需氨基酸、1%青-链霉素的DMEM/F12培养基在24 ℃环境下培养。
1.1.4 实验试剂 TRIzol、BCA蛋白浓度测定试剂盒购自北京索莱宝科技有限公司,M-MLV反转录试剂盒、T4连接酶体系、限制性内切酶购自宝生物工程(大连)有限公司,胶回收试剂盒购自北京康为世纪生物科技有限公司,RNA纯化试剂盒购自北京博迈德基因技术有限公司,PCR试剂、p-EASY连接体系、DH5α及BL21(DE3)感受态细胞购自北京全式金生物技术有限公司,SYBR qPCR SuperMix定量试剂购自Novoprotein公司,鱼类单核细胞分离试剂盒购自天津市灏洋生物制品科技有限责任公司。
1.2 PoPIK3R3-like基因序列分析
本研究通过对多物种PIK3R3及PIK3R3-like基因进行系统进化分析,比较了牙鲆PIK3R3和PIK3R3-like的关系。通过比对将PoPIK3R3-like-Ⅰ、PoPIK3R3-like-Ⅱ的核酸序列与对应氨基酸序列进行序列分析,并对不同硬骨鱼中PIK3R3-like基因编码的氨基酸序列及多物种中该基因的系统进化对进行了分析。在NCBI数据库中获得其它鱼类PIK3R3-like的氨基酸序列,使用DNAMAN软件对核酸与对应氨基酸序列进行比对,并对牙鲆及其它鱼类PIK3R3-like的氨基酸序列进行多序列比对,分析不同鱼类中该基因序列的一致性(见表1)。将PoPIK3R3-like-Ⅰ与各物种PIK3R3-like基因的氨基酸序列通过Clustal W方法进行比对,使用MEGA 7.0工具中的NJ法构建进化树,Bootstrap值为1 000(见表2)。

表1 实验所用PIK3R3-like蛋白登录号

表2 实验所用PIK3R3蛋白登录号
1.3 牙鲆各组织及细胞RNA的提取及cDNA的合成
实验前用麻醉剂将牙鲆麻醉以减轻实验动物的痛苦。待牙鲆麻醉后将其转移到实验台上,用酒精擦拭鱼身进行消毒,随后用灭菌的眼科剪从牙鲆的泄殖孔将其腹腔剪开,小心地取出心脏、肝脏、脾脏、肾脏、脑、鳃、肌肉、肠,共取3条雌鱼3条雄鱼,取出的组织用灭菌的去离子水清洗后切成小块,迅速投入液氮中速冻,随后保存在-80 ℃超低温冰箱中直至取用。
组织RNA的提取采用TRIzol法,将组织从-80 ℃超低温冰箱中取出后投入含有TRIzol的离心管中,用手持电动匀浆器将组织磨碎,后续按照说明书上的步骤对RNA进行提取。使用RNA纯化试剂盒去除RNA中残留的DNA和蛋白质。使用M-MLV反转录试剂盒将纯化后的RNA反转录为cDNA,并保存在-20 ℃条件下。
使用TRIzol对处理后的牙鲆鳃细胞和巨噬细胞进行消化后,按照说明书的步骤对细胞中的RNA进行提取,使用gDNA Eraser试剂盒对RNA进行反转录及cDNA的合成。
1.4 牙鲆PIK3R3-like基因核心片段的获取
根据实验室已有的牙鲆全基因组进行本地blast得到牙鲆PIK3R3-like基因序列,使用IDT网站(https://sg.idtdna.com/pages)在线设计特异性引物进行PCR扩增,引物序列为:Fw: 5’- CAAAGACAACAGCAGCAGCC -3’,Rv: 5’- CAGTCGTTCTCGCAGGATACAG -3’。以牙鲆各组织混合cDNA为模板,使用北京全式金生物公司生产的TransStart®FastPfu DNA Polymerase进行PCR扩增,PCR体系为5×TransStart®FastPfu buffer 5 μL,dNTP(10 mmol/L) 2 μL,模板1 μL,正、反向引物各0.5 μL,TransStart®FastPfu DNA Polymerase 0.5 μL,ddH2O 15.5 μL,共计25 μL。反应程序为95 ℃ 2 min;95 ℃ 20 s,52 ℃ 20 s,72 ℃ 1 min,35个循环;72 ℃ 10 min,4 ℃保存。反应结束后使用2%琼脂糖凝胶进行电泳对PCR产物进行检测,切胶回收后与pEASY®-Blunt Simple载体连接,连接好的质粒转化入DH5α感受态细胞后进行培养,选取阳性克隆菌株送往华大基因测序。通过BLAST比对确定扩增得到的是牙鲆PIK3R3-like基因。
1.5 PoPIK3R3-like基因的表达分析
由于PIK3R3-like的两种剪接型仅在结构域位置有少许区别,3’ UTR及5’ UTR区域无差异,难以设计引物将二者区分开,因此作者设计引物检测了二者表达量之和。使用IDT网站(https://sg.idtdna.com/pages)在线设计设计PoPIK3R3-like的 qRT-PCR 引物,序列为PoPIK3R3-like-Fw1: 5’-CTGCACCTTTGTTTGACTTC-3’;PoPIK3R3-like-Rv1: 5’-GTTCACATCACCGTCTACTC-3’。以牙鲆各组织或细胞的cDNA为模板,以牙鲆β-actin基因为内参基因,通过qRT-PCR检测PoPIK3R3-like的表达模式。
Real-time PCR反应程序设定为:95 ℃ 5 min;95 ℃ 15 s,60 ℃ 40 s,共40个循环。每个反应设置3个重复以增加实验数据的可信度。待反应结束后采用2-ΔΔCt法对实验数据进行分析处理,根据目的基因和内参基因的Ct值计算目的基因的表达量,最终结果用平均值±标准误(Mean ± SE)表示。使用SPSS对数据进行单因素方差分析以判断显著性差异,p< 0.05为差异显著(*标示),p< 0.01为差异极显著(**标示)。
1.6 迟缓爱德华氏菌刺激牙鲆鳃细胞、单核-巨噬细胞
将生长状态良好的牙鲆鳃细胞接种到24孔细胞培养板中,待细胞覆盖度达到80%左右时弃去培养基,用PBS清洗细胞两遍后加入不含青-链霉素的培养基,以免对后续加入的细菌造成影响,随后加入感染复数(MOI)为10,即细胞数量10倍的迟缓爱德华氏菌对细胞进行刺激,在刺激后的0、4、8、12和24 h时收集细胞,保存在TRIzol中用于RNA的提取。需要注意的是在刺激4 h后需弃去培养基,用PBS缓冲液清洗细胞洗去未侵入到细胞中的细菌,再加入新鲜的培养基继续对细胞进行培养以免细菌在培养基中过度繁殖对细胞造成不利影响。
牙鲆单核-巨噬细胞利用鱼类单核细胞分离试剂盒(天津市灏洋生物制品科技有限责任公司)按照说明书中的步骤从牙鲆的头肾中分离得到,同样使用感染复数为10的迟缓爱德华氏菌对细胞进行刺激,在刺激后的0和2 h收集细胞,保存在TRIzol中用于RNA的提取。
1.7 牙鲆PIK3R3-like基因原核表达载体的构建
在PoPIK3R3-like-Ⅰ的ORF两端设计分别带有带有EcoRI和XhoI酶切位点的引物,引物序列为PoPIK3R3-like-Fw2: 5’-CCGGAATTCATGGTTTATCCTCCCGAAG-3’;PoPIK3R3-like-Rv2: 5’-CCGCTCGAGTTACATTTCTGGAGCTGCAG-3’,下划线所示为酶切位点位置。将PCR产物连接到pET-32a(+)质粒中,得到重组表达质粒。将重组质粒转化到DH5α感受态细胞中,挑选阳性菌株进行测序,对测序正确的菌株进行质粒提取,用于下一步蛋白的诱导表达。
1.8 重组PoPIK3R3-like-Ⅰ蛋白的表达、纯化和复性
将质粒转化到BL21(DE3)表达菌株中,从阳性菌株中挑取单菌落,37 ℃ 180 r/min条件下使用LB培养基进行培养,当菌液OD值达到0.6左右时向菌液中加入终浓度为0.5 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG),用于诱导蛋白表达,随后在37 ℃ 180 r/min条件下继续培养8 h。分别取1 mL未诱导及诱导后的菌液,离心后弃去培养基,用去离子水将菌体重悬,加入5×SDS-PAGE上样缓冲液后99 ℃加热10 min使蛋白变性,随后通过SDS-PAGE检测诱导结果。
对菌体进行超声破碎后检测得知蛋白表达在包涵体中,对包涵体进行洗涤、溶解后,使用镍柱对包涵体进行纯化,随后用不同浓度的咪唑将结合在镍柱上的蛋白洗脱下来,通过SDS-PAGE检测各浓度咪唑洗脱下来的蛋白单一性,选择纯度较高的一组进行下一步蛋白的复性。
按照说明书中的要求剪下合适长度的透析袋并进行预处理,将需复性的蛋白装入透析袋中,两端密封后在4 ℃条件下分别在透析液Ⅰ~Ⅶ(成分参照周纳宇等的实验步骤[23])中透析12 h。透析结束后取出透析袋,在其表面均匀撒上PEG20000对蛋白进行浓缩,随后离心收集上清,样品保存在-80 ℃超低温冰箱中。使用BCA蛋白浓度测定试剂盒按照说明书中的步骤对浓缩后的蛋白进行浓度测定。
2 结果
2.1 PoPIK3R3-like基因的序列分析
通过查找本研究实验室牙鲆转录组数据库结合NCBI数据库分析,作者得到一段牙鲆PIK3R3基因的亚型——PIK3R3-like的基因序列(见图1),序列比对显示牙鲆中存在两种剪接型,将可变剪接长链和短链分别命名为PoPIK3R3-like-Ⅰ和PoPIK3R3-like-Ⅱ,通过BLASTP比对发现PoPIK3R3-like基因的两种剪接型序列与多种硬骨鱼的PIK3R3-like基因均具有较高同源性,其中与黄尾鰤的相似度最高,达到94.3%(见图2),同时PoPIK3R3-like-Ⅰ比其它PoPIK3R3-like基因均多出一个21nt的插入,编码7个氨基酸。
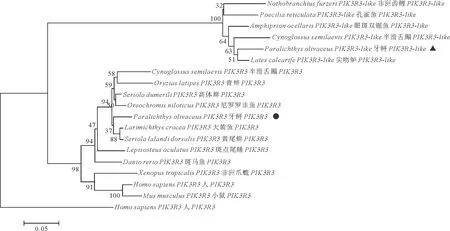
(使用MEGA 7.0软件中的NJ法对进化树进行构建,采用Clustal W的方法进行多序列比对,节点处的数值表示经过1 000次重复检验后的Bootstrap支持率(%)。The phylogenetic tree was drawn by MEGA 7.0 neighbor-joining method based on multiple sequence alignment by Clustal W. The reliability of each node was estimated by bootstrapping with 1 000 replications. The numbers shown at each node indicate the bootstrap values (%).)

(Paralichthys olivaceus Ⅰ:牙鲆 Ⅰ(PoPIK3R3-like-Ⅰ); Paralichthys olivaceus Ⅱ:牙鲆 Ⅱ(PoPIK3R3-like-Ⅱ); Cynoglossus semilaevis:半滑舌鳎; Lates calcarifer: 尖吻鲈; Amphiprion ocellaris: 眼斑双锯鱼; Nothobranchius furzeri: 非洲齿鲤。不同的颜色表示不同序列中该位置处氨基酸的保守程度。Different colors indicate the degree of conservation of amino acids at this position.)
利用Editseq分析得到PoPIK3R3-like-Ⅰ的最长开放阅读框(ORF)长1 425 bp,编码474个氨基酸(见图3)。SignalP v4.0在线预测发现其蛋白不存在信号肽。通过SMART预测发现PIK3R3-like-Ⅰ蛋白含有3个SH2结构域,包括1个nSH2结构域,由第47~130位氨基酸构成;1个iSH2结构域,由第146~320位氨基酸构成;1个cSH2结构域,由第344~426位氨基酸构成(见图4)。

(阴影部分表示三个SH2结构域,其中阴影区域1(47~130位氨基酸)对应nSH2结构域,阴影区域2(146~130位氨基酸)对应iSH2结构域,阴影区域区域3(344~426位氨基酸)对应cSH2结构域。Shadow part represents three SH2 domains,in which shadow part 1 (47~130 amino acids) corresponds to nSH2 domain, shadow part 2 (146~130 amino acids) corresponds to iSH2 domain, and shadow part 3 (344~426 amino acids) corresponds to cSH2 domain.)

图4 PoPIK3R3-like-Ⅰ的结构域
2.2 PoPIK3R3-like基因的组织表达分析
通过qRT-PCR检测牙鲆各组织中PoPIK3R3-like的分布情况。如图5,PoPIK3R3-like在牙鲆的心脏、肝脏、脾脏、肾脏、脑、鳃、肌肉和肠中均有表达,但具有一定的分布特异性,其中在脑和鳃中表达量最高。
2.3 迟缓爱德华氏菌刺激牙鲆鳃细胞、单核-巨噬细胞后PIK3R3-like的表达量变化
本研究使用迟缓爱德华氏菌刺激牙鲆的鳃细胞和单核-巨噬细胞后,在不同时间点进行取样,通过qRT-PCR检测了处理后细胞中PoPIK3R3-like基因的表达量变化。如图6,使用迟缓爱德华氏菌刺激牙鲆鳃细胞后,PoPIK3R3-like的表达量首先上调,在8 h时达到最大值,与0 h时具有显著差异,随后逐渐下降,整体呈现先上升后下降的趋势。如图7,使用迟缓爱德华氏菌刺激牙鲆单核-巨噬细胞2 h后PoPIK3R3-like的表达量上调,并且与对照组相比具有显著差异。

(图中*代表差异显著(*p<0.05, **p<0.01)。*is represented the significant difference (*p<0.05, **p<0.01) in this picture.)

(图中*代表差异显著(*p<0.05, **p<0.01)。 * is represented the significant difference (*p<0.05, **p<0.01) in this picture.)
2.4 PoPIK3R3-like的诱导表达
作者通过原核表达的方式得到了PoPIK3R3-like-Ⅰ的重组蛋白,并进行了纯化和复性,SDS-PAGE检测显示诱导组与对照组相对有一条明显增粗的条带,分子量大小与预测(72 kDa)一致,表明诱导出了相应蛋白。超声破碎后对上清和包涵体进行检测显示重组蛋白表达在包涵体中。对包涵体进行纯化后蛋白条带比较单一且主带清晰(见图8)。

(泳道M:Marker;泳道1:诱导前表达菌株的蛋白;泳道2:诱导后表达菌株的蛋白;泳道3:诱导后表达菌株上清中的蛋白;泳道4:诱导后表达菌株包涵体中的蛋白;泳道5:纯化后的重组蛋白。Lane M: Marker; Lane 1: Extracts from expressing strains before IPTG induction; Lane 2: Extracts from IPTG induced expressing strains; Lane 3: Eupernate of the extracts from expressing strains before IPTG induction; Lane 4: Inclusion bodies of the extracts from expressing strains before IPTG induction; Lane 5: purified rPoPIK3R3-like-Ⅰ.)
2.5 PoPIK3R3-like重组蛋白的浓度测定
利用每一个标准品的浓度及其对应的吸光值绘制标准曲线(见图9),将PoPIK3R3-like-Ⅰ重组蛋白测得的吸光值2.278 5带入标准曲线方程,经计算知蛋白浓度为4.033 5 μg/μL。

图9 BCA法蛋白浓度测定标准曲线
3 讨论
PI3K家族被公认在细胞凋亡、肿瘤迁移等一系列过程中发挥关键作用,此外有研究表明PI3K家族参与先天性免疫和适应性免疫[9],在抵抗病原体入侵[6]、维持免疫细胞的功能[8]中具有重要意义,其部分成员在白细胞中高度表达,对于活化免疫细胞并将其招募到炎症部位、杀伤病原体和呈递抗原发挥不可替代的作用[24]。PI3K家族也参与了一些免疫相关的信号通路,已有研究证明,PI3K家族是重要的信号转导基因,它们充当中间信号分子,在PI3K/AKT/mTOR信号传导途径中发挥重要作用[25-26],PI3K通过产生第二信使将信号从细胞表面传递到细胞质,进而激活多种效应激酶途径,包括BTK,AKT,PKC,NF-κB,JNK/SAPK途径,最终导致正常细胞的存活和生长[27-28]。另外,阻断PI3K家族中的PIK3R3可以通过NF-kB途径调节紧密连接蛋白以减轻炎症的严重程度[29],PIK3R3还可通过p53/p21信号传导途径抑制细胞衰老[30]。有研究表明,牙鲆作为低等脊椎动物,先天性免疫在其抵抗病原体入侵中扮演重要角色,已有研究者证明牙鲆注射迟缓爱德华氏菌后牙鲆多个器官中PI3K家族成员表达量发生显著变化,提示PI3K家族在牙鲆抵抗迟缓爱德华氏菌入侵过程中可能发挥一定作用[20-22]。本研究得到了牙鲆PI3K家族的成员之一——PIK3R3-like的ORF序列,通过对牙鲆与其它物种的PIK3R3及PIK3R3-like进行序列比对和进化树分析发现多个物种的PIK3R3-like与PIK3R3分别聚为一支,同时两基因间同源性较高,提示PIK3R3-like可能是PIK3R3的一个亚型,可能由硬骨鱼类的全基因组复制出现。根据Li等[20,22]和Liu[21]等对于牙鲆注射迟缓爱德华氏菌后牙鲆多个器官中PI3K家族成员转录组表达谱的研究,作者发现在牙鲆中PIK3R3-like在迟缓爱德华氏菌感染后表达量呈现显著上升,而PIK3R3表达量变化不明显,提示在牙鲆中PIK3R3-like可能在免疫反应方面其重要性强于PIK3R3,当然作者尚需要两个基因进一步的比较免疫学研究。
序列分析同时发现该基因不含信号肽,推测其可能在细胞内发挥作用;对结构域进行预测发现其共含有三个结构域,分别是nSH2结构域、iSH2结构域和cSH2结构域,与其它硬骨鱼进行多序列比对后发现PoPIK3R3-like的这三个结构域与其它硬骨鱼相比比较保守,但PoPIK3R3-like在扩增中发现了一个可变剪接区域,其编码了一个在iSH2结构域比其它硬骨鱼多出了7个氨基酸的转录本以及一个氨基酸数量相同的转录本,提示在牙鲆中该可变剪接可能对PoPIK3R3-like基因的功能有影响,并与其它硬骨鱼类可能有所差异;系统进化分析显示PoPIK3R3-like-Ⅰ与其它硬骨鱼类的PIK3R3-like聚为一支,与两栖类、鸟类及哺乳类进化关系较远,符合常见PI3K家族基因普遍的进化关系。
荧光定量PCR结果显示PoPIK3R3-like-Ⅰ基因在牙鲆的各组织中均有表达,但具有一定的分布特异性,在脑和鳃中表达量较高,在其它组织中表达量相对较低。对呼吸机相关肺炎(VAP)患者的研究发现其外周血中PIK3R3基因的表达量与健康人相比发生显著性上调[31];使用鳗弧菌侵染尼罗罗非鱼后其多个免疫器官中PIK3R3b基因的表达量发生显著变化,表明PIK3R3基因可能在炎症反应中发挥作用[19]。类似的,作者使用牙鲆重要的病原菌——迟缓爱德华氏菌在体外对牙鲆的鳃细胞和单核-巨噬细胞进行感染,qRT-PCR结果显示在鳃细胞中PoPIK3R3-like的表达呈现先上升后下降的趋势,且表达量与对照组具有显著差异;迟缓爱德华氏菌刺激单核-巨噬细胞2 h后细胞中PoPIK3R3-like表达量明显上升且同样与对照组具有显著差异。众所周知,鳃是硬骨鱼类重要的免疫器官,含有多种免疫因子和免疫组织,其在牙鲆的先天性免疫中扮演重要角色,单核-巨噬细胞可以通过补体、免疫球蛋白、膜受体等多种机制识别并杀死入侵病原体,控制机体的免疫应答,是牙鲆抵抗外界病原体的关键组分,该结果表明PoPIK3R3-like在牙鲆抵抗迟缓爱德华氏菌感染中可能发挥重要作用,其抗感染的分子机制值得进一步深入研究。
作者通过原核表达的方式在大肠杆菌中得到了PoPIK3R3-like-Ⅰ的重组蛋白,诱导蛋白表达的条件有很多,37 ℃诱导的优点是蛋白合成速度较快,获得的蛋白量较大,缺点是过快的合成速度易使蛋白形成包涵体,失去其天然活性,需后期复性;另一种常见的诱导条件是在较低的温度下诱导,如16或20 ℃,低温诱导的优点是蛋白易以可溶的形式表达在上清中,形成的蛋白是有活性的,无需复性,缺点是蛋白合成速度较慢,获得的蛋白量较小,需延长诱导时间。不同蛋白适宜的诱导温度、诱导时间和IPTG浓度有所差异,经过摸索作者确定了rPoPIK3R3-like-Ⅰ的诱导条件,使用0.5 mmol/L浓度的IPTG在37 ℃下诱导6 h。SDS-PAGE检测显示诱导得到的蛋白表达在包涵体中,考虑是由于原核表达系统中缺乏帮助蛋白折叠的分子伴侣等物质,使来源于真核生物的外源蛋白难以正确折叠,因此不具有天然活性,需进行复性。但包涵体复性往往对于蛋白的生物学活性具有一定影响,可能影响对于蛋白功能的检测,后期可通过降低诱导温度、更换表达载体和表达菌株以期其在上清中表达,并可检测蛋白的完整生物学活性,探究其在牙鲆细菌感染中的具体生物学功能。
综上所述,作者通过数据库生信分析得到了牙鲆PIK3R3-like基因的编码区序列,获得了具有七个氨基酸差异的一对可变剪接转录本,并对其可变剪切长链的氨基酸序列、结构域及进化关系进行了分析,体外免疫刺激表明该基因在牙鲆抵抗外界病原体入侵中发挥一定作用,最后通过原核表达得到了rPoPIK3R3-like-Ⅰ蛋白,为下一步研究该基因的功能奠定了基础。

