添加益生菌和PHBV对凡纳滨对虾养殖系统水质和对虾生长、非特异免疫指标的影响❋
李咏梅, 李腾飞, 田相利,2❋❋, 罗 凯, 王龙斌, 张盛坤, 魏 聪, 刘 杨
(1.海水养殖教育部重点实验室(中国海洋大学), 山东 青岛 266003;2.青岛海洋科学与技术试点国家实验室, 山东 青岛 266237)

益生菌是指在一定浓度范围内可以促进宿主健康的活体微生物制剂[4],作为抗生素的替代品,近几年,益生菌被广泛用于促进水生动物的生产性能及预防和治疗疾病,已成为水产养殖业的研究和应用焦点[5]。研究表明,益生菌不仅可以通过与致病菌竞争生存环境等来抑制致病菌的生长,从而提高水产动物的存活率[6],还能够调控水质,降低水体中的氨氮等有害物质的浓度[7]。其中,芽孢杆菌经常被用作水产养殖系统中的有益微生物。例如,Zhou等[8]发现水体泼洒凝结芽孢杆菌(B.coagulans)SC8168,在一定浓度下能显著提高凡纳滨对虾幼虾的存活率和消化酶活性。此外,当用于水体泼洒时,凝结芽孢杆菌B16也有效促进了罗非鱼(Oreochromisniloticus)的生长[9]。现有研究表明,芽孢杆菌作为益生菌,单独或与其他益生菌联合使用可有效提高鱼类生长速度和饲料利用率。Gobi等[10]和Aly等[11]报道了地衣芽孢杆菌(B.licheniformis)Dahb1和短小双歧杆菌(B.pumilus)显著促进了低眼巨鲶(Pangasiushypophthalmus)和罗非鱼(O.niloticus)的生长。Zokaeifar等[12]则发现枯草芽孢杆菌(B.subtilis)L10和G1可以通过增强凡纳滨对虾的免疫反应来提高其生长性能和抗病性。
研究表明,养殖水体添加适量的碳源,会提高水体中的碳氮比,促进益生菌的生长繁殖,并可通过异养菌的同化作用去除水中氨氮、亚硝酸盐氮和硝酸盐氮[13]。聚羟基丁酸戊酸酯(Poly hydroxybutyrate-co-valerate,PHBV)是微生物在非平衡状态下(如缺乏氮、磷)在细胞内合成的一种热塑性聚酯,具有生物可降解性、生物相容性、压电性、光学活性等许多优良特性[14]。因其具有较好的生物降解性,同时能够以固体材料形式存在,使其在异养反硝化中的应用成为可能[15]。PHBV作为碳源在污水处理系统中的固相反硝化过程的应用已经取得了较好的效果[16]。同时,PHBV具有缓释碳的特点,放入水体后,可以持续提供碳源且易于控制。不过,迄今为止,尽管PHBV等固体碳源在工业污水处理应用广泛,但作为碳源在水产养殖中的应用还少见报道。

1 材料与方法
1.1 实验材料
所用凡纳滨对虾幼虾购自青岛正大农业发展有限公司。实验之前,使对虾在实验条件下适应和驯化2周。驯化过程中,水温控制在(25±0.5) ℃,盐度控制在29.0±1.0,日换水1次,每次换水量为10%,连续充气。每天定时投喂凡纳滨对虾基础饲料3次(7:00、12:00和18:00)。驯化结束后,挑选质量、大小相似的健康凡纳滨对虾用于实验。
实验所用菌株均来自中国海洋大学水产养殖生态学实验室保种中心,为3株异养硝化-好氧反硝化菌株,包括枯草芽孢杆菌H1及其与短小芽孢杆菌BP-171和盐单胞菌DN3[25-27]。实验过程中,各处理组均使用鲜活菌液,活菌量为1×109cfu·mL-1。PHBV材料形状为圆柱形,高为4 mm,内径为1 mm,白色,购自豪圣工程有限公司。由于PHBV 材料只能在微生物膜的作用下分解并释放DOC[14-15,28],所以在使用前,PHBV材料在海水中活化10 d,使其能够自然挂膜,活化过程中进行充分曝气。
1.2 实验设计
凡纳滨对虾养殖实验在18个容积为500 L白色聚乙烯养殖水槽中进行。设置了6个不同处理组,其中,D1处理组仅添加PHBV,D2处理组仅添加枯草芽孢杆菌H1,而D3、D4和D5则在添加PHBV的基础上,分别添加枯草芽孢杆菌H1(D3)、枯草芽孢杆菌H1+盐单胞菌DN3组合(1∶1,D4)以及枯草芽孢杆菌H1+盐单胞菌DN3+短小芽孢杆菌BP-171组合(1∶1∶1,D5)。同时,以不添加PHBV和益生菌处理组作为对照(DZ)。每个处理组分别设置3个重复,每个重复随机放养120尾规格相似的对虾,对虾平均体质量为(2.26±0.02) g。
PHBV材料置于内径为10 cm,高35 cm的PVC塑料管中,PVC管内设置气石进行充气,不仅可通过充气充分搅动颗粒,还可通过充气产生的水流将缓释的碳源持续释放到水体中。PHBV材料装填完成后,用合适的纱网将塑料管两端覆盖,防止材料露出,并将整个装置置于相应的处理组养殖设施内。
整个养殖实验在青岛瑞滋海珍品发展有限公司16号车间进行,实验持续时间为9周。
1.3 日常管理
1.3.1 活菌的培养 将保藏的菌种接种于2216E液体培养基,在160 r/min、(28.0±1.0) ℃的条件下培养至对数期待用。经检测,此期每毫升菌液中含活菌1×109cfu。
1.3.2 养殖管理 实验期间,每日按照对虾总质量的5%投喂凡纳滨对虾基础饲料3次(7:00、12:00和18:00),并根据剩余饵料状况、对虾的体长和天气变化等情况,适度调整投饵量。每隔7 d向不同处理组均匀泼洒培养至适量浓度的菌液(活菌浓度约为1×109cfu·mL-1)。菌液由实验室自行制备,泼洒后使各处理组水体中的益生菌浓度约达到1×104cfu·mL-1。

图1 固体碳源PHBV缓释装置示意图Fig. 1 Diagram of PHBV slow release device for solid carbon source
1.4 样品采集及测定
1.4.1 生长指标的测定 分别在实验开始和结束时对各个处理组对虾进行计数和称重,并计算凡纳滨对虾特定成活率、饲料效率和特定生长率。各类生长指标计算公式如下:
成活率(Survival rate,SR)=Nt/N0×100% ;
饲料效率(Feed conversion ratio,FER)=
(Wt-W0)/Wf×100%;
特定生长率(Specific growth rate,SGR)=
(lnWt- lnW0)/t×100%。
式中:Nt为终末尾数;N0为初始尾数;Wf为每个网箱所投饲料总质量(g);Wt和W0分别为对虾的初体质量和末体质量(g),均为湿质量;t为实验天数(d)。
1.4.2 非特异性免疫酶活性的测定 实验结束后,每个养殖桶中随机抽取15尾对虾进行血清采集。用1 mL无菌注射器从凡纳滨对虾腹部血窦中缓慢抽取血淋巴置于1.5 mL无菌离心管中。经4 ℃静置过夜,5 000 r/min-1离心15 min取上清液,于-80 ℃冰箱中保存。
对虾血清中超氧化物歧化酶(SOD)、碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、溶菌酶(LZM)、总一氧化氮合酶(TNOS)和过氧化物酶(POD)活性,以南京建成生物工程研究所生产的相关试剂盒进行具体测定,参照试剂盒说明书进行操作。
1.4.3 水质指标测定 每周采集500 mL水样,当天送回实验室进行水质指标的测定。使用全自动间断化学分析仪(Clever Chem 380G,德国DeChem-Tech. GmbH公司),按照说明书进行操作,测定氨氮、硝酸氮、亚硝酸氮、总氮、可溶性活性磷酸盐和总磷的数据。同时,取1 mL水样用无菌生理盐水以10的倍数进行逐级稀释,最终取稀释倍数为105~109水样在2216E培养基上均匀涂布,28.0 ℃培养24 h后进行平板计数,确定水体中总菌数量。
1.5 数据处理和统计分析
实验结果用平均数±标准差(Mean±SD)的方式表示,数据使用SPSS 24.0分析软件中的单因素方差分析(ANOVA)和Duncan多重比较法进行差异显著性分析,P<0.05则表示为差异显著。
2 结果
2.1 添加益生菌和PHBV对凡纳滨对虾养殖水质的影响
2.1.1 实验期间水质指标 实验期间,水温在24和26 ℃之间波动,水中溶解氧一直高于7 mg·L-1。各处理组溶氧及pH与对照相比未见显著差异(P>0.05)。


表1 实验期间各水质参数的平均值±标准差Table 1 Each water quality parameter during the experiment(Mean±SD)


2.1.3 活性磷酸盐和总磷的变化 DZ组和D2组活性磷酸盐(SRP)浓度显著高于其他处理组(P<0.05),各处理组的活性磷酸盐浓度在0~42 d均呈现出上升趋势,42~56 d时期上升速率提高,在56 d之后可溶性活性磷酸盐均呈现下降趋势。在实验开始28 d后,对照组的活性磷酸盐浓度基本高于其他处理组。
各处理组中总磷(TP)的浓度变化趋势均呈现先上升后下降的趋势,均在42~56 d之间达到峰值,然后开始下降,与活性磷酸盐变化趋势基本一致,但实验前期(0~21 d)对照组的总磷浓度显著高于其他处理组(P<0.05),中后期与其他处理组差别不大。实验期间,各处理组与对照相比,总磷平均浓度未见显著差异(P>0.05)。

图3 活性磷酸盐(A)和总磷(B)在不同处理组中的浓度变化Fig. 3 Fluctuations of active phosphorus SPR(A) and TP(B)
2.2 添加益生菌和PHBV对凡纳滨对虾生长的影响
不同处理对虾生长情况如表2所示。可以看出,添加益生菌和PHBV可不同程度提高凡纳滨对虾的生长速度。其中,各处理组对虾末体质量均显著高于对照组(P<0.05),各处理组对虾的总质量显著高于对照组(P<0.05),而D3、D4和D5组对虾总质量则显著高于对照组和D1(P<0.05)。除D1组外,其他处理组的对虾成活率均显著高于对照组(P<0.05)。各处理组对虾特定生长率均显著高于对照组(P<0.05),但对虾饲料效率未见显著差异(P>0.05)。

表2 凡纳滨对虾的总质量、成活率、特定生长率和饲料效率Table 2 Gross weight, survival rate, specific growth rate, feed efficiency ratio of L. vannamei
2.3 添加益生菌和PHBV对凡纳滨对虾非特异性免疫的影响
图4所示分别为不同处理组和对照组凡纳滨对虾血清中超氧化物歧化酶(SOD)、碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、溶菌酶(LZM)、总一氧化氮合酶(TNOS)和过氧化物酶(POD)等非特异性免疫酶活性。由图4可知,在养殖过程中各处理组对虾血清ACP和LZM活性显著高于对照组(见图4A,图4C,P<0.05)。其中,以D5组的ACP活性最高,D2、D3和D5组LZM活性显著高于D1和DZ组(P<0.05)。D1组AKP活性与对照组相比差异不显著,其他处理组均显著高于对照组(见图4B,P<0.05),其中D4组的AKP活性最高。D1和D5组超氧化物歧化酶(SOD)活性与对照差异不显著,其他处理组均显著高于对照组(P<0.05)(见图4D)。各处理组TNOS酶活性与对照组相比未见显著差异(见图4E,P>0.05),除D4组外,各处理组过氧化物酶(POD)活性均显著高于对照组(见图4F,P<0.05)。
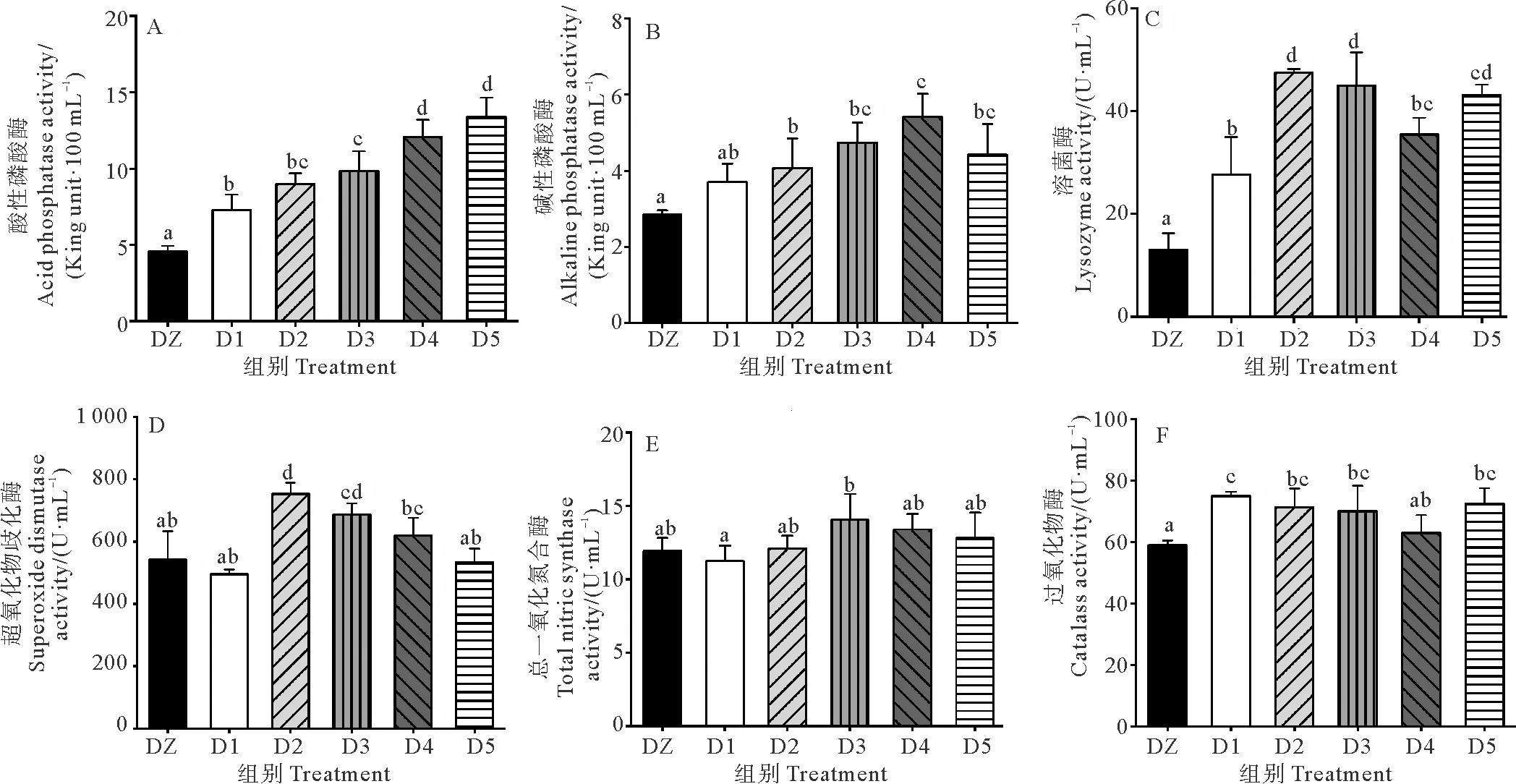
(图中不同字母的表示相互之间差异显著(P<0.05),数据以平均值±标准误表示,n=3。 The data with different letters mean significant differences between groups(P < 0.05). The data were expressed as mean ± SE, n=3.)
3 讨论
3.1 添加益生菌和PHBV对凡纳滨对虾养殖水体中氮和磷的影响
集约化水产养殖系统的主要水质问题之一是由残饵和粪便导致的水体中氮的大量积累问题,而部分氮的形态如氨氮及亚硝酸氮等,则直接对养殖动物具有直接的毒性作用[29]。研究表明,适宜的益生菌可以有效降低水体中氨氮等有害物质的浓度,从而改善水产动物的生存环境[30]。近年来,异养硝化-好氧反硝化生物脱氮技术已成为研究热点,但相关应用方面的研究主要集中在实验室小试阶段,中试以上规模的报道较少,且多以生物强化的手段为主,即将好氧反硝化菌(群)以菌剂的形式外源投加于生物反应器中,以期提高反应器的脱氮效能[31]。本研究所使用的菌株枯草芽孢杆菌H1、短小芽孢杆菌BP-171和盐单胞菌DN3均分离自水产养殖环境,在实验室研究中表现出了优异的脱氮性能[25-27]。在本研究中,添加枯草芽孢杆菌H1或同时添加PHBV和益生菌的各处理水体总氨氮、亚硝酸氮、硝酸氮和总氮的平均浓度均显著低于对照组。在研究期间,各处理组水体不同形态氮浓度动态变化有所差异。总体上看,各处理组氮浓度与对照相比,主要差异体现在实验的中、后期。添加益生菌和碳源各处理组的总氨氮和硝酸氮浓度均显著降低。其中,以单独加枯草芽孢杆菌H1的处理组(D2)效果最佳;而同时添加碳源和3种益生菌处理组(D5)水体中亚硝酸氮浓度最低。可以看出,尽管在养殖期间各处理组的降氮效果有所差异,但除了单独添加PHBV对亚硝酸氮去除作用不明显外,添加益生菌和碳源及其不同组合均可以有效地降低对虾养殖水体不同形态的氮浓度。但与单独添加枯草芽孢杆菌H1相比,3株菌等比例组合处理仅在亚硝酸氮处理能力上表现出了一定优势,如何进一步优化3株菌组合比例需要进一步的研究与验证。目前,关于异养硝化-好氧反硝化细菌在水产养殖水体应用的报道还很少见。从本研究看,尽管3株异养硝化-好氧反硝化细菌体现出了较好的降氮效果,但在实际养殖条件下的降氮效果与实验室研究[25-27]相比还存在一定的差异,这可能与实际养殖环境条件的复杂性有关。因此,异养硝化-好氧反硝化细菌在对虾养殖中的实际应用技术值得进一步深入研究。
一般来讲,异养菌的菌体成分需要必需氨基酸、糖类等有机物才能够合成,因此其生长需要在适宜的C/N中完成[32]。因此,理论上添加碳源可以促进对虾养殖水体中异养菌的生长,通过异养菌的同化作用,将水体中的无机氮转化为自身的生物量[33]。因此,在本研究中,添加PHBV处理组可能主要是通过异养菌同化作用降低水体氮浓度。而异养硝化-好氧反硝化细菌与PHBV的组合,则通过细菌的同化作用、硝化作用与反硝化作用共同加强了水体中氮的转化过程,降低了水体氮浓度。
在养殖系统中,磷的输入主要来自饲料和肥料,为沉积性循环元素,其利用率有待提高[34]。本研究中磷的主要输入为投饵,主要的利用途径为细菌和藻类,当然,部分磷也可以通过食物链被对虾利用。总体上看,添加益生菌和PHBV对各处理水体总磷浓度影响不大,但同时添加益生菌和PHBV可有效降低水体活性磷浓度,具体机制有待于进一步研究。
3.2 不同益生菌组合和PHBV对凡纳滨对虾生长的影响
研究表明,补充投喂益生菌可以通过补充消化酶、提高饲料效率、预防肠道菌群紊乱[35],进而促进水产养殖动物的生长速度。例如,Rahiman 等[36]将NL110 杆菌和NE17 弧菌用于罗氏沼虾(Macrobrachiumrosenbergii),对虾生长率、存活率及免疫水平均得到显著提高。刘翠玲等[37]将枯草芽孢杆菌添加至鲤(Cyprinuscarpio)饲料中进行投喂,发现可提高鲤的特定生长率。本研究中,通过水体添加方式,将益生菌和碳源应用到对虾养殖系统,各处理凡纳滨对虾的生长和产量均显著提高,但对饲料效率影响不大。这一作用可能与益生菌和碳源对养殖水质的改善直接相关。通过添加碳源提高养殖水体C/N,可促进与优化异养细菌的生长,也可起到改善水质的作用[38]。例如,添加PHBV材料使养殖水体中更易形成生物絮团,降低养殖水体中氮的浓度,从而提高凡纳滨对虾的成活率和产量[38]。Li等[39]也发现在养殖水体中添加PHBV和PBS作为碳源,可以显著促进罗非鱼生长。Ray等[40]的研究则表明,生物絮团系统通过降低养殖水体中亚硝态氮和氨氮的浓度,可提高凡纳滨对虾的成活率。
3.3 添加益生菌和PHBV对凡纳滨对虾非特异性免疫指标的影响
与脊椎动物不同,无脊椎动物高度依赖非特异性免疫,因为它们缺乏获得性免疫系统[41]。超氧化物歧化酶(SOD)、过氧化氢酶(POD)是甲壳动物体内重要的抗氧化酶,能够有效清除自由基、活性氧,防止生物分子方面的损伤,起到免疫抗病作用[42]。水产动物肠道微生物易受到所生活环境菌群的影响,进而对机体免疫等生理过程产生影响。本研究中,添加益生菌处理组对虾血清SOD和POD总体显著高于对照组,这与Liu等[43]和李军亮等[44]的结果相似。溶菌酶属于对虾体内的第一道防线,主要作用是溶解革兰氏阳性细菌[45]。本研究中添加益生菌处理对虾血清溶菌酶活性均显著高于对照组,这与Kewcharoen等[46]的结果相似。酸性磷酸酶和碱性磷酸酶,与生物体内物质摄取与转运直接相关,也是机体免疫抗病不可缺少的重要免疫酶[47]。本研究中,添加益生菌和PHBV均可显著提高对虾血清中酸性磷酸酶和碱性磷酸酶的活性,且提高幅度随添加益生菌种类增多而增加,这表明复合益生菌的效果可能比单一益生菌更显著。这一结果与胡毅等[48]在凡纳滨对虾中发现复合芽孢杆菌比单一芽孢杆菌有更好的添加效果相似。推测这可能是由于不同细菌在肠道微生物区系中占有不同的生态位,因而添加复合益生菌组比添加单一益生菌有更好的免疫及生长效果[49]。总一氧化氮合酶在机体免疫物质诱导下会释放出大量的NO,这些被释放的NO可参与到后续免疫反应中,从而对病原生物产生杀灭作用[50]。本研究中添加益生菌和PHBV对虾血清总一氧化氮合酶与对照组未见显著差异,这与常杰等[51]的结果有所不同,这可能由于对虾未受到弧菌等病原菌的感染,所以体内没有诱导出总一氧化氮合酶表达的免疫物质,使得总一氧化氮合酶的活性未出现差异。另外,碳源的添加可提高水体中的碳氮比,利用水体中的粪便、残饵形成生物絮团,这种生物絮团也可以被凡纳滨对虾摄食[52],生物絮团中富含维生素和多糖类等多种有益物质[53],这些物质被凡纳滨对虾摄取之后,也有助于对虾免疫力的提高。例如,Mansour等[54]发现生物絮团增加了罗非鱼(O.niloticus)SOD和POD活性,与本研究结果相似。
4 结语
水体中添加PHBV和异养硝化-好氧反硝化菌株枯草芽孢杆菌H1、短小芽孢杆菌BP-171以及盐单胞菌DN3的不同组合均可有效改善水质,提高了对虾的生长性能,并在一定程度上增强了对虾非特异免疫能力。总体比较而言,添加益生菌各处理优于仅添加PHBV处理,同时添加益生菌与PHBV对水体氮去除能力与仅添加枯草芽孢杆菌H1差异不大,但益生菌与PHBV的组合有助于提高对虾的生长性能。

