酶联免疫吸附试验检测血清中丙型肝炎病毒抗体灰区的复检结果分析
汤兴芳
摘 要:目的 评估酶联免疫吸附试验(ELISA)检测血清中丙型肝炎病毒抗体(抗-HCV抗体)灰区结果。方法 选择2017年1月~2020年1月期间于重庆市长寿区中医院采用ELISA检测血清抗-HCV结果呈灰区的135例患者所呈标本为研究样本,对处于灰区的样本选用化学发光微粒子免疫分析法(CMIA法)检测,并进行核酸检测(NAT)确认。统计分析ELISA检测结果呈灰区患者的CMIA及NAT复检阳性率。结果 抗-HCV单、双试剂(即同种试剂双孔复试)灰区的结果经CMIA、NAT复检后均能检出阳性结果,且抗-HCV单试剂灰区复检结果阳性标本检出率(即灰区样本复检结果呈阳性的标本例数/灰区样本总例数)高于双试剂灰区,NAT法阳性检出率更高,差异有统计学意义(P<0.05)。结论 ELISA法检测抗-HCV有一定的局限性,对处于灰区标本进行复检,有利于提高检出率,便于早期诊断和治疗。
关键词:酶联免疫吸附试验;丙型肝炎病毒抗体;灰区
中图分类号:R511 文献标识码:A 文章编号:1009-8011(2021)-13-0182-02
酶联免疫吸附试验(ELISA)是临床常用的丙型病毒性肝炎检测方法,但有研究指出,ELISA过程中存在多种影响因素,会影响检验结果的准确性,尤其是临界值附近结果,有时甚至会有同一实验室不同批次结果或是不同实验室试验结果不一致的现象[1-2]。对于部分丙肝“窗口期”感染患者,采用ELISA法检测血清中丙型肝炎病毒抗体(抗-HCV)易出现漏检、误诊等情况[3]。在这种情况下,使用ELISA获取的结果存在明显风险,有可能影响到疾病的诊断及治疗方案的合理选择,甚至延误病情,造成不良后果。本次研究通过对检测结果进行复检,评估分析ELISA检测血清中丙型肝炎病毒抗体(抗-HCV抗体)灰区结果。详细报告如下。
1 资料与方法
1.1 一般资料
选取重庆市长寿区中医院2017年1月~2020年1月期间采用ELISA检测血清抗-HCV抗体结果呈灰区的135例患者标本作为研究对象。其中男性67例,女性68例;年龄34~62岁,平均年龄(49.20±8.20)岁;病程3~11年,平均病程(6.79±2.40)年。研究经医院伦理委员会审核批准,患者均签署知情同意书。
1.2 纳排标准
纳入标准:①临床资料齐全;②无其他严重脏器功能损伤情况。
排除标准:①其他肝脏病变疾患者;②对研究知情不同意;③依从性低。
1.3 方法
仪器设备:丙型肝炎病毒抗体诊断试剂盒(化学发光法)(生产企业:日本希森美康)、丙型肝炎病毒核酸定量检测试剂盒(生产企业:湖南圣湘生物科技有限公司)、丙型肝炎抗体室间质评血清(生产企业:重庆临检中心)、CFX96荧光定量PCR仪(生产企业:伯乐公司)、HISCL-5000全自动化学发光免疫分析仪(生产企业:日本希森美康)。
在准备好仪器与试剂后,分别获取患者的血清,进行化学发光微粒子免疫分析法(CMIA法)检测以及核酸检测(NAT)。检测过程严格遵循检测试剂盒的说明书和临床检验操作SOP文件进行相关操作。
1.4 观察指标
ELISA检测结果呈灰区患者的CMIA及NAT复检阳性率。结果判定:①抗-HCV ELISA法检测:选择初筛样本0.8<血样测定吸光度值/临界值(S/CO)<1.0试验室检查结果显示为灰区。S/CO为0.7~3.0的样本采用同种试剂双孔复试,结果均为灰区的样本需进行复检,与单孔检测结果进行比较;②CMIA法检查:S/CO<1.0者为阴性;S/CO>1.0者为阳性。③HCV-RNA荧光定量聚合酶链反应(FQ-PCR)检测:阳性结果判断标准为>25 IU/mL[4]。复检阳性率=复检阳性标本例数/灰区样本例数×100%。
1.5 统计学处理
采用SPSS 21.0对数据进行统计分析。计量资料采用(x±s)表示,行t检验;计数资料采用[n(%)]表示,行χ2检验。P<0.05为差异有统计学意义。
2 结果
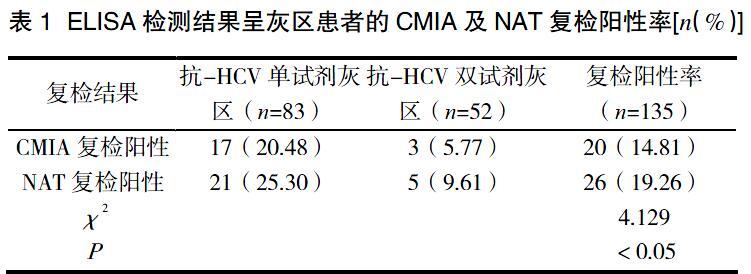
CMIA复检阳性20例,抗-HCV单试剂灰区CMIA复检阳性率高于双试剂灰区,差异存在统计学意义(χ2=5.484,P<0.05)。NAT復检阳性26例,抗-HCV单试剂灰区HCV-RNA检测阳性率高于双试剂灰区,差异存在统计学意义(χ2=5.059,P<0.05)。与CMIA法复检结果相比,NAT复检阳性检出率更高,差异存在统计学意义(χ2=4.129,P<0.05)。见表1。
3 讨论
丙型病毒性肝炎因感染丙型肝炎病毒(HCV)导致,以慢性肝脏损害为主,属于乙类传染病。丙型病毒性肝炎主要传播途径是血液传播,输血或血液透析过程中血液制品的污染是医院感染的主要原因。人群普遍易感,且被感染后产生的抗-HCV并非保护性抗体,痊愈后仍可再患。HCV是一种于1989年经分子克隆技术发现的具有较强传染性的病毒,主要通过性行为、血液、母婴途径传播。所致的丙型肝炎呈全球性分布,目前,全球范围内有1.8亿以上HCV携带者。该疾病进展缓慢,对人体肝脏的破坏极为隐匿,很多丙肝病毒感染患者的肝功能检查结果往往显示正常,容易造成误诊与漏诊,但是人体一旦感染丙肝病毒,容易转化成慢性肝炎并发展为肝硬化甚至肝细胞癌,不仅威胁患者的身体健康,还会威胁患者的生命安全。目前,体外免疫检测技术很多,且随着抗体制备和标记技术的提升,灵敏度和特异性都有了很大的提高,但ELISA作为一种传统经典的检测技术,是我国医学实验室用于检测感染性疾病抗体的常用方法,具有检测快速便捷、成本较低、获取结果速度快等优点。目前,一些血站、急救中心对于血液制品的管理与样本检测多采用ELISA法。ELISA法检测的基本原理为抗原、抗体的特异性反应,该方法快速、敏感、简便、易标准化、便捷,具有灵敏度和特异性高的优势。应用实践中,一些实验室应用工作临界值即设立“灰区”,将推荐的判定值下调,以达到防止弱阳性标本漏检的目的[5]。
本次研究选取近三年来重庆市长寿区中医院经ELISA检测的血清抗-HCV抗体结果呈灰区的135例患者血清标本作为研究对象,并进行化学发光法联合HCV抗原复检,并进行核酸检测(NAT)确认,对检测后的结果进行比较。结果显示,抗-HCV单、双试剂灰区结果经CMIA、NAT复检后均能检出阳性结果,抗-HCV单试剂灰区复检结果阳性标本检出率(即灰区样本复检结果呈阳性的标本例数/灰区样本总例数)高于双试剂灰区,并且NAT阳性检出率更高 (P<0.05)。可以认为,ELISA法对抗-HCV检测的结果存在一定范围内的偏差,需要方法上的改进和更新。但有研究提示[6],由于HCV-RNA在HCV感染的急性期、慢性轉换期或感染恢复期时难以被检出,单纯依靠NAT复检ELISA抗-HCV灰区仍然存在出现错误结果的风险。笔者认为,适当调整灰区设置,或采用FQ-PCR扩增、抗原检测等方法能够进一步矫正试验结果。
综上所述,采用ELISA法对抗-HCV进行检测有一定的局限性,对处于灰区的标本进行复检,能够有效提高检出率。一方面能够针对丙肝患者给予相应的早期诊断对于及时制定治疗方案有积极意义,另一方面能够减轻患者心理负担,同时避免医疗纠纷的发生。
参考文献
[1]吴汉钟,曾媛媛.无偿献血者梅毒抗体ELISA法阳性与TPPA确证比对分析[J].现代临床医学,2018,44(4):302-303.
[2]宋庆召.血液透析患者丙型肝炎病毒非输血感染的危险因素及其预防[J].医学新知杂志,2019,29(3):284-287.
[3]王瑞,葛红卫,黄力勤,等.使用相同抗-HCVELISA试剂的6家血站实验室灰区设定分析[J].中国输血杂志,2018,31(2):105-109.
[4]周军杰.核酸检测对酶联免疫吸附试验法检测乙型肝炎表面抗原、丙型肝炎病毒抗体结果呈灰区及弱反应性标本复检的必要性探讨[J].中国医学工程,2017,25(7):73-75.
[5]伊学军,翟建新.酶联免疫吸附试验与化学发光微粒子检查丙肝结果对比分析[J].中国社区医师,2016,32(19):111,114.
[6]严谨,徐磊,曾文娟.2种方法检测血清中抗-HCV灰区结果分析[J].临床血液学杂志(输血与检验),2017,30(3):464-467.

