花叶矢竹组培苗生根壮苗技术研究
高会彬,郑仁红,周国强,杨海芸,余 英
(1.宜宾林竹产业研究院,四川 宜宾644000;2.浙江农林大学亚热带森林培育国家重点实验室培育基地,浙江杭州311300)
花叶矢竹(Pseudosasa japonicaf.Akebonosuji)是矢竹(Pseudosasa japonica)的变型,秆型挺拔、叶片长披针形,叶片呈现白色、白绿相间条条纹、绿色等多种混合颜色,其条纹宽窄、长短、在叶片上的位置各不相同,这是竹子在自然界中秆色、叶色变异的典型特性,正是这种变异丰富了竹子的种类,也提高了观赏价值[1]。花叶矢竹作为一个代表性竹种,其独特在于其白叶在自然条件下能够逐渐恢复绿色,在组培条件下却保持花叶状态,这为竹子秆色叶色变异机理的研究提供了宝贵材料[2]。
竹子作为观赏植物,近年来,花叶、花秆、特型竹等受到越来越多的关注,在园林绿化中的应用也在逐年增加,花叶矢竹组培生根壮苗后可以为园林绿化、盆景创作等提供大量的种苗。丛生芽的生根诱导是竹类植物试管快繁成功的关键[1],丛生型竹类组织培养技术研究种多利用丛生芽的诱导方式[3-7],也有部分丛生竹和散生竹利用种子繁殖[8-10],菲白竹等混生竹也利用丛生芽诱导方式[11-12],研究发现外植体为茎段的花叶矢竹无菌苗能够自然生根[2],但是愈伤组织分化苗却不能直接生根,生根能力等并不清楚,因此,以愈伤组织分化苗为外植体,建立完善的组织培养技术体系,明确组培生根壮苗的条件,对进一步转基因和研究试管苗与传统繁殖竹苗叶色变化的差异有重要的意义。本文主要研究不同植物生长调节剂对花叶矢竹根的萌发、生长周期和生根效率的影响,优化筛选最佳生根壮苗的培养基,为花叶矢竹等观赏竹类在叶色变异的研究和园林绿化、美化环境等方面提供技术支撑。
1 材料与方法
1.1 材料培养
取材愈伤组织分化的花叶矢竹无菌苗,来自宜宾市林竹产业研究院组培室。实验前生长在无任何添加的MS基本培养基中,培养室温度(25±2)℃,每天光照周期16 h/8 h。
1.2 试验方法
1.2.1 取材 选择生长一致的花叶矢竹无菌苗,选取3-5个芽为一丛,剥去老叶等留取干净幼嫩的新芽作为试验材料。
1.2.2 生根壮苗单因素试验 以MS为基本培养基,研究不同浓度植物生长素NAA、IBA对生根壮苗的影响。各设5个浓度梯度,NAA浓度设置为0.2、0.5、1.0、2.0、4.0 mg·L-1;IBA的浓度设置为:0.2、0.5、1、3、5 mg·L-1;培养基中蔗糖30 g·L-1,gelrite 2.5 g·L-1,pH 5.8。每个处理接种20丛(20管,1丛/管),每隔2 d观察一次,培养4周后记录生根并观察记录生长情况。
1.2.3 生根壮苗正交试验 采用L9(33)正交设计(因素水平参见表1),探究植物激素交互对根诱导、壮苗的影响。基本培养基:MS,分别添加生长调节剂组合(表1),蔗糖30 g·L-1,gelrite 2.5 g·L-1,pH 5.8。每瓶接种1丛,每个处理20丛。培养4周后统计生根及增殖系数,观察记录生长情况。

表1 不同植物生长调节物质及浓度正交设计方案Tab.1 Orthogonal design scheme of various plant growth regulatory substances and concentrations
1.2.4 培养条件 光培养条件:温度(23±2)℃,光照2 600 LUX左右,16 h·d-1。
1.2.5 数据处理与分析 无菌苗生根培养接种后,每2 d观察根的萌动、芽生长、叶片颜色的变化,在4周的时候记录生根数,测量根长、芽长、芽苗生长状况、褐化程度等,相关数据计算公式如下:
生根率=生根管数/接种总管数×100%;平均根长=每管平均根长/生根总管数;芽增殖系数=每管芽数之和/接种总管数;平均新生芽长=每管平均芽长之和/抽芽总管数;褐化评价标准:0度:完全无褐色,基部呈绿色;1度:基部有轻微褐化,基部根绿色部分可见,纹理可见;2度:基部完全褐化,无绿色部分,纹理不可见;3度:基部完全褐化,培养基上面有枯叶现象;4度:基部完全褐化,培养基上面植株枯萎;实验数据用EXCEl统计后通过SPSS 22.0软件对进行方差分析,用ORIGIN软件作图。
2 结果与分析
2.1 不同浓度NAA对生根壮苗的影响
2.1.1 不同浓度NAA对生根诱导的影响 如表2所示,不同浓度NAA显著影响不定根生根数和生根长度。NAA 5个浓度处理不定根,培养30 d后,结果经过对比后表明,添加NAA花叶矢竹生根率均能达到80%及以上。浓度增加对不定根的诱导产生积极影响,生根率、平均根数随浓度增加呈现先上升后下降的趋势。在浓度为0.5、1.0 mg·L-1时生根率最大,为100%,根白色、细长,随浓度继续增加呈现下降趋势。浓度过低不利于不定根的诱导,平均根数较少,浓度过高对生根数量有抑制作用。当NAA浓度为1.0 mg·L-1时,平均根数最大,为8.1。生根长度为低浓度诱导效果明显。低浓度(0.2、0.5 mg·L-1)处理的根长约是高浓度根长的2倍,浓度为1.0、2.0、4.0 mg·L-1时根长相近。

表2 不同浓度的NAA对花叶矢竹试管苗生根诱导的影响Tab.2 Effects of different concentrations of NAA on rooting induction of Pseudosasa japonica f.akebonosuji plantlets
2.1.2 不同浓度NAA对壮苗的影响 不同浓度NAA对花叶矢竹增殖系数有显著影响。0.2 mg·L-1时达到最大,为8.5(表3)。低浓度(0.2、0.5、1.0 mg·L-1)新芽长势较好,明显优于高浓度(2.0、4.0 mg·L-1)。浓度0.5 mg·L-1植株长势最佳,总体芽抽长约为原芽长2倍。从增殖系数、平均新芽长以及长势看,NAA浓度0.2 mg·L-1时,壮苗效果最好。

表3 不同浓度NAA对壮苗的影响Tab.3 Effects of different concentrations of NAA on seedling strengthening
2.2 不同浓度IBA对生根壮苗的影响
结果显示(表4),IBA对花叶矢竹生根数、根长、新芽数、新芽长影响显著。但生根率普遍偏低,生根效果不好。随着IBA浓度的增加,生根率、平均生根数量都有所增加,生根率最高可达70%,平均根数在浓度为3.0 mg·L-1达到最大,达3.15。但是高质量浓度的IBA培养基中花叶矢竹的根部较膨大,为畸形根系。

图1 不同浓度NAA花叶矢竹芽苗生长情况Fig.1 Growth of shoots of Pseudosasa japonica f.akebonosuji at different concentrations of NAA

表4 不同浓度IBA对生根及长势的影响Tab.4 Effects of different concentrations of IBA on rooting and growth

图2 不同浓度IBA花叶矢竹长势、生根情况Fig.2 Growth and rooting conditions of Pseudosasa japonica f.akebonosuji with different concentrations of IBA
IBA浓度0.2 mg·L-1时,增殖系数最大,达12.5,芽苗绿色,长势好。浓度0.2、0.5、1.0、3.0 mg·L-1时,叶片黄绿色,芽翠绿色,芽抽长,增殖系数较大。在IBA浓度为5.0 mg·L-1时,芽无抽长,增殖系数小植株枯黄长势差。
2.3 不同浓度IBA对生根周期的影响
由图3、图4可知,NAA、IBA浓度对生根周期有影响。不定根萌动周期随着NAA浓度的增加,呈现先缩短后增长的趋势,随着时间的增长,萌发率增长趋势减缓。NAA浓度0.5 mg·L-1时周期最短,生根率15 d达80%。而浓度过低或者过高时,不定根的萌动周期较长,需要30 d,生根率达80%以上。由图表可以看出,浓度0.5、1.0、2.0 mg·L-1生根率均能达到100%,但周期随浓度增加逐渐变长,浓度1.0、2.0 mg·L-1的周期一致,在4.0 mg·L-1时萌动周期最长,15 d时没有萌动迹象,在30 d左右时生根率达到85%。生根率在30 d后随着时间增加变化不大。

图3 NAA不同浓度、不同周期间生根率Fig.3 Rooting rate at different NAA concentrations for various duration
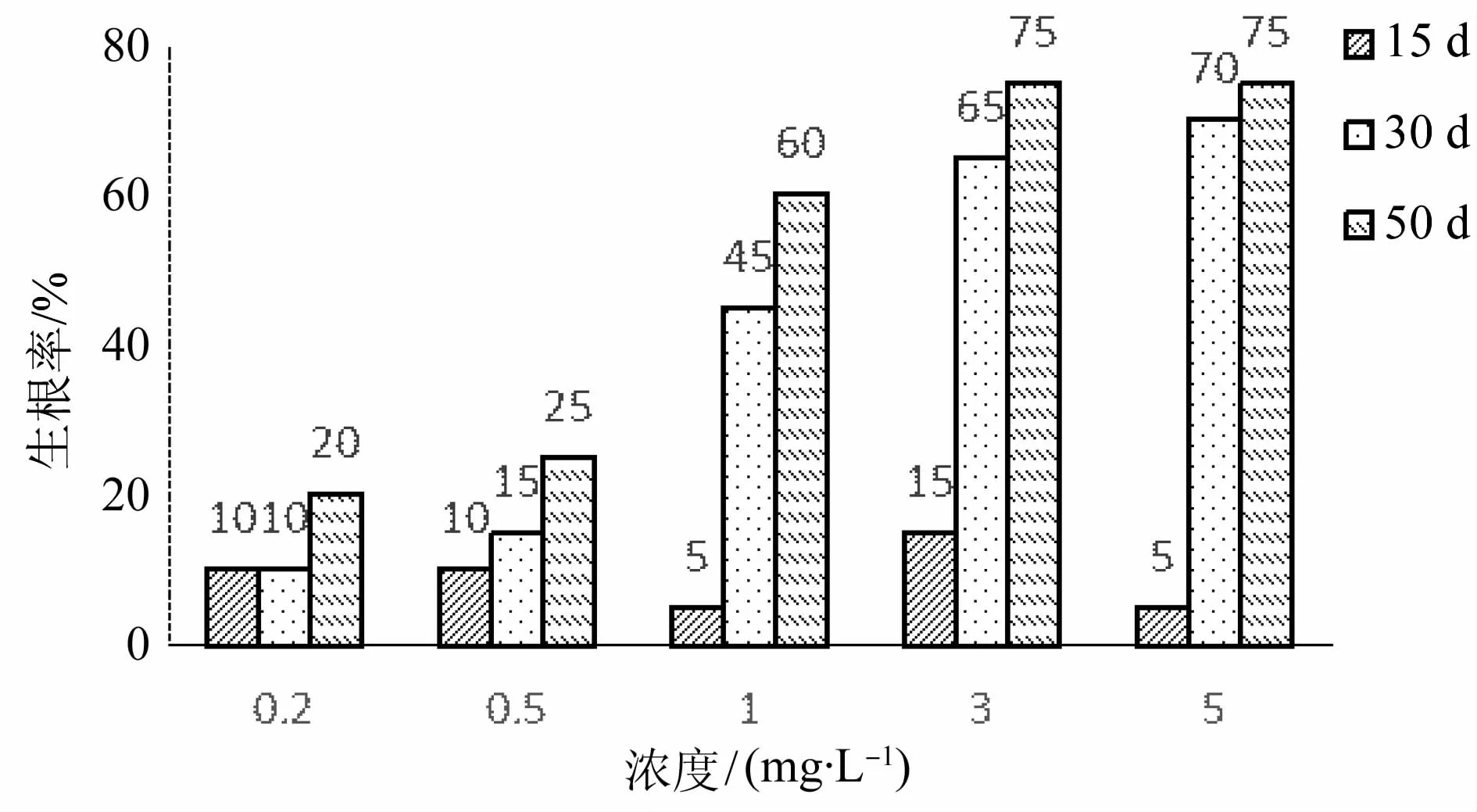
图4 不同浓度IBA、不同生长周期下生根率Fig.4 Rooting rate at different IBA concentrations for various duration
添加IBA培养15 d,浓度对生根率影响不成规律。培养时间延长,生根率随着IBA浓度的增加,呈上升趋势,到3.0 mg·L-1时达到最大后,浓度再升高趋势减缓。说明IBA诱导生根周期较长。浓度低于1.0 mg·L-1时生根率低,高于1.0 mg·L-1时,生根率最高可达75%。
2.4 不同植物生长调节物质组合对生根壮苗的影响
如表5、6,植物生长调节剂组合诱导花叶矢竹生根实验中,NAA对新芽长有显著影响,对新芽数没有显著影响;而IBA、6-BA对芽长、新芽数都没有显著影响。

表5 不同浓度IBA对芽长方差分析Tab.5 ANOVA of different concentrations of IBA on bud length

表6 不同浓度IBA对新芽数方差分析Tab.6 ANOVA of different concentrations of IBA on new bud number
结果表明(表7),生根率以编号2处理效果最佳,达70%,平均根长0.4 cm,小于单因素NNA 2号处理0.955 cm。3-9号处理培养基褐化严重,从培养基、芽苗基部褐化程度可以看出,随着6-BA浓度增加培养基、基部褐化程度逐渐加重。在新芽长度指标上仅NAA具有显著性差异,在新芽数指标上,NAA、IBA、BA均无显著性差异。当NAA浓度增加,新芽长呈递减趋势,与单因素NNA实验结果相符。

表7 正交实验中不同种类与浓度的植物生长调节物质对生根壮苗及长势的影响Tab.7 Effects of different types and concentrations of plant growth regulatory substances on rooting and seedling growth in the orthogonal experiment

图5 正交实验9个处理生长情况Fig.5 Growth under orthogonal experiments of 9 treatments
9种植物激素组合处理对花叶矢竹生根有一定的影响,但生根率、增值系数都较单独添加NAA、IBA时低,长势上叶片发黄、枯萎。总体来看,9种处理对生根诱导没有积极影响,试验所设计激素浓度组合生根壮苗效果均不及单独添加NAA或IBA。
2.5 活性炭对花叶矢竹生根壮苗的影响
MS+NAA 0.5 mg·L-1培养基添加不同浓度活性炭,结果表明:添加活性炭会抑制生根,单独添加NAA生根率可达100%,而增加活性炭培养4周后,花叶矢竹不生根,新增芽数及芽长都较不添加活性炭时低。

表8 不同活性炭浓度对生根壮苗的影响Tab.8 Effects of different activated carbon concentrations on rooting and seedling strengthening
2.6 不同浓度糖对花叶矢竹生根壮苗的影响
糖对花叶矢竹生根壮苗影响不显著。在MS+NAA 0.5 mg·L-1的培养基中添加不同浓度的糖,其增殖系数、芽长、根数、根长、生根率有差异。根据长势观察添加糖的含量在30 g·L-1时芽苗较粗壮,长势较好。
2.7 不同浓度激素单独添加对生根壮苗的影响
BA、TDZ均对芽增殖、芽长、根长影响不显著,对生根数量有显著性影响。随着浓度的升高,根数成上升趋势,在浓度为0.05 mg·L-1时,平均生根数量达到最高,0.9根。生根率没有呈现规律,在浓度0.01 mg·L-1时,达90%。TDZ在浓度0.005 mg·L-1平均根数达到0.3根,随着浓度的继续增加,平均根数保持在0.3根。生根率随着TDZ浓度的增加呈现出下降的趋势。
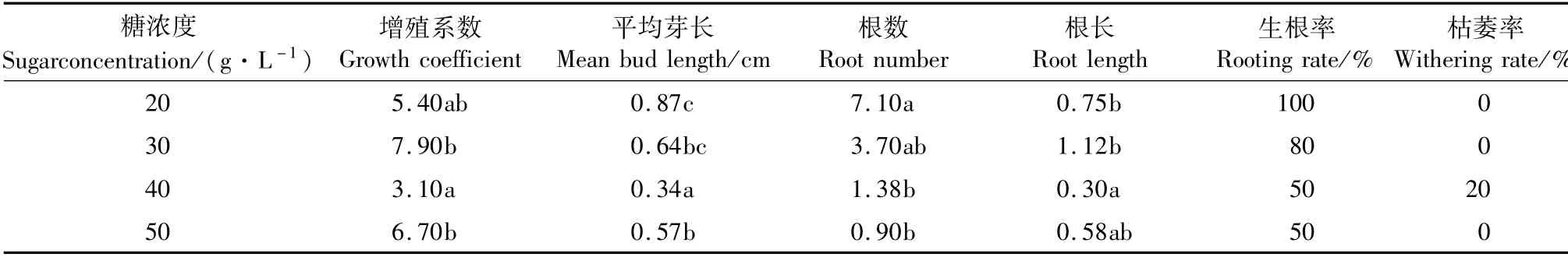
表9 不同浓度糖对生根壮苗的影响Tab.9 Effects of different concentrations of sugar on rooting s rooting and seedling strengthening

表10 不同浓度激素单独添加对生根壮苗的影响Tab.10 Effects of different concentrations of hormones on rooting and seedling strengthening
2.8 不同浓度组合植物激素对花叶矢竹壮苗的影响
组合添加6-BA+ZT对芽增殖、芽长、根长影响不显著,对平均根数有显著性影响。平均根长、生根率都随着组合激素中6-BA浓度的增加而上升,在6-BA浓度0.05 mg·L-1+ZT 0.5 mg·L-1时,数值达到最大,平均根长0.25 cm、生根率50%。

表11 不同浓度组合植物激素对壮苗的影响Tab.11 Effects of different concentration combinations of plant hormones on seedling strengthing
3 结论与讨论
3.1 NAA促进花叶矢竹生根,IBA对壮苗有促进作用
植物不定根原基发生和发育依赖于多种因子,尤其是低温和生长素起关键作用[13]。NAA、IBA是竹类植物生根培养常用激素,添加外源生长素,刺激植物体内激素平衡转向根萌发的方向[14-15]。本研究中,NAA对花叶矢竹生根影响显著,浓度0.5 mg·L-1时,根诱导周期最短,培养30 d,生根率达到100%;培养50 d后,根长均达到练苗要求,浓度过高或过低都不利于根的诱导,持续观察中,单独添加NAA花叶矢竹芽苗以及基部可以维持90 d不褐化;添加IBA培养30 d,生根率最高只有70%,根长较长,根数较少。基部褐化严重。随着IBA浓度增加,根有加粗现象,但生长趋势表现逐渐衰退,浓度5.0 mg·L-1时根部膨大畸形,但是从壮苗角度考虑,添加低浓度(0.2、0.5 mg·L-1)IBA利于花叶矢竹芽苗生长。
在NAA生根培养基中添加活性炭、6-BA、TDZ对花叶矢竹生根壮苗均有抑制作用。糖添加30 g·L-1时芽苗生长状态最好,芽较粗壮。这与高明远研究中可溶性糖提高可降低渗透势,稳定细胞膜结构,利于光合作用有关[16]。
3.2 不同发生途径的芽苗生根能力不同
有研究表明,适当添加低浓度的BA有利于竹子无菌苗芽苗的生长与生根[17],但本研究中,IBA 1.0 mg·L-1+6-BA 0.3 mg·L-1+NAA 1.0 mg·L-1,生根率最高70%,长势好,而其他处理生根效果并不理想,生根率低、芽苗生长长势差,基部褐化严重,这可能与无菌芽苗来源于愈伤组织分化苗、以及基因型有关,竹子本身萌蘖和生根能力都比较强,并不需要过多的外源激素刺激和诱导,过多会对芽苗生长产生抑制。在本课题组前期茎段侧芽无菌萌发研究中,当生长素与细胞分裂素组合诱导增殖生长后,转移到无激素添加的MS培养基中会直接生根[2],根的形态与芽苗形态相关,芽苗粗壮时根数较为粗壮、纤维化程度高,而愈伤组织分化的芽苗幼嫩程度高,根多而细。
3.3 问题与展望
在接种10 d内,发现严重的芽苗黄叶枯萎现象,除了受到植物生长调节物质影响外,也可能是由于首次使用封口膜对试管进行封口,膜透气孔径过大,导致试管内水分蒸发过快,芽苗失水。
竹子组培苗随着继代次数的增多,会出现丛芽增殖率下降、长势变差等现象[18]。花叶矢竹在生根壮苗过程中,芽苗的长势变差,这可能与试验材料是采用的实验室内多次继代的无菌无菌苗有关。

