双能量钙图/虚拟去钙诊断模型在颅内出血与钙化灶鉴别诊断中的价值
修超,于洋,姜倩男,王贺,林锐,张铎
北华大学附属医院 a.医学影像中心;b.神经外科,吉林 吉林 132011
引言
脑出血全球发病率为12~15/10万人每年,是致死率、致残率极高的脑部疾病[1-3]。2019年《中国脑出血诊断指南》中指出在我国脑出血占脑卒中比例为18.8%~47.6%[4],并且这一数值在老年人群中尤为显著,且呈逐年增多趋势。脑出血发病凶险,发病30 d的病死率高达35%~52%,仅有约20%的患者在6个月后能够恢复生活自理能力,给医疗资源以及患者家庭都带来了沉重的负担。
对于急性疑似脑出血的患者,进入脑卒中绿色通道后首先推荐进行常规CT检查。CT平扫对于发现颅内出血灶具有很高的敏感性,被AIS指南列为I-推荐等级,A证据等级影像检查手段[5]。然而在老年人群中,早期微出血与普遍存在的颅内微小钙化灶在CT图像上均呈现中等密度,对鉴别诊断造成了一定难度。虽然通过病史、病灶位置、与解剖结构关系以及影像表现可以做出初步区分,但是混淆以及误判断依然存在。因此,对于疑似脑卒中患者更快、更早明确病因的诊断方法非常重要,同时对后续治疗方法以及临床护理路径的选择也具有重大指导意义。
以往研究表明双能量CT成像有助于解决这一难题。基于高低kV获得的双能量CT图像可以对物质成分进行分析,获得钙图以及虚拟去钙图,进而定性、定量地评估微小钙化灶与出血灶的不同表现,提高鉴别诊断效能。早期研究取得了很好的结果与表现[6-12],但是某些问题仍需要解决:① 微出血病灶的鉴别诊断是目前CT研究的盲区,传统研究受到测量方法以及对图像分辨率的考虑将微小病灶排除在研究范围之外,然而在临床上早期微小脑实质内病灶才是分析研究的重点,虽然磁共振T2*、SWI成像在此方面表现更好,但是检查时间过长、患者禁忌症等原因导致其在临床开展有限[13-14];② 前期研究普遍采用最大层面法提取病灶感兴趣区域,分析影像学表现,并设定定量分类鉴别模型阈值。这种方式受到测量者主观人为选择因素影响,面临在使用过程中引入主观偏倚以及测量误差的问题。因此针对微出血灶病灶需要更为合理有效的分析方法。
本研究中,回顾性收集我院疑似脑出血患者的双能量颅脑平扫CT资料,利用第三方三维病灶分割工具对颅内中等密度病灶进行自动的提取和划分;并针对病灶大小进行亚组分析,重新建立基于双能量钙图以及虚拟去钙图的定量鉴别诊断模型,相关研究鲜有报道。我们首次采用此方法对脑出血患者进行研究,以期其对临床小钙化灶与出血灶的鉴别诊断提供有利帮助。
1 材料与方法
1.1 患者的纳入及分组
本实验为临床诊断研究类型,实验中回顾性地收集了我院自2016年3月至2019年12月卒中中心收录的急诊患者157名,详见图1。纳入标准:① 怀疑脑出血的患者;② 基线扫描采用双源双能量进行CT平扫,发现疑似高密度病灶;③ 病灶的CT值<100 HU;④ 有MRI或者随访对照的标准。排除标准:① 无MRI以及随访对照;② CT图像质量不满足诊断要求。所有检查项目均取得患者及其家属知情同意书,并通过本院伦理委员会批准。

图1 患者的纳入以及分组情况
1.2 图像采集和分析方法
所有患者均采用西门子第二代双源Somaton Definition Flash进行扫描,kV选择80 kV与Sn140 kV(带能谱纯化技术的双能量扫描模式);管电流使用CARE Dose4D自动调节技术,其中参考管电流设为300 mAs。高低能量图像分别重建并存储在PACS系统中,图像的重建层厚为0.75 mm,重建图像间隔为0.5 mm。同时,高低能量图像按照0.4的融合比例进行线性融合形成混合120 kV图像(模拟120 kV的扫描数据)。所有重建利用J37f软组织重建卷积核以及SAFIRE迭代重建技术(迭代强度为2)[15-17]。
高低能量图像传输到西门子Syngo VIA(version VA48A,西门子医疗)后处理工作站,根据双能量扫描下三物质重构原理,对钙图以及虚拟去钙图进行重构,并分别定性、定量分析钙以及虚拟去钙后病灶的影像表现。实验中具体处理方法通过利用“脑出血”应用修改基物质以及计算斜率获得(修改后的斜率为1.44),利用第三方开源3D Slicer分析工具对病灶进行基于阈值的半自动三维分割,并自动获得其平均CT值与在双能量钙图/虚拟去钙图下的测量值,详见图2。

图2 利用第三方软件实现对病灶的三维分割、显示与t测量
1.3 统计学分析
本实验以病灶为最小研究单位,连续性变量以平均数±标准差表示,等级资料以中位数与分位距表示。利用随机分配方法将所有病灶分为训练组与测试组。利用Studentt与卡方检验对两组间基线资料差异性进行分析。在等效120 kV图像下以及钙图/虚拟去钙图上对病灶数值进行测量,利用ROC分析方法比较基于常规CT值以及基于钙图/虚拟去钙值诊断的诊断效能,并获得最佳分类钙化灶与出血灶的阈值。
主观评估由两位分别有7年以及9年神经影像诊断经验医生对“等效120 kV图像+分类模型”和“双能量钙图/虚拟钙图+分类模型”进行5分值主观评估。评估标准为:-2为明确钙化灶,-1为疑似钙化灶,0为无法确认,1为疑似出血灶,2为明确出血灶。观察者在评审过程中没有患者的基本信息、基线资料及其他参考资料,并且两个观察者之间互相独立。
2 结果
2.1 患者基本资料与基线分析
研究中共回顾157例我院卒中中心就诊的患者,其中男89名,女68名,平均年龄(63.6±5.9)岁。患者行双能量CT扫描共收集得到189例疑似病灶,利用随机数分类方法以1:1的比例对所有病灶进行划分,训练集94例,测试集95例,两组间基线资料及比较分析结果如表1所示。

表1 研究对象基线资料情况
2.2 基于CT值与双能量测量值的模型
根据随访金标准在训练集中分别针对CT值以及钙图/虚拟去钙测量值建立逻辑回归的分类模型。如表2所示,基于CT值的逻辑回归模型CT值的OR值为1.095,具有一定的区分能力,准确率为77.8%,在训练集中的假阳、假阴、真阳、真阴分别为 17、0、16、61;敏感度为 1(95%CI:0.759~1),特异度为 0.782(95%CI:0.671~0.864),阳性预测值为0.485(95%CI:0.312~0.661),阴性预测值为1(95%CI:0.926~1);模型拟合优度Hosmer&Lemeshow检验χ2=11.691,P=0.166。基于钙图/虚拟去钙测量值的逻辑回归模型中,钙图与虚拟去钙测量值的OR值分别为1.301和0.764,区分钙化灶与出血灶的准确性为97.0%。在训练集中的假阳、假阴、真阳、真阴分别为0、3、33、58;敏感度、特异度分别为0.917(95%CI:0.764~0.978)与1(95%CI:0.922~1);阳性预测值与阴性预测值分别为1(95%CI:0.870~1)和 0.951(95%CI:0.854~0.987);拟合优度检验χ2=0.238,P>0.999。

表2 基于CT值以及钙图/虚拟去钙图的模型参数
两个逻辑回归模型诊断效能ROC分析结果如图3所示。利用CT值进行分析,逻辑回归分类模型的AUC曲线下面积为0.718(95%CI:0.616~0.806),而利用钙图/虚拟去钙获得AUC曲线下面积为0.995(95%CI:0.951~1.000)。两种方法的Delong检测值为z=4.335,P<0.001。
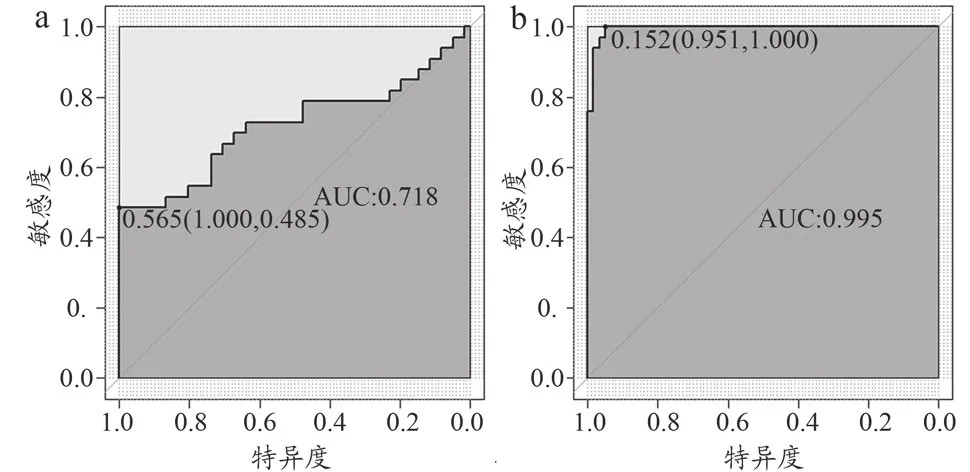
图3 训练集中诊断模型区分钙化灶与出血灶的ROC曲线分析
2.3 测试集的分析结果
在测试集中利用之前获得的逻辑回归模型以及最佳阈值对所有病灶进行鉴别诊断验证。以准确性作为衡量的标准,基于CT值的逻辑回归模型最佳阈值选取0.565,模型预测得分小于阈值为出血灶,大于阈值为钙化灶;基于钙图/虚拟去钙的逻辑回归模型最佳阈值选取为0.152,模型预测得分小于阈值为出血灶,大于阈值为钙化灶。利用此阈值对测试集中数据进行诊断结果,见表3。
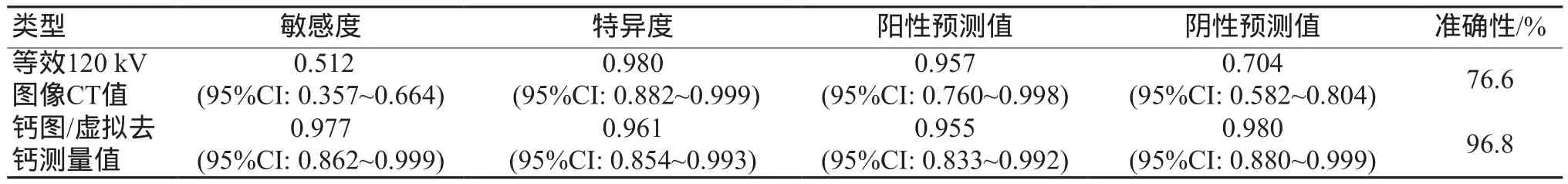
表3 基于CT值与钙图/虚拟去钙测量值模型的预测结果
基于CT值的模型AUC曲线下面积为0.817(95%CI:0.724~0.890),而利用钙图/虚拟去钙获得AUC曲线下面积为0.994(95%CI:0.951~1.000)。两种方法的Delong检测值为z=3.676,P=0.0002,见图4。

图4 测试集中诊断模型区分钙化灶与出血灶的ROC曲线分析
2.4 主观评估结果
两位影像医生分别采用CT图像结合分析模型、钙图/虚拟去钙图像结合分析模型对测试集数据进行了主观判断。按照五分制评估标准,明确及高度疑似被认定为可以正确提供诊断信息,错误疑似或错误分类被认定为错误判断,由此得出两位影像医生的主观评估结果,见图5。两位观察者基于CT图像诊断的评估得分具有高度一致性,Kappa分析值为0.831,P<0.001。对缺血灶的判断要好于对钙化灶的鉴别,在43例钙化灶中错误地分类或仅凭CT图像无法给出明确的病灶分别为15例和16例,远远高于对缺血灶的判断。

图5 对测试集数据的主观诊断结果
两位观察者基于双能量CT图像对病灶的类型都给出了准确的判断,观察者之间的Kappa值为0.948,P<0.001,高度一致。同时,对于病灶的诊断确信度也高于基于CT图像的诊断结果,在94例病灶中,明确诊断(五分制得分为-2或2)的病例数比例分别为75、78,远远高于对照组基于CT值的诊断结果(观察者1为63例,观察者2为65例),两者之间具有统计学差异。病例展示如图6所示。

图6 病例展示
2.5 基于病灶大小的亚组分析结果
测试集94例病灶中共有28例病灶的最大直径小于5 mm,占比29.5%。按病灶大小进行划分,两组虚拟 120 kV的CT值分别为(69.4±15.6)vs.(66.2±16.4)(t=0.888,P=0.377),钙图/虚拟去钙的测量值分别为[(21.87±23.99)/(44.59±18.90)]vs.[(18.16±27.21)/(45.52±19.40)],两组间t检验同样不具有统计学差异(钙图t=0.625,P=0.533,虚拟去钙t=-0.215,P=0.830)。<5 mm亚组与>5 mm亚组分别基于CT值以及钙图/虚拟去钙的诊断结果如表4所示。在病灶直径<5 mm亚组中,基于CT值诊断的敏感性、特异性分别为0.5(95%CI:0.240~0.760)和1(95%CI:0.747~1);基于钙图/虚拟去钙的诊断敏感度、特异度分别为1(95%CI:0.732~1)和0.867(95%CI:0.584~0.977)。对于病灶直径>5 mm亚组,基于CT值诊断的敏感性、特异性分别为0.933(95%CI:0.660~0.997)和0.706(95%CI:0.560~0.821);基于钙图/虚拟去钙的诊断敏感度、特异度分别为1(95%CI:0.850~1)和0.973(95%CI:0.842~0.999)。诊断敏感度、特异度在<5 mm与>5 mm亚组中不存在统计学差异。

表4 基于病灶大小的亚组分析结果[n(%)]
3 讨论
中高密度钙化灶与缺血灶的鉴别诊断一直是困扰临床的难题[18],尤其对于微小病灶来说鉴别难度更大。基于此,本研究针对病灶大小的亚组进行了分析,结果显示:基于CT值的预测结果受病灶大小影响较大,而采用了全新的基于钙图/虚拟去钙的诊断方法,没有受到病灶大小的影响。本研究建立了全新的三维病灶分析模型,更有益于反映病灶的整体情况,同时消除传统最大截面分析方法在感兴趣区域选择过程中的主观偏倚和测量误差。之前的体外模体研究以及临床研究已经证实双能量CT扫描在区分钙质和出血方面的可行性,双能量扫描分别采用高低两个kV的球管对患处进行扫描,由于物质在不同kV下CT值的变化趋势各不相同,因此可以有效地区分出常规120 kV扫描下无法鉴别的衰减值相近的物体[19]。尤其在急诊科脑卒中患者中,对于提高钙质与出血的鉴别诊断、提升医生的诊断准确度与诊断信心有很大的帮助,可以有效改善患者继续监测以及短期随访成像的规划安排。然而前期研究中[20],<5 mm病灶因为无法准确获得测量值以及图像分辨率而被排除在研究之外,但这类微出血会引起多种临床表现,尤其是有认知障碍、脑卒中、增加卒中后抑郁的风险。因此,早期分辨脑微出血对于明确患者治疗路径选择有重要帮助。本研究利用的三维病灶分析弥补了以往研究无法分析微小病灶(直径<5 mm)的不足,且所建立的诊断模型可以应用于不同大小的病灶之中,其诊断准确性没有任何差异,可以对早期的脑微出血与钙化灶进行鉴别诊断。当然本研究还有很多不足之处:本研究是单中心回顾性研究,并且受到门诊患者数量、金标准对照以及纳入排除标准的限制,本研究纳入的患者数量还需要进一步扩充。
4 结论
本研究利用双源双能量扫描获得钙图/虚拟去钙图像,进而对病灶物质成分进行分析,建立分类预测模型。此方法可以大幅提升出血灶与钙化灶的诊断能力,降低误诊率,提升医生的诊断信心与脑卒中绿色通道的工作效率。