男性低位直肠癌经自然腔道取标本手术的疗效观察
吴晓华,欧文权,王 健,杨伟峰,黄 兴
(福建医科大学附属南平第一医院普外科,福建 南平 353000)
直肠癌是中国发病率较高的肠道来源恶性肿瘤,癌灶与肛缘的距离小于5 cm定义为低位直肠癌[1],自从全直肠系膜切除术广泛开展实施,直肠癌手术之后的局部复发率明显下降[2],切除肿瘤标本的质量是直肠癌局部复发的重要影响因素。一些男性直肠癌患者由于自身的骨盆较狭窄,会明显影响术区视野的显露,这种困扰在低位直肠癌患者中更甚,有时不能保证肿瘤远端足够的阴性手术切缘,并且在患者腹部需要采取辅助切口,患者术后伤口疼痛以及感染率高。经腹腔镜下游离直肠及其系膜,然后行经自然腔道取标本手术(natural orifice specimen extraction surgery,NOSES),不仅无需腹部多余切口,并且做到了完全直视下离断直肠近端及远端,但该术式应用于男性低位直肠癌的临床效果及安全性目前尚未见报道,本文主要探讨NOSES在男性低位直肠癌中的治疗效果,以期为该病的治疗提供参考。
1 资料与方法
1.1 临床资料
选取2015年1月至2017年12月福建医科大学附属南平第一医院收治的男性低位直肠癌患者56例,按照随机数字表法将其分为观察组和对照组,每组28例。观察组行NOSES,对照组行腹腔镜下直肠癌前切除术。2组患者年龄、肿瘤直径、肿瘤与肛缘的距离、BMI、术前CEA水平、术前CA199水平等临床资料比较,差异无统计学意义(P>0.05),见表1。纳入标准:①术前经肠镜及病理检查确诊为直肠癌;②肿瘤与肛缘的距离小于5 cm,肿瘤直径小于4 cm,侵犯深度T1~T3期,肿瘤小于1/2环腔;③肛门指检时肿瘤基底部活动良好;④患者一般情况良好,术前相关检查提示无腹腔镜手术禁忌。排除标准:①肿瘤占据范围超过直肠1/2环腔;②肿瘤引起消化道梗阻、消化道穿孔等需急诊手术;③有开腹手术史;④T3期有新辅助治疗意愿;⑤直肠癌合并远处转移(如肝、肺等);⑥不能耐受腹腔镜手术;⑦BMI>30 kg·m-2。手术均由同一治疗组的医师完成,且通过我院伦理委员会审查(2016060001)。

表1 患者临床资料比较(n=28)
1.2 方法
2组患者术前1 d晚上均予以磷酸钠盐口服溶液或者甘露醇行肠道准备,麻醉方式为全身麻醉。
观察组行NOSES。采取仰卧头低足高截石位。于脐上1 cm处置入1个10 mm的Trocar作为观察孔,建立CO2气腹,将CO2压力维持在12~14 mmHg,置入腹腔镜后探查肿瘤形态、大小以及有无远处转移。于右麦氏点置入1个12 mm的Trocar作为主刀操作孔,于左麦氏点和左右腹直肌外缘(平脐)分别置入5 mm Trocar,置入Trocar后分别引入分离钳和超声刀。按全直肠系膜切除术(total mesorectal excision,TME)原则将直肠及系膜以超声刀分离至肿瘤下缘5 cm或盆底,以腹腔镜切割吻合器在距肿瘤10~15 cm处的近端离断结肠(图1a)。1名助手用稀碘伏将肛门反复消毒后,充分扩肛,以卵圆钳将乙状结肠及含肿瘤直肠外翻拖出到肛门外(图1b),拖出后将乙状结肠端切开,主刀将裁剪好的塑料保护套(需根据拖出肠段的长度裁剪保护套的长度,至少要长于拖出肠段5 cm,保护套的远端打活结)由12 mm的Trocar放入腹腔,站在肛门侧的助手经切开的肠段将保护套拖出并松开活结,由保护套将一次性使用管型吻合器(28.5 mm)的钉座放入腹腔,近端结肠断端以4号线荷包缝合。助手直视下测量肿瘤病灶的远端切缘距离,确保肿瘤远端切缘与肿瘤病灶下缘的距离大于1 cm,用一次性直线型切割吻合器在肿瘤远端切断拖出的肠段(图1c)。腹腔镜下完成直肠残端与结肠吻合(图1d);盆腔置入引流管1根,由右下腹12 mm的Trocar引出,缝合各Trocar孔。
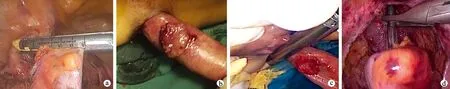
a:距肿瘤10~15 cm处的近端离断结肠;b:将乙状结肠及含肿瘤直肠外翻拖出到肛门外;c:直视下自肿瘤远端切断拖出的肠段;d:直肠残端与结肠吻合
对照组行腹腔镜下直肠癌前切除术,采取仰卧头低足高截石位。腹腔镜下分离直肠至肛提肌平面,将直肠远端预断离部“裸化”,于腹腔镜下使用直线型切割吻合器于肿瘤病灶下缘2 cm处切断“裸化”处。取下腹部长4~6 cm的正中切口,切口保护套保护切口后取出带肿瘤的近端肠管,切除肿瘤病灶近端的肠管10~15 cm,荷包缝合近断端后置入管型吻合器(28.5 mm)的钉座,还纳腹腔,重新建立气腹。助手扩肛并消毒肛门后在腹腔镜直视下经肛门缓慢放入管型吻合器,完成吻合,吻合口必须无张力及扭曲。
1.3 观察指标
观察指标:①手术情况,包括手术时间、术中出血量、淋巴结清扫数目、阳性淋巴结个数、远端切缘距离、预防性造口情况;②术后住院期间及随访情况,包括住院费用、肠功能恢复时间、住院时间、术后引流量、肠梗阻发生率、下肢深静脉血栓发生率、吻合口狭窄发生率、吻合口瘘发生率、切口感染发生率、术后7 d疼痛评分、3年内局部复发。通过EORTC-QLQ-CR29量表[3]评估术后3、6个月患者的生活质量情况(身体形象、焦虑、体质量、大便失禁、排尿困难、尿失禁、腹痛、阳痿、脓血便、肛门疼痛),身体形象、焦虑、体质量评估后的得分越高则表示功能状态越好;其余各项评估后的得分越高,则表示症状越明显。采取Parks肛门功能分级[4]对肛门功能进行评价:完全正常为1级;不能完全控制气体和腹泻为2级;完全不能控制腹泻为3级;不能控制固体排便为4级。
1.4 统计学处理

2 结果
2.1 手术情况比较
观察组远端切缘距离(3.1±0.4)cm,对照组远端切缘距离(2.7±0.6)cm,2组比较差异有统计学意义(P<0.05);观察组无预防性造口病例,对照组预防性造口5例,2组比较差异有统计学意义(P<0.05);2组患者手术时间、术中出血量、淋巴结清扫数目、阳性淋巴结个数比较,差异均无统计学意义(P>0.05),见表2。
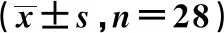
表2 手术情况比较
2.2 患者术后住院及随访情况比较
与对照组比较,观察组术后肠功能恢复时间更短、住院时间更短、术后7 d疼痛评分更低,差异均有
统计学意义(P<0.05);2组患者住院费用、术后引流量、肠梗阻发生率、下肢深静脉血栓发生率、吻合口狭窄发生率、吻合口瘘发生率、切口感染发生率、3年内局部复发情况比较,差异均无统计学意义(P>0.05),见表3。
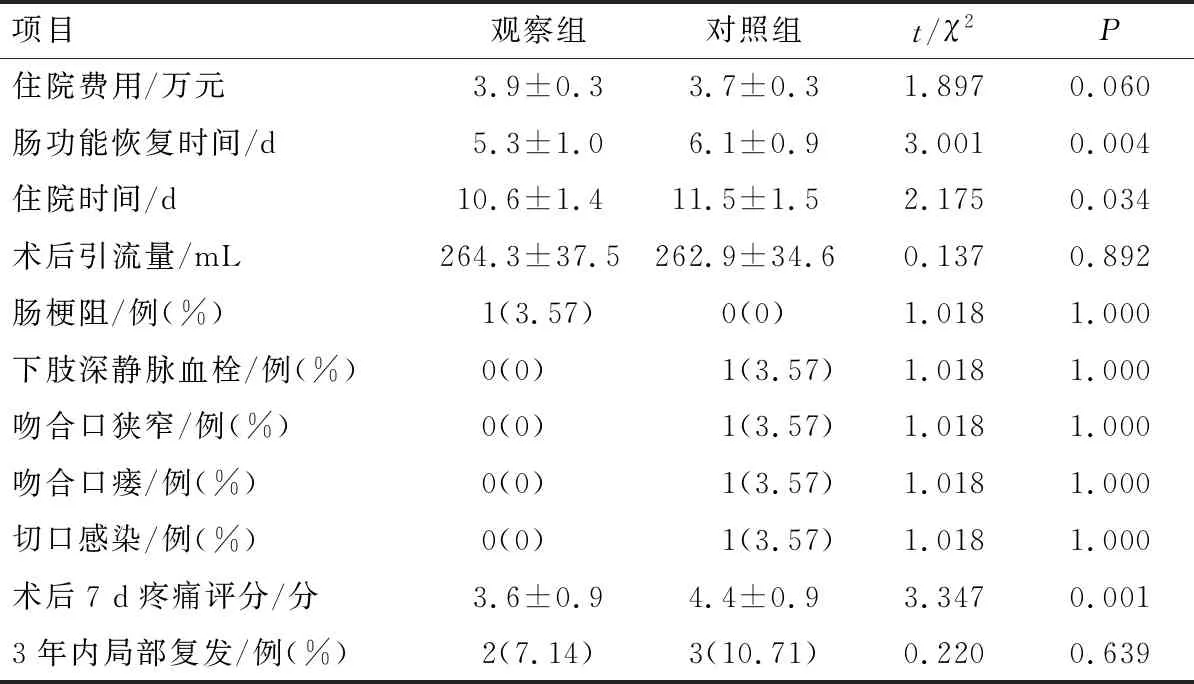
表3 术后住院期间及随访情况(n=28)
2.3 术后生活质量及肛门功能情况比较
2组患者术后3、6个月身体形象、大便失禁比较,差异有统计学意义(P<0.05);2组患者术后3个月腹痛、肛门疼痛比较,差异有统计学意义(P<0.05),见表4。随访并统计了2组患者(包括对照组预防性造口回纳之后5例患者)术后1年内的排便功能情况,观察组患者在术后经过1年的康复后,排便功能趋近于正常,与对照组相比差异具有统计学意义(P<0.05),见表5。
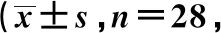
表4 患者术后3、6个月生活质量评价情况分)
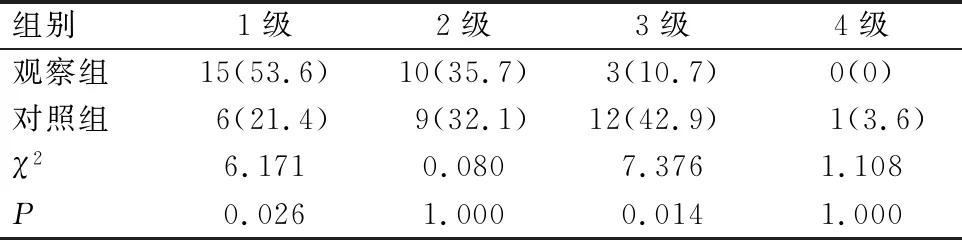
表5 患者术后1年肛门功能评价情况[n=28,例(%)]
3 讨论
1982年Heald等[5]首次提出TME在直肠癌手术中应用的概念,自此开启了直肠癌外科手术治疗的新里程碑,目前TME已成为治疗直肠癌的“金标准”[6]。近年来腹腔镜技术在微创外科领域迅速发展,由于其具有体表切口小、术中出血量少、术后恢复时间短等优势[7],腹腔镜下全直肠系膜切除术(laparoscopic total mesorectal excision,laTME)已被胃肠外科医师广泛接受和普遍应用。研究证实腹腔镜下进行直肠癌的根治效果与传统开放手术无明显差别[8],但是对于低位直肠癌,特别是骨盆较狭窄的男性低位直肠癌患者,即使是手术经验丰富、操作熟练的结直肠外科医师仍无法确保足够的肿瘤远侧切缘[9],术中还可能损伤盆腔植物神经,难以彻底切除直肠吻合口周围组织,术后并发症(泌尿及性功能障碍、肠管损伤)及局部复发率增加[10]。且低位直肠癌病灶切除后吻合口的位置低,术中游离近端乙状结肠并保留乙状结肠血供困难,这也会在一定程度上增加TME后发生吻合口瘘的风险[11]。游离肿瘤远侧时为了保证足够的切缘通常采取助手经肛门指引的方式评估离断直肠位置,这增加了与肿瘤接触的机会,违背了肿瘤操作的无瘤原则。因此,男性低位直肠癌患者的手术治疗对于结直肠外科医师来说仍然具有很大的挑战及改进空间。
NOSES可以在直视下精准地判断肿瘤病灶远端切缘,确保肿瘤远端切缘的安全性[12],因此手术过程中直肠远端离断的难度降低,同时可提高直肠癌患者预后及术后生活质量[13]。本研究中,观察组较对照组能够保证更远的手术安全切缘,可以更容易地进行直肠切除闭合和超低位吻合等手术操作,可以克服男性盆腔狭窄所带来的手术操作困难问题,在直视下进行肿瘤远端安全切缘的测量及离断,并且在离断肿瘤远端时只需1个直线型切割吻合器,而对照组通常需要2个腹腔镜切割吻合器方可确保安全离断肿瘤远端直肠。本研究结果显示,与对照组比较,观察组手术创伤小,腹部除了穿刺鞘戳孔伤口以外无腹部大切口,可以经肛取出标本后进行吻合,符合NOSES的理念,具有微创和更好的美容效果,术后腹部疼痛亦较轻,为患者术后快速康复提供了有利的条件,避免患者术后因疼痛不敢活动而长期卧床引起下肢深静脉血栓的发生,同时也促进了肠功能更早恢复,缩短了患者住院时间。将直肠肠管拖出肛门外离断,可以直视下切除足够长度的肠管而确保吻合口无张力,并且肿瘤远端切缘平整,更加有利于吻合口的愈合[14],可降低吻合口瘘发生率以及避免预防性造口带来的生活不便。患者术后生活质量及肛门排便功能是外科医师与患者关注的一个重点,观察组身体形象、大便失禁评分与对照组比较有优势,这与观察组腹部无长切口、术中更能避免损伤相关肌群有关。
在手术的过程中,我们总结了如下注意事项:①病例的慎重选择和术前肿瘤病灶的精确评估,确保肿瘤分期为T1~T3,肿瘤占据肠腔<1/2环腔,BMI<30 kg·m-2,肿瘤直径小于5 cm(环周直径<3 cm为宜),肛门指检扪及肿瘤基底活动性良好[15-16]。②腹腔镜下游离直肠时游离的平面尽量低,前侧尽量达到齿状线平面,后侧尽可能打开内外括约肌间沟,以防止肛门括约肌限制肠管外翻,避免肿瘤被挤压。如患者的肠系膜肥厚,游离肠系膜下动静脉和裁剪近端肠系膜时,也应该向远端多游离,以利于肠管的顺利拖出。③从肛门拖出乙状结肠及含肿瘤直肠时,应该在腹腔镜观察下操作,切忌暴力拖出,否则容易导致肠壁破裂及肿瘤细胞因挤压或摩擦而脱落。④术前需行肠道准备,避免腹腔镜下乙状结肠断端进行荷包缝合时粪便污染腹腔,若术中有粪便黏附乙状结肠断端,碘伏纱条擦拭后必须用小标本袋取出,切忌直接经穿刺鞘取出;整个手术过程必须严格遵循无菌无瘤操作的原则,放置管型吻合器的钉座时以保护套隔离经肛门放入,避免钉座与肠管接触;经肛拖出乙状结肠及含肿瘤直肠时,肿瘤有可能因与直肠摩擦接触而导致肿瘤细胞脱落,因此在闭合远端直肠前需用42 ℃的蒸馏水充分冲洗闭合处的直肠。⑤腹腔镜下游离结肠一定要充分确保吻合口处有良好的血供,避免因张力及血供不足引起吻合口瘘,必要时可以采取末端回肠双腔预防性造瘘。
总之,NOSES治疗男性低位直肠癌具有一定的优势,可以缩短患者术后肠功能恢复时间、住院时间,降低术后疼痛评分,减少术后并发症,促进患者术后快速康复,但并非每个患者均可采取该术式,且目前针对该术式的相关研究不多,仍然需要进一步的多中心、大样本量及长期随访研究证实其优势。

