增生性糖尿病视网膜病变玻璃体切割术后玻璃体再出血危险因素分析
范小娥 柯屹峰 任新军 李筱荣
天津医科大学眼科医院 眼视光学院 眼科研究所 国家眼耳鼻喉疾病临床医学研究中心天津市分中心 天津市视网膜功能与疾病重点实验室 300384
增生性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)患者行玻璃体切割手术(pars plana vitrectomy,PPV)后玻璃体再出血(postoperative vitreous hemorrhage,PVH)是影响PPV手术预后的重要原因,可导致视力再次下降,甚至需再次手术[1]。PVH是指行完全PPV玻璃体腔恢复透明后再次出现玻璃体积血(vitreous hemorrhage,VH),在间接检眼镜下视网膜细节不能窥见,但不包括术后第1天出现的VH,即手术后持续出血者[2-4]。近年来随着23G和25G PPV微创手术的开展和抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物的应用,PDR患者的PPV手术风险大大降低,但PVH仍然是PDR术后的重要并发症。目前PVH的危险因素并不明确,也缺乏大样本的研究。本研究拟收集首次行PPV治疗PDR伴VH患者的临床资料,分析其PPV后PVH发生的危险因素。
1 资料与方法
1.1 一般资料
采用病例对照研究方法,选取2012年6月至2019年5月在天津医科大学眼科医院首次行PPV治疗的PDR合并VH患者1 848例1 848眼,其中男979例979眼,女869例869眼;年龄23~85岁,平均(55.72±10.39)岁;糖尿病病程3个月~40年,平均(10.25±6.45)年。患眼术前BCVA为光感~0.6,其中光感者25眼,手动者112眼,数指者142眼,0.01~0.1者290眼,>0.1者1 279眼;术前眼压为5.3~44 mmHg(1 mmHg=0.133 kPa),平均(15.27±2.55)mmHg;伴TRD者235眼,伴黄斑前膜者11眼,伴黄斑水肿者42眼;术前已行PRP者1 083眼,术前3 d内行抗VEGF药物治疗者353眼;有晶状体眼者1 668眼,人工晶状体眼者179眼;术前合并虹膜新生血管(neovascularization of iris,NVI)者72眼,术中视盘新生血管(neovascularization of disc,NVD)伴出血者96眼,联合白内障超声乳化摘出+人工晶状体植入手术者1 175眼。纳入标准:(1)病历资料和影像资料完整,经内分泌科确诊的糖尿病患者;(2)经间接检眼镜、B型超声、眼底照相、频域光相干断层扫描(spectral domain optical coherence tomography,SD-OCT)等检查,符合2002年国际糖尿病视网膜病变诊断标准的PDR[5],且伴持续未吸收的VH超过3周,伴或不伴牵拉性视网膜脱离(tractional retinal detachment,TRD)患者;(3)术后随访时间≥6个月,硅油填充患者在硅油取出后随访≥6个月。排除标准:(1)有除白内障手术外的其他任何内眼手术史;(2)既往有视网膜疾病史,如年龄相关性黄斑变性等;(3)至随访结束时,手术填充的硅油未取出者;(4)手术中有晶状体后囊损伤或破裂者。本研究遵循《赫尔辛基宣言》并经天津医科大学眼科医院伦理委员会审核批准[批文号:2019KY(L)-09]。所有患者均签署手术知情同意书。
1.2 方法
1.2.1眼科检查和评价指标 术前及术后各随访时间点所有患眼均采用对数视力表检查最佳矫正视力(best-corrected visual acuity,BCVA)并换算为LogMAR视力,非接触眼压计(CT-80A,日本Topcon公司)测量眼压,裂隙灯显微镜(SL-1E,日本Topcon公司)检查眼前节,前置镜(美国VOLK公司)、间接检眼镜(OMEGA500,德国海尼公司)、眼底照相(CR-2,日本Canon公司)及B型超声(AVISO,法国光太公司)检查眼底,根据屈光间质状态选择行荧光素眼底血管造影(TRCNW7SF,日本Topcon公司)或SD-OCT(日本Topcon公司)检查,明确PDR分期、VH和TRD程度。
1.2.2手术方法 由同一名手术经验丰富的医师行23G或25G标准三通道闭合式PPV。对于术前TRD范围超过3个钟点位、纤维血管增生膜与视网膜呈宽基底黏连的患眼,手术前3 d给予抗VEGF药物(雷珠单抗/康柏西普,0.05 ml)玻璃体腔内注射治疗[6]。影响眼底观察的白内障患者行PPV联合白内障超声乳化摘出+人工晶状体植入术。
采用Alcon微套管系统完全切割玻璃体皮质和积血,曲安奈德辅助染色,玻璃体后脱离,清除玻璃体后皮质,剥除视网膜前增生膜,不能剥除的部分予以分割孤立,解除牵拉张力,充分电凝止血;根据患者眼底病变和黄斑水肿情况,术中选择视网膜内界膜剥除;PPV前已行全视网膜激光光凝(panretinal photocoagnlation,PRP)者手术中补充激光光凝,未行PRP者手术中均顶压周边视网膜进行PRP,必要时行气液交换;根据患眼PDR严重程度选择玻璃体腔填充物(灌注液/无菌空气/硅油/C3F8);根据眼底病变情况选择术毕玻璃体腔内注射抗VEGF药物治疗(雷珠单抗/康柏西普,0.05 ml)。硅油填充患者于PPV术后第3~6个月接受硅油取出术。
1.2.3PVH分组 根据术后是否出现PVH将患者分为PVH组和无PVH组;再根据术后PVH发生时间分为早期PVH组(PPV术后1个月内)及晚期PVH组(PPV术后超过1个月)[2]。1 848眼中,PVH组、无PVH组分别为170眼和1 678眼。早期PVH组30眼,晚期PVH组140眼。PVH发生时间为术后6~450 d,平均(99.12±6.89)d。术后随访6~24个月,采用手术前相同设备和方法进行相关检查。观察患眼BCVA、眼压变化以及手术后PVH情况。
1.3 统计学方法
采用SAS 9.4统计学软件进行统计分析,本研究中计量资料的数据经W检验呈偏态分布,以M(Q1,Q3)表示,各组间差异比较采用Mann-WhitneyU检验;计数资料以例数和百分数表示,当总例数≥40且所有理论频数≥5时采用χ2检验,当总例数<40或存在理论频数<5时采用Fisher确切概率法分析各组基线、眼部和手术因素差异。根据差异性分析结果,将P<0.05的因素纳入Logistic多因素回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 PVH组与无PVH组各因素差异性分析
基线因素中,PVH组的年龄(Z=-6.374,P<0.01)低于无PVH组,VH病程(Z=2.610,P=0.009)、糖尿病病程(Z=3.458,P<0.01)、合并视网膜静脉阻塞(retinal vein occlusion,RVO)比率(χ2=12.208,P<0.01)、合并高血压比率(χ2=15.179,P<0.01)、术前糖化血红蛋白(glycosylated hemoglobin,HbA1c)水平(Z=9.862,P<0.01)、术前空腹血糖水平(Z=3.384,P<0.01)和高血压病程(Z=3.155,P=0.002)均高于无PVH组;PVH组与无PVH组间糖尿病治疗类型(χ2=21.001,P<0.01)、PDR分期(χ2=14.676,P<0.01)、合并肾脏或心脑血管疾病(P<0.01)的眼数分布明显不同;2个组性别构成比、眼别构成比、术前凝血酶原时间(prothrombin time,PT)和术前部分凝血活酶时间(activated partial thromboplastin time,APTT)比较,差异均无统计学意义(均P>0.05)(表1)。
眼部因素中,PVH组的术前人工晶状体眼比率(χ2=5.379,P<0.01)、术前合并NVI的比率(χ2=102.810,P<0.01)高于无PVH组,术前LogMAR视力(Z=3.172,P=0.002)差于无PVH组,术前眼压(Z=-3.258,P=0.001)低于无PVH组。2个组术前合并眼底疾病及术前是否完成PRP的眼数分布比较,差异均无统计学意义(均P>0.05)(表2)。
手术因素中,PVH组联合白内障超声乳化摘出手术的比率(χ2=19.044,P<0.01)、术中PRP激光点数(Z=-2.647,P=0.008)均低于无PVH组;2个组间患者术毕玻璃体腔填充物质类型(χ2=9.770,P=0.021)、术毕玻璃体腔注药类型(χ2=42.042,P<0.01)眼数分布不同;PVH组术前3 d玻璃体腔内注射抗VEGF药物治疗比率(χ2=5.518,P=0.019)、术中NVD伴出血的比率(χ2=48.334,P<0.01)均高于无PVH组;2个组间术中有无剥除内界膜和术中是否补充/完成PRP的眼数分布比较,差异均无统计学意义(均P>0.05)(表3)。
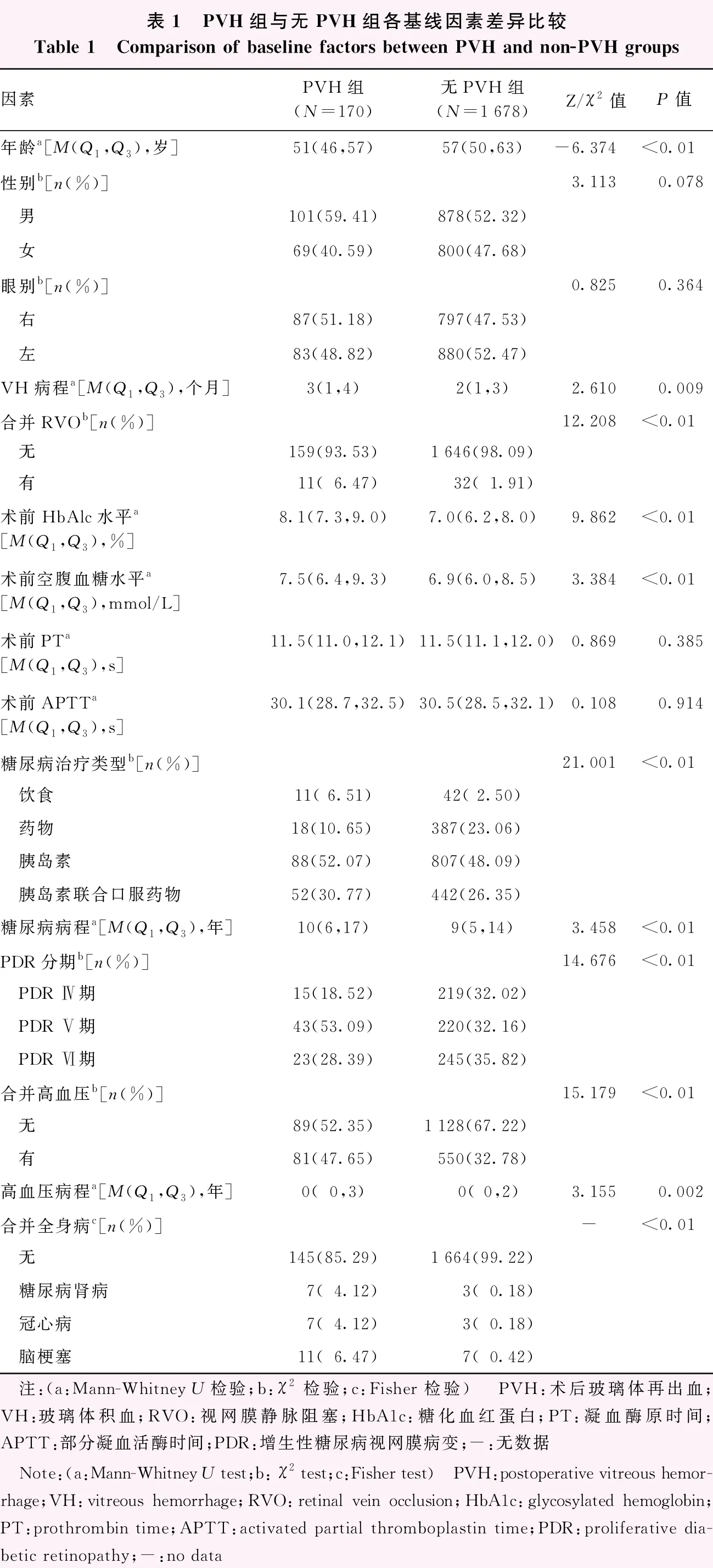
表1 PVH组与无PVH组各基线因素差异比较Table 1 Comparison of baseline factors between PVH and non-PVH groups因素PVH组(N=170)无PVH组(N=1678)Z/χ2值P值年龄a[M(Q1,Q3),岁]51(46,57)57(50,63)-6.374<0.01 性别b[n(%)]3.1130.078 男101(59.41)878(52.32) 女69(40.59)800(47.68)眼别b[n(%)]0.8250.364 右87(51.18)797(47.53) 左83(48.82)880(52.47)VH病程a[M(Q1,Q3),个月]3(1,4)2(1,3)2.6100.009合并RVOb[n(%)]12.208<0.01 无159(93.53)1646(98.09) 有11(6.47)32(1.91)术前HbAlc水平a[M(Q1,Q3),%]8.1(7.3,9.0) 7.0(6.2,8.0) 9.862 <0.01 术前空腹血糖水平a[M(Q1,Q3),mmol/L]7.5(6.4,9.3) 6.9(6.0,8.5) 3.384 <0.01 术前PTa[M(Q1,Q3),s]11.5(11.0,12.1) 11.5(11.1,12.0) 0.869 0.385 术前APTTa[M(Q1,Q3),s]30.1(28.7,32.5) 30.5(28.5,32.1) 0.108 0.914 糖尿病治疗类型b[n(%)]21.001<0.01 饮食11( 6.51)42( 2.50) 药物18(10.65)387(23.06) 胰岛素88(52.07)807(48.09) 胰岛素联合口服药物52(30.77)442(26.35)糖尿病病程a[M(Q1,Q3),年]10(6,17)9(5,14)3.458<0.01 PDR分期b[n(%)]14.676<0.01 PDR Ⅳ期15(18.52)219(32.02) PDR Ⅴ期43(53.09)220(32.16) PDR Ⅵ期23(28.39)245(35.82)合并高血压b[n(%)]15.179<0.01 无89(52.35)1128(67.22) 有81(47.65)550(32.78)高血压病程a[M(Q1,Q3),年]0(0,3) 0(0,2)3.1550.002合并全身病c[n(%)]- <0.01 无145(85.29)1664(99.22) 糖尿病肾病7(4.12)3(0.18) 冠心病7(4.12)3(0.18) 脑梗塞11(6.47)7(0.42) 注:(a:Mann-Whitney U检验;b:χ2检验;c:Fisher检验) PVH:术后玻璃体再出血;VH:玻璃体积血;RVO:视网膜静脉阻塞;HbA1c:糖化血红蛋白;PT:凝血酶原时间;APTT:部分凝血活酶时间;PDR:增生性糖尿病视网膜病变;-:无数据 Note:(a:Mann-Whitney U test;b: χ2 test;c:Fisher test) PVH:postoperative vitreous hemor-rhage;VH:vitreous hemorrhage;RVO:retinal vein occlusion;HbA1c:glycosylated hemoglobin;PT:prothrombin time;APTT:activated partial thromboplastin time;PDR:proliferative dia-betic retinopathy;-:no data
2.2 多因素Logistic回归分析术后PVH危险因素
将上述PVH组与无PVH组间有差异的变量全部纳入多因素Logistic回归分析,结果显示年龄每增加1岁,PVH风险降低6%(OR=0.940,95%CI:0.921~0.960);术前HbAlc水平每增加1个单位,PVH风险增加87.8%(OR=1.878,95%CI:1.623~2.172);合并RVO患者PVH的风险比未合并RVO高7.310倍(OR=8.310,95%CI:2.704~25.532);饮食控制血糖患者PVH的风险比胰岛素联合口服药物高2.030倍(OR=3.030,95%CI:1.204~7.623);糖尿病病程每增加1年,发生PVH的风险增加4.4%(OR=1.044,95%CI:1.012~1.077);合并肾脏或心脑血管疾病患者PVH的风险比未合并肾脏或心脑血管疾病高17.377倍(OR=18.377,95%CI:7.498~45.044);术前合并NVI患者发生PVH风险比术前未合并NVI高6.488倍(OR=7.488,95%CI:3.935~14.250);未联合白内障超声乳化摘出手术患者PVH的风险比联合白内障超声乳化摘出手术高62.8%(OR=1.628,95%CI:1.069~2.478);术毕玻璃体腔内注射抗VEGF药物患者PVH的风险比术毕玻璃体腔内未注射抗VEGF药物低81.9%(OR=0.181,95%CI:0.094~0.346);术中合并NVD伴出血患者PVH的风险比术中未合并NVD伴出血高1.691倍(OR=2.691,95%CI:1.445~5.011)(表4)。
2.3 早期PVH组和晚期PVH组各因素差异性分析
早期PVH组与晚期PVH组患者的术前基线、眼部和手术因素等指标比较差异均无统计学意义(P>0.05)(表5)。
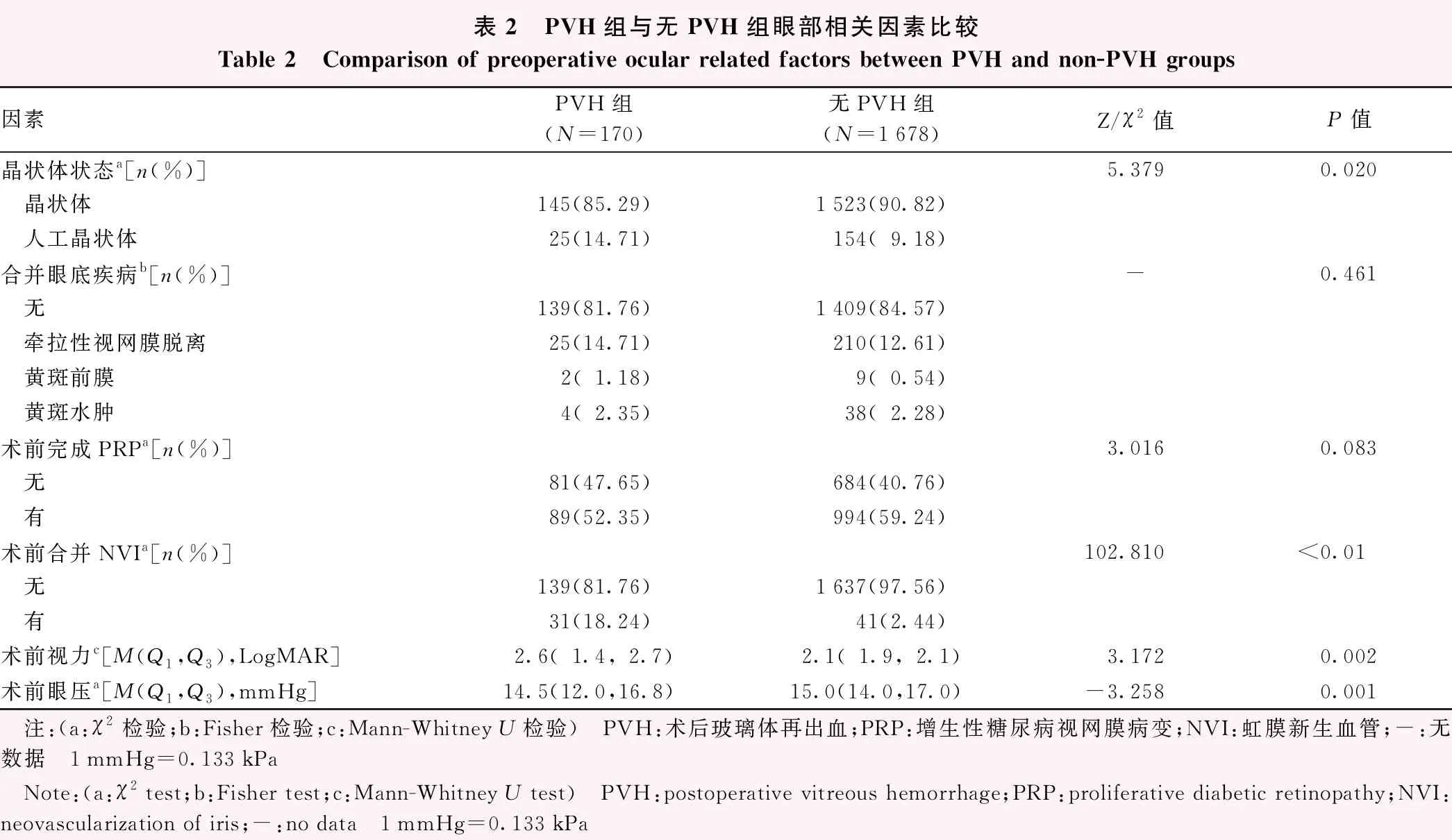
表2 PVH组与无PVH组眼部相关因素比较Table 2 Comparison of preoperative ocular related factors between PVH and non-PVH groups因素PVH组(N=170)无PVH组(N=1678)Z/χ2值P值晶状体状态a[n(%)]5.3790.020 晶状体145(85.29)1523(90.82) 人工晶状体25(14.71)154(9.18)合并眼底疾病b[n(%)]-0.461 无139(81.76)1409(84.57) 牵拉性视网膜脱离25(14.71)210(12.61) 黄斑前膜2(1.18)9(0.54) 黄斑水肿4(2.35)38(2.28)术前完成PRPa[n(%)]3.0160.083 无81(47.65)684(40.76) 有89(52.35)994(59.24)术前合并NVIa[n(%)]102.810<0.01 无139(81.76)1637(97.56) 有31(18.24)41(2.44)术前视力c[M(Q1,Q3),LogMAR]2.6(1.4,2.7)2.1(1.9,2.1)3.1720.002术前眼压a[M(Q1,Q3),mmHg]14.5(12.0,16.8)15.0(14.0,17.0)-3.2580.001 注:(a:χ2检验;b:Fisher检验;c:Mann-Whitney U检验) PVH:术后玻璃体再出血;PRP:增生性糖尿病视网膜病变;NVI:虹膜新生血管;-:无数据 1mmHg=0.133kPa Note:(a:χ2 test;b:Fisher test;c:Mann-Whitney U test) PVH:postoperative vitreous hemorrhage;PRP:proliferative diabetic retinopathy;NVI:neovascularization of iris;-:no data 1mmHg=0.133kPa
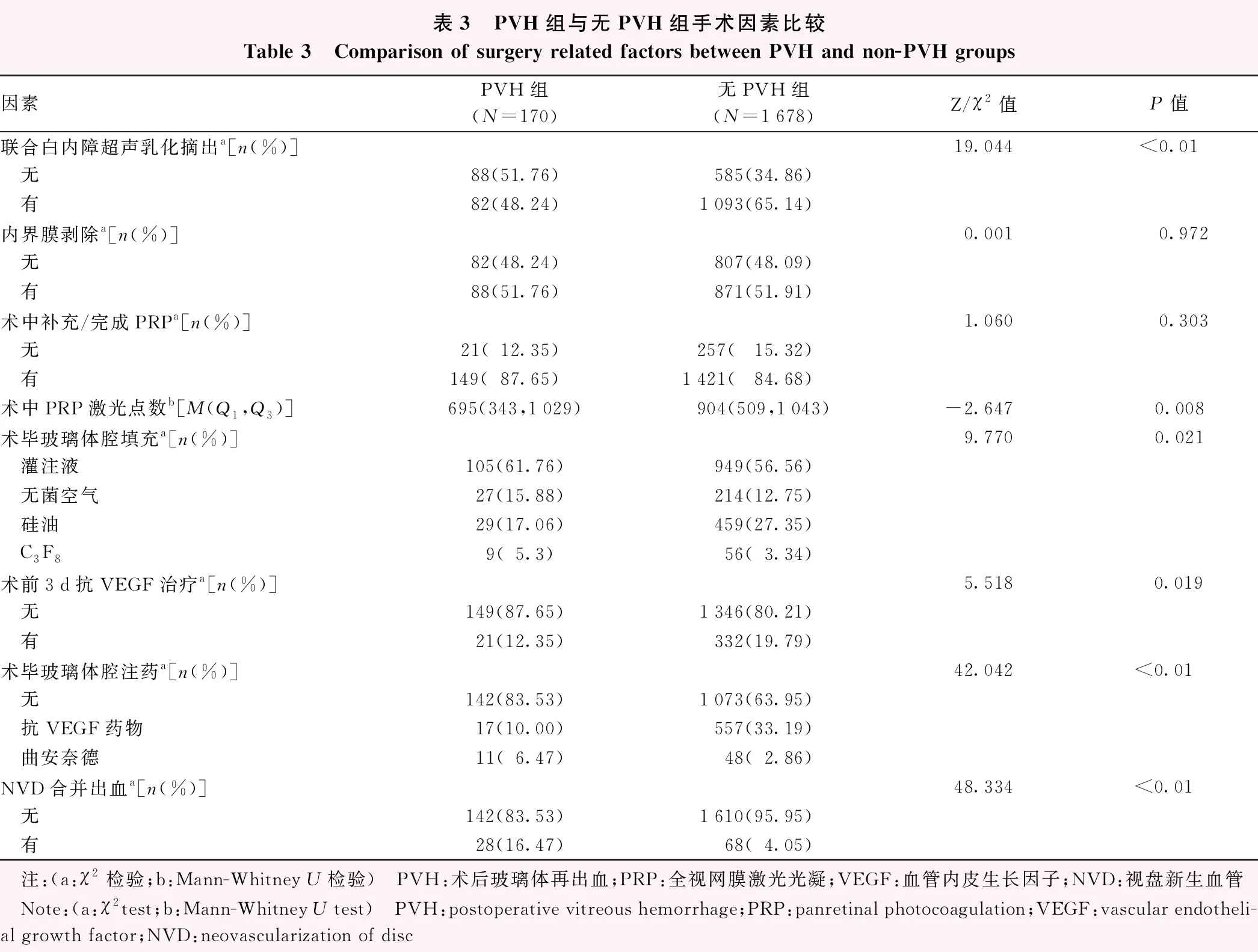
表3 PVH组与无PVH组手术因素比较Table 3 Comparison of surgery related factors between PVH and non-PVH groups因素PVH组(N=170)无PVH组(N=1678)Z/χ2值P值联合白内障超声乳化摘出a[n(%)]19.044<0.01 无88(51.76)585(34.86) 有82(48.24)1093(65.14)内界膜剥除a[n(%)]0.0010.972 无82(48.24)807(48.09) 有88(51.76)871(51.91)术中补充/完成PRPa[n(%)]1.0600.303 无21(12.35)257(15.32) 有149(87.65)1421(84.68)术中PRP激光点数b[M(Q1,Q3)]695(343,1029)904(509,1043)-2.6470.008术毕玻璃体腔填充a[n(%)]9.7700.021 灌注液105(61.76)949(56.56) 无菌空气27(15.88)214(12.75) 硅油29(17.06)459(27.35) C3F89(5.3)56(3.34)术前3d抗VEGF治疗a[n(%)]5.518 0.019 无149(87.65)1346(80.21) 有21(12.35)332(19.79)术毕玻璃体腔注药a[n(%)]42.042<0.01 无142(83.53)1073(63.95) 抗VEGF药物17(10.00)557(33.19) 曲安奈德11(6.47)48(2.86)NVD合并出血a[n(%)]48.334<0.01 无142(83.53)1610(95.95) 有28(16.47)68(4.05) 注:(a:χ2检验;b:Mann-Whitney U检验) PVH:术后玻璃体再出血;PRP:全视网膜激光光凝;VEGF:血管内皮生长因子;NVD:视盘新生血管 Note:(a:χ2test;b:Mann-Whitney U test) PVH:postoperative vitreous hemorrhage;PRP:panretinal photocoagulation;VEGF:vascular endotheli-al growth factor;NVD:neovascularization of disc
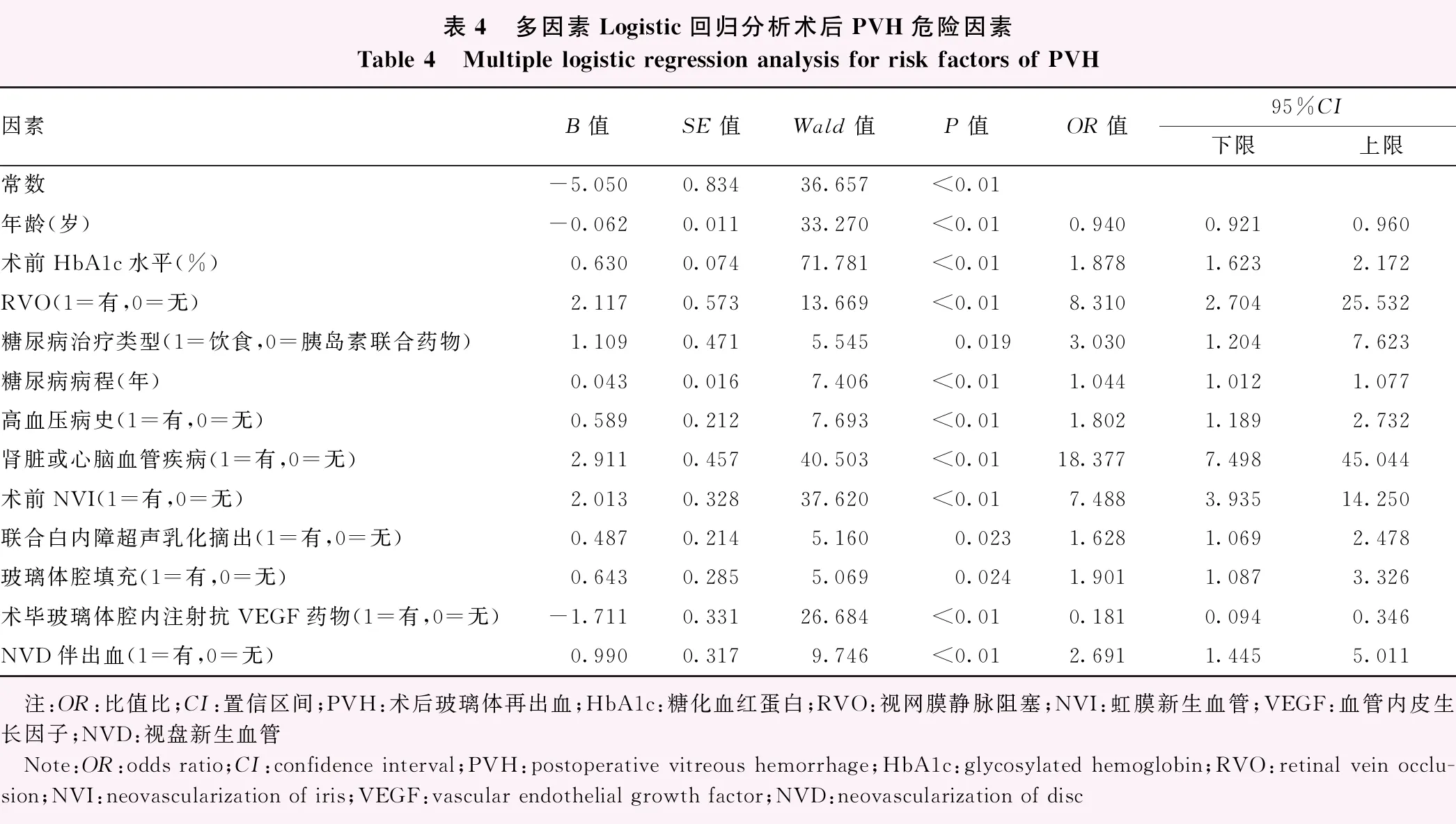
表4 多因素Logistic回归分析术后PVH危险因素Table 4 Multiple logistic regression analysis for risk factors of PVH因素Β值SE值Wald值P值OR值95%CI下限上限常数-5.0500.83436.657<0.01年龄(岁)-0.0620.01133.270<0.010.9400.9210.960术前HbA1c水平(%)0.6300.07471.781<0.011.8781.6232.172RVO(1=有,0=无)2.1170.57313.669<0.018.3102.70425.532糖尿病治疗类型(1=饮食,0=胰岛素联合药物)1.1090.4715.5450.0193.0301.2047.623糖尿病病程(年)0.0430.0167.406<0.011.0441.0121.077高血压病史(1=有,0=无)0.5890.2127.693<0.011.8021.1892.732肾脏或心脑血管疾病(1=有,0=无)2.9110.45740.503<0.0118.3777.49845.044术前NVI(1=有,0=无)2.0130.32837.620<0.017.4883.93514.250联合白内障超声乳化摘出(1=有,0=无)0.4870.2145.1600.0231.6281.0692.478玻璃体腔填充(1=有,0=无)0.6430.2855.0690.0241.9011.0873.326术毕玻璃体腔内注射抗VEGF药物(1=有,0=无)-1.7110.33126.684<0.010.1810.0940.346NVD伴出血(1=有,0=无)0.9900.3179.746<0.012.6911.4455.011 注:OR:比值比;CI:置信区间;PVH:术后玻璃体再出血;HbA1c:糖化血红蛋白;RVO:视网膜静脉阻塞;NVI:虹膜新生血管;VEGF:血管内皮生长因子;NVD:视盘新生血管 Note:OR:odds ratio;CI:confidence interval;PVH:postoperative vitreous hemorrhage;HbA1c:glycosylated hemoglobin;RVO:retinal vein occlu-sion;NVI:neovascularization of iris;VEGF:vascular endothelial growth factor;NVD:neovascularization of disc
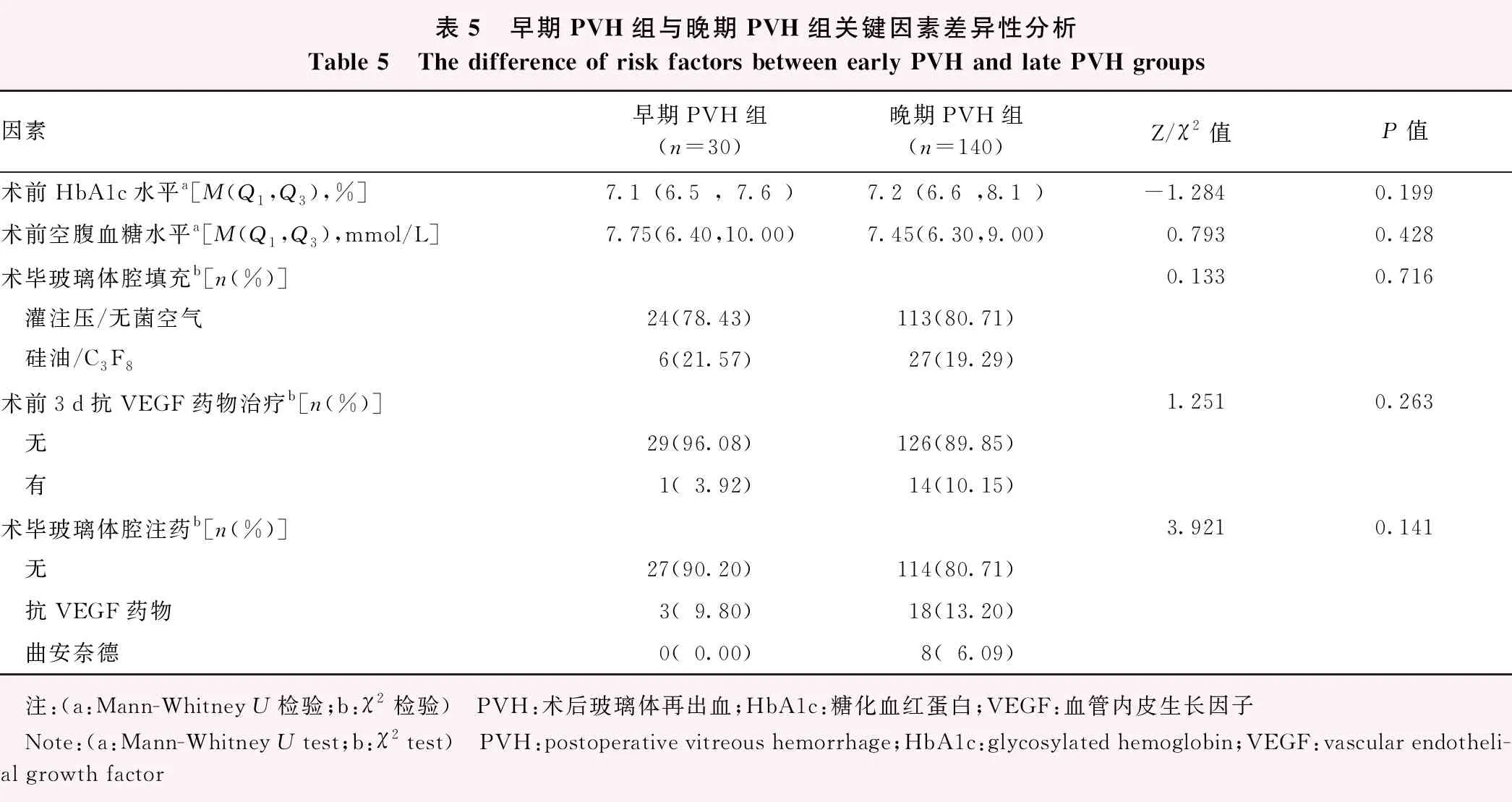
表5 早期PVH组与晚期PVH组关键因素差异性分析Table 5 The difference of risk factors between early PVH and late PVH groups因素早期PVH组(n=30)晚期PVH组(n=140)Z/χ2值P值术前HbA1c水平a[M(Q1,Q3),%]7.1(6.5,7.6)7.2(6.6,8.1)-1.2840.199术前空腹血糖水平a[M(Q1,Q3),mmol/L]7.75(6.40,10.00)7.45(6.30,9.00)0.7930.428术毕玻璃体腔填充b[n(%)]0.1330.716 灌注压/无菌空气24(78.43)113(80.71) 硅油/C3F86(21.57)27(19.29)术前3d抗VEGF药物治疗b[n(%)]1.2510.263 无29(96.08)126(89.85) 有1(3.92)14(10.15)术毕玻璃体腔注药b[n(%)]3.9210.141 无27(90.20)114(80.71) 抗VEGF药物3(9.80)18(13.20) 曲安奈德0(0.00)8(6.09) 注:(a:Mann-Whitney U检验;b:χ2检验) PVH:术后玻璃体再出血;HbA1c:糖化血红蛋白;VEGF:血管内皮生长因子 Note:(a:Mann-Whitney U test;b:χ2 test) PVH:postoperative vitreous hemorrhage;HbA1c:glycosylated hemoglobin;VEGF:vascular endotheli-al growth factor
3 讨论
本研究分析PDR术后PVH独立危险因素有12个,其中,低龄、术前高HbA1c、糖尿病病程长、饮食控制血糖、合并高血压病、合并肾脏或心脑血管疾病、术前合并NVI、NVD伴出血这8个因素与目前国内外研究结论一致[2,3,7-15]。合并RVO、未联合白内障超声乳化手术、术毕玻璃体腔无菌空气填充和术毕玻璃体腔内未注射抗VEGF药物治疗4个危险因素尚存在争议。
以往有关晶状体状态与PVH的相关性研究结果不尽相同。有研究认为术前晶状体状态不影响PVH的发生[2]。也有研究表明对有晶状体眼的PDR患者行PPV时,为避免损伤晶状体,往往残留前部及周边的玻璃体裙带,易形成纤维血管增生膜收缩牵拉,使PVH的发生率升高[4]。但目前在广角镜的帮助以及良好的巩膜顶压辅助下,术中基底部玻璃体清除更彻底,有晶状体眼对PVH的影响降低。本研究结果显示,未联合白内障超声乳化手术为PVH的危险因素,其可能与本研究时间跨度大,早期PPV手术条件不完善,导致结果存在偏倚有关。
RVO对PDR患者行PPV术后影响的研究较少。PDR患者因视网膜微血管异常,RVO发生率较高。有研究显示,PDR患者中合并RVO者高达17.0%,并推测RVO是PDR患者PPV术后发生PVH的重要原因[16-18]。PDR合并RVO患者PVH发生率升高的可能原因包括:(1)PDR合并RVO患者视网膜表面,特别是视盘表面的纤维血管膜产生牵拉,可导致管壁相对薄的视网膜静脉完全闭塞,手术中经剥除纤维血管膜等处理后可恢复部分血流,产生缺血—再灌注损伤,加速新生血管形成[19];(2)RVO本身即可诱导视网膜新生血管生成,使PVH发生率升高[20];(3)PDR患者多数合并高血压、心脑血管疾病等全身疾病,致微血管损伤和微循环障碍,使PDR合并RVO时视网膜病变更为严重,PPV术后新生血管再生长及PVH发生率更高;(4)PDR合并RVO患者视网膜渗出、水肿明显且广泛,血—视网膜屏障功能及视网膜色素上皮细胞破坏严重,术中PRP效果差,导致相对无效的激光光斑数量增多,不能有效抑制新生血管生成。
单纯依靠饮食控制常难以将血糖调节在一个良好的稳定水平,容易出现血糖波动,导致视网膜功能和结构受损,PVH发生率升高[21]。Mohsin等[22]在对878例青少年糖尿病患者历时12年的随访中发现,每日3次或以上皮下注射胰岛素的患者血糖波动幅度和波动次数较单纯口服药物或控制饮食减少,从而延缓PDR的进展。
PDR患者术毕玻璃体腔抗VEGF药物注射主要为了治疗术后黄斑水肿或预防术后眼底病变进展[23-24]。目前术毕玻璃体腔内注射抗VEGF药物治疗在降低PPV术后PVH方面的研究尚少见。本研究发现术毕玻璃体腔内注射抗VEGF药物为PDR患者PPV术后发生PVH的保护因素,其可能的原因包括:(1)对于高危PDR,如术前存在视盘或视网膜大量新生血管的情况下,术毕使用抗VEGF药物治疗可使玻璃体腔VEGF浓度处于低水平,促进新生血管的消退,防止术后再出血,同时促进残余积血吸收;(2)术中尚未有效完成PRP时,可在VEGF药物作用有效期内完成PRP,避免因PRP起效慢或不完全而导致视网膜新生血管的进展;(3)PDR增生膜较多且充血明显、伴广泛TRD的患者,术毕抗VEGF治疗有助于脆弱易出血的新生血管收缩,减少新生血管壁渗漏,降低术后PVH的发生率。然而,本研究中术毕是否选择玻璃体腔内注射抗VEGF药物治疗,主要依据医生对糖尿病视网膜病变、视网膜纤维血管增生膜及其引起视网膜牵拉的严重程度来主观判断,存在潜在选择偏倚。
目前大部分医师对视网膜病变程度相对较轻的患眼采用灌注液或无菌空气填充,而对病变程度较重的患眼采用硅油或C3F8填充。Takayama等[10]采用多中心回顾性研究,发现经25G PPV治疗后的452眼PDR患眼中,无菌空气填充组PVH发生率为16.1%,明显高于长效气体填充组的7.1%和硅油填充组的3.1%,认为无菌空气填充为PDR患者PPV术后PVH发生的危险因素,与本研究结果一致,分析其可能的原因为无菌空气在眼内存留时间较短,对视网膜出血的机械压迫作用弱,易引起术后PVH发生。
早期PVH发生的原因多与手术后玻璃体基底部残留积血的释放、基底部纤维血管膜的增生、手术中止血不彻底等有关[2]。本研究中早期PVH发生率和晚期PVH发生率分别为1.62%和7.58%,均明显低于既往研究报道的13%~36.8%[25-26],且早期PVH组和晚期PVH组术前基线、眼部和手术因素等指标比较差异均无统计学意义,考虑随着微创玻璃体切割手术技术、设备的不断更新以及抗VEGF药物的应用,PPV手术过程将更加安全、高效,可更好地切割前部及周边的玻璃体裙带,更彻底地清除基底部玻璃体有关。
综上所述,本研究结果显示低龄、术前高HbA1c、合并RVO、糖尿病饮食控制治疗、糖尿病病程长、合并高血压、合并肾脏或心脑血管疾病、术前合并NVI、未联合白内障超声乳化手术、NVD伴出血、术毕未行玻璃体腔内注射抗VEGF药物治疗、术毕玻璃体腔无菌空气填充是PDR伴VH患者PPV术后发生PVH的危险因素。由于本研究回顾病例时间跨度大,随访时间较短及研究对象的选择存在潜在偏倚,可能会导致结果偏倚或分析误差,未来尚需行多中心临床研究进一步完善。
利益冲突所有作者均声明不存在利益冲突

