N-取代苯基-4-(1-甲基-1H-吡唑-5-基)噻吩-2-甲酰胺的合成、杀菌活性及分子对接
程敬丽, 李安邦, 肖豆鑫, 赵金浩
(浙江大学 农药与环境毒理研究所,杭州 310058)
琥珀酸脱氢酶抑制 (SDHI) 类杀菌剂具有广谱、高效、低毒和环境相容性好等优点,迄今已有20 多个品种商品化[1]。通过分析现有SDHI 的分子结构,发现其均含羧酸母核骨架、酰胺骨架和胺部分[2-3],其中酰胺骨架高度保守,胺部分多为取代的芳香胺或者杂环胺,而羧酸母核骨架的结构相对变化丰富[4]。从上市的品种来看,SDHI 类杀菌剂以取代的吡唑甲酰胺骨架结构类型居多[5]。例如萎锈灵、氟酰胺、甲呋酰胺、噻氟酰胺、啶酰菌胺和氟唑菌酰胺,分别含有氧硫杂芑环、苯环、呋喃环、吡啶环、吡唑环和噻唑环等[6]。虽然已经商品化的SDHI 类杀菌剂活性较高,但由于其骨架结构变化小,导致其杀菌谱较窄,且很快产生交互抗性[7-8],因此,迫切需要创制具备新颖骨架结构的SDHI 类杀菌剂。
当前,对SDHI 类杀菌剂进行结构改造的热点在于侧链胺取代基的修饰[9-12],而对羧酸母核骨架和酰胺骨架的改造相对较少,如耿瑞等将叔醇结构引入到吡唑羧酸的骨架中,具有一定的新颖性[13]。羧酸母核中含有吡唑的商品化品种已有11 个,吡唑环的引入大大增强了其杀菌活性,如氟唑菌酰胺、氟唑菌酰羟胺和苯并烯氟菌唑等[14]。2014 年商品化的异丙噻菌胺 (isofetamid) ,是由日本石原产业开发的一种新型噻吩酰胺类杀菌剂,也是唯一的羧酸母核中含噻吩结构的SDHI 类产品[5],其作为一种内吸性杀菌剂,兼具预防和治疗作用,用于防控菌核病和灰霉病等[15]。
骨架跃迁是先导优化策略中常见的方法之一,通过骨架中某一部分的替换跃迁,不仅可以提高先导配体与受体的亲和力[16-17],改善先导化合物的稳定性[18],还可以降低先导化合物的毒性[19]、规避知识产权的保护等[20]。本课题组在前期研究中,在保留吡唑甲酰胺的基础上,发现了一个具有新颖吡唑联苯羧酸骨架的SDHI 类先导化合物A16C[21]。为进一步优化此先导结构,本研究通过骨架跃迁,将吡唑联苯酰胺骨架中的苯环替换为异丙噻菌胺中的活性基团噻吩,设计、合成了18个结构新颖的噻吩吡唑甲酰胺类衍生物 (目标化合物的设计策略见图式1,合成路线见图式2),其中17 个化合物为首次报道。初步研究了该系列衍生物对植物病原真菌的杀菌活性,并利用分子对接方法初步研究了目标化合物与琥珀酸脱氢酶(SDH)的结合模式,以期发现具有新颖骨架结构的SDHI 类杀菌剂。
1 试验部分
1.1 仪器与试剂
AVANCE III 400-MHz 型核磁共振波谱仪(TMS 为内标,DMSO-d6为溶剂,瑞士布鲁克公司);6 530 Q-TOF 液相-质谱联用仪 (美国安捷伦公司);Quattro Premier XE 液相-质谱联用仪 (美国Waters 公司);RY-1g 熔点测定仪 (温度计未校正,天津天光光学仪器有限公司);H 型柱层析硅胶 (青岛海洋化工厂);所有溶剂和试剂均为分析纯。
1.2 供试菌株
水稻立枯丝核菌Rhizoctonia solani、小麦赤霉病菌Fusarium graminearum、油菜菌核病菌Sclerotinia sclerotiorum、马铃薯早疫病菌Alternaria solani、草莓灰霉病菌Botrytis cinerea和水稻恶苗病菌Fusarium moniliforme,均为本研究所保存和提供。
1.3 化合物的合成[21]
1.3.1 4-(1-甲基-1H-吡唑-5-基) 噻吩-2-甲酸 (中间体2-1) 的合成 将22.90 g 1-甲基-1H-吡唑-5-硼酸频哪醇酯 (110 mmol)、22.1 g 4-溴噻吩-2-甲酸甲酯 (100 mmol)、26.67 g 磷酸三钾 (三水合物)(100 mmol)、11.5 g 四 (三苯基膦) 钯 (Pd(PPh3)4)(10 mmol) 和160 mLN,N-二甲基甲酰胺 (DMF) 混合均匀,在氮气保护下搅拌回流7 h。冷却,用饱和氯化钠水溶液(50 mL × 3) 洗涤,乙酸乙酯(60 mL × 3) 萃取,50 g 无水硫酸钠干燥,减压蒸馏得23.6 g 黄色固体 (100 mmol)。加入甲醇30 mL 和质量分数为8 %的氢氧化钠溶液50 mL,常温搅拌4.5 h 后减压蒸馏,用乙酸乙酯(30 mL ×3) 洗涤,水相用体积分数为8 %的盐酸调节pH值至3~4,立即出现白色沉淀。抽滤,干燥,得到13.53 g 化合物 2-1。白色固体,产率65 %,m.p.189~191 ℃。1H NMR (400 MHz, DMSO-d6),δ:8.10 (d,J= 1.5, 1H), 7.94 (d,J= 1.5, 1H), 7.43 (d,J= 1.9, 1H), 6.54 (d,J= 1.9, 1H), 3.93 (s, 3H).13C NMR (101 MHz, DMSO-d6),δ: 162.7, 137.9, 137.2,135.6, 133.1, 131.2, 130.4, 106.1, 38.0. HRMS(m/z,ESI-) 计算值 C9H8N2O2S-[M-H]-207.023 4, 实测值207.023 6。
1.3.2 4-(1-甲基-1H-吡唑-4-基) 噻吩-2-甲酸 (中间体2-2) 的合成 参考文献[22]的方法合成,得到白色固体,收率70 %,m.p. 194~197 ℃(文献值[21]:m.p. 195~197 ℃,收率74 %)。1H NMR (400 MHz,DMSO-d6),δ: 8.11 (s, 1H), 7.93 (d,J= 1.6 Hz, 1H),7.84 (d,J= 1.5 Hz, 1H), 7.83 (s, 1H), 3.84 (s, 3H).13C NMR (101 MHz, DMSO-d6),δ: 163.0, 136.5,135.1, 134.4, 131.6, 128.3, 125.0, 117.0, 38.7.HRMS(m/z, ESI-) 计算值 C9H8N2O2S-[M-H]-207.023 4,实测值207.023 5。
1.3.3 目标化合物N-取代苯基-4-(1-甲基-1H-吡唑-5-基) 噻吩-2-甲酰胺类化合物的合成通法 参考文献[22]的方法进行。将化合物2-1 或2-2 溶于二氯甲烷中,滴加草酰氯 ((COCl)2),在氮气保护及室温下搅拌2 h。降温至0 ℃,分别滴加各种胺和三乙胺的混合物,升温至室温反应2 h。滴加稀盐酸调节pH 值至3~4,用饱和氯化钠水溶液(25 mL × 3)洗涤、二氯甲烷(50 mL × 3) 萃取,减压蒸馏,柱层析 (V(石油醚 ):V(乙酸乙酯) = 3 : 1)纯化,分别制备得到目标化合物3a~3n,4a~4d(其中4d 为已知物[22])。
N-(4-溴苯基)-4-(1-甲基-1H-吡唑-5-基) 噻吩-2-甲酰胺(3a):淡黄色固体,收率85.5 %, m.p. 162~163 ℃;1H NMR(400 MHz, DMSO-d6),δ: 10.41 (s, 1H), 8.23 (d,J= 1.3 Hz,1H), 8.12 (d,J= 1.4 Hz, 1H), 7.74 - 7.67 (m, 2H), 7.60 - 7.53(m, 2H), 7.48 (d,J= 1.9 Hz, 1H), 6.50 (d,J= 1.9 Hz, 1H),3.96 (s, 3H).13C NMR (101 MHz, DMSO-d6),δ: 159.6, 140.4,138.0, 138.0, 137.4, 131.7, 131.0, 129.4, 129.4, 122.4, 115.8,105.9, 38.1. HRMS(m/z, ESI-) 计算值 C15H11BrN3OS [M-H]-359.981 2, 实测值 359.981 4。
N-(4-溴-2-甲基苯基)-4-(1-甲基-1H-吡唑-5-基) 噻吩-2-甲酰胺(3b):淡黄色固体,收率79.2 %, m.p. 152~153 ℃;1H NMR (400 MHz, DMSO-d6),δ: 10.07 (s, 1H), 8.21 (s, 1H),8.10 (d,J= 1.4 Hz, 1H), 7.53 (d,J= 1.9 Hz, 1H), 7.47 (d,J=1.9 Hz, 1H), 7.43 (dd,J= 8.4, 2.1 Hz, 1H), 7.30 (d,J= 8.5 Hz,1H), 6.50 (d,J= 1.9 Hz, 1H), 3.96 (s, 3H), 2.24 (s, 3H);13C NMR (101 MHz, DMSO-d6),δ: 159.7, 140.1, 138.0, 137.4,136.8, 135.2, 133.0, 131.0, 129.3, 129.1, 129.1, 128.7, 118.8,105.9, 38.1, 17.7. HRMS(m/z, ESI-) 计算值 C16H13BrN3OS[M-H]-373.996 8, 实测值 373.998 4。
N-甲基-4-(1-甲基-1H-吡唑-5-基)-N-苯基噻吩-2-甲酰胺(3c):淡黄色固体,收率82.6 %, m.p. 166~153 ℃;1H NMR(400 MHz, DMSO-d6),δ: 7.86 (d,J= 1.5 Hz, 1H), 7.52 - 7.39(m, 5H), 7.35 (d,J= 1.9 Hz, 1H), 6.60 (d,J= 1.3 Hz, 1H),6.16 (d,J= 1.9 Hz, 1H), 3.63 (s, 3H), 3.36 (s, 3H);13C NMR(101 MHz, DMSO-d6),δ: 161.1, 143.9, 139.0, 137.8, 137.2,131.2, 130.0, 129.7, 128.6, 128.4, 128.2, 105.5, 38.7, 37.7.HRMS(m/z, ESI-) 计算值C16H14N3OS [M-H]-296.086 3, 实测值 296.086 5。
N-(4-氯苯基)-4-(1-甲基-1H-吡唑-5-基) 噻吩-2-甲酰胺(3d):白色固体,收率72.8 %, m.p. 192~193 ℃;1H NMR(400 MHz, DMSO-d6),δ: 10.42 (s, 1H), 8.23 (d,J= 1.4 Hz,1H), 8.11 (d,J= 1.1 Hz, 1H), 7.80-7.72 (m, 2H), 7.48 (d,J=1.9 Hz, 1H), 7.46 - 7.41 (m, 2H), 6.51 (d,J= 1.9 Hz, 1H),3.96 (s, 3H);13C NMR (101 MHz, DMSO-d6),δ: 159.7, 140.4,138.0, 137.6, 137.4, 131.0, 129.4, 129.4, 128.8, 127.7, 122.0,105.9, 38.1. HRMS(m/z, ESI-) 计算值C15H11ClN3OS [M-H]-316.031 7, 实测值 316.031 9。
N-(2,5-二甲基苯基)-4-(1-甲基-1H-吡唑-5-基) 噻吩-2-甲酰胺(3e):灰褐色固体,收率70.1 %, m.p. 158~159 ℃;1H NMR (400 MHz, DMSO-d6),δ: 9.99 (s, 1H), 8.21 (s, 1H),8.08 (d,J= 1.4 Hz, 1H), 7.47 (d,J= 1.9 Hz, 1H), 7.17 (d,J= 7.7 Hz,1H), 7.13 (s, 1H), 7.01 (d,J= 7.7 Hz, 1H), 6.50 (d,J= 1.9 Hz,1H), 3.96 (s, 3H), 2.28 (s, 3H), 2.19 (s, 3H);13C NMR (101 MHz, DMSO-d6),δ: 159.6, 140.6, 138.0, 137.5, 135.5, 135.3,131.0, 130.8, 130.3, 128.9, 128.8, 127.3, 127.1, 105.8, 38.1,20.6, 17.6. HRMS(m/z, ESI-) 计算值 C17H16N3OS [M-H]-310.102 0, 实测值 310.102 4。
N-(3-氯苯基)-4-(1-甲基-1H-吡唑-5-基) 噻吩-2-甲酰胺(3f): 白色固体,收率87.7 %. m.p. 170~171 ℃;1H NMR(400 MHz, DMSO-d6),δ: 10.45 (s, 1H), 8.25 (d,J= 1.4 Hz,1H), 8.13 (d,J= 1.3 Hz, 1H), 7.90 (t,J= 2.0 Hz, 1H), 7.70 -7.63 (m, 1H), 7.48 (d,J= 1.9 Hz, 1H), 7.41 (t,J= 8.1 Hz, 1H),7.23 - 7.15 (m, 1H), 6.51 (d,J= 1.9 Hz, 1H), 3.97 (s, 3H).13C NMR (101 MHz, DMSO-d6),δ: 160.2, 140.6, 140.5, 138.4,137.7, 133.5, 131.4, 131.0, 130.0, 129.9, 124.1, 120.3, 119.1,106.3, 38.5. HRMS(m/z, ESI-) 计算值 C15H11ClN3OS [M-H]-316.031 7, 实测值 316.031 7。
4-(1-甲基-1H-吡唑-5-基)-N-(对甲苯基) 噻吩-2-甲酰胺(3g): 白色固体,收率82.3 %, m.p. 175~177 ℃;1H NMR(400 MHz, DMSO-d6),δ: 10.29 (s, 1H), 8.32 - 8.18 (m, 1H),8.07 (s, 1H), 7.62 (d,J= 8.4 Hz, 2H), 7.47 (d,J= 1.8 Hz, 1H),7.17 (d,J= 8.3 Hz, 2H), 6.51 (d,J= 1.8 Hz, 1H), 3.97 (s, 3H),2.28 (s, 3H);13C NMR (101 MHz, DMSO-d6),δ: 159.4, 140.9,138.0, 137.5, 136.1, 133.1, 130.9, 129.2, 129.0, 120.6, 105.9,38.1, 20.6. HRMS(m/z, ESI-) 计算值 C16H14N3OS [M-H]-296.086 3,实测值 296.086 5。
4-(1-甲基-1H-吡唑-5-基)-N-(间甲苯基) 噻吩-2-甲酰胺(3h): 白色固体,收率86.4 %, m.p. 172~173 ℃;1H NMR(400 MHz, DMSO-d6),δ: 10.29 (s, 1H), 8.30 (s, 1H), 8.09 (d,J= 1.3 Hz, 1H), 7.54 - 7.56 (m, 2H), 7.47 (d,J= 1.9 Hz, 1H),7.25 (t,J= 7.7 Hz, 1H), 6.95 (d,J= 7.5 Hz, 1H), 6.51 (d,J=1.9 Hz, 1H), 3.97 (s, 3H), 2.32 (s, 3H);13C NMR (101 MHz,DMSO-d6),δ: 159.5, 140.9, 138.5, 138.0, 137.9, 137.5, 131.0,129.1, 128.7, 124.7, 121.1, 117.7, 105.8, 38.1, 21.3. HRMS(m/z, ESI-) 计算值 C16H14N3OS [M-H]-296.086 3, 实测值296.086 0。
N-(3-甲氧基苯基)-4-(1-甲基-1H-吡唑-5-基) 噻吩-2-甲酰 (3i):浅灰色固体,收率69.5 %, m.p.184~185 ℃;1H NMR(400 MHz, DMSO-d6),δ: 10.34 (s, 1H), 8.31 (s, 1H), 8.09 (s,1H), 7.52-7.45 (m, 1H), 7.42 (s, 1H), 7.33 (d,J= 8.2 Hz,1H), 7.27 (t,J= 8.1 Hz, 1H), 6.71 (d,J= 8.0 Hz, 1H), 6.51 (d,J= 1.5 Hz, 1H), 3.97 (s, 3H), 3.76 (s, 3H);13C NMR (101 MHz,DMSO-d6),δ: 159.6, 159.6, 140.8, 139.8, 137.9, 137.4, 131.0,129.6, 129.2, 112.7, 109.6, 106.2, 105.9, 55.2, 38.1.HRMS(m/z, ESI-) 计算值 C16H14N3O2S [M-H]-312.081 2, 实测值 316.081 3。
4-(1-甲基-1H-吡唑-5-基)-N-苯基噻吩-2-甲酰胺 (3j):淡黄色固体,收率77.6 %. m.p. 154~155 ℃;1H NMR (400 MHz,DMSO-d6),δ: 10.31 (s, 1H), 8.25 (s, 1H), 8.09 (d,J= 1.2 Hz,1H), 7.73 (d,J= 8.1 Hz, 2H), 7.48 (d,J= 1.7 Hz, 1H), 7.38 (t,J= 7.9 Hz, 2H), 7.13 (t,J= 7.4 Hz, 1H), 6.51 (d,J= 1.7 Hz,1H), 3.97 (s, 3H);13C NMR (101 MHz, DMSO-d6),δ: 159.5,140.7, 138.6, 137.9, 137.4, 130.9, 129.1, 128.8, 124.1, 120.5,105.8, 38.1. HRMS(m/z, ESI-) 计算值 C15H12N3OS [M-H]-282.070 7, 实测值 282.070 9。
4-(N-苄基-4-(1-甲基-1H-吡唑-5-基) 噻吩-2-甲酰胺(3k):淡黄色固体,收率78.2 %, m.p. 139~140 ℃;1H NMR(400 MHz, DMSO-d6),δ: 9.15 (t,J= 5.9 Hz, 1H), 8.07 (d,J=1.4 Hz, 1H), 8.01 (d,J= 1.4 Hz, 1H), 7.45 (d,J= 1.9 Hz, 1H),7.35 - 7.24 (m, 5H), 6.45 (d,J= 1.9 Hz, 1H), 4.49 (d,J= 6.0 Hz, 2H), 3.94 (s, 3H);13C NMR (101 MHz, DMSO-d6),δ:160.9, 140.6, 139.3, 137.9, 137.5, 130.9, 128.5, 128.3, 128.2,127.5, 127.0, 105.7, 42.7, 38.1. HRMS(m/z, ESI-) 计算值C16H14N3OS [M-H]-296.086 3, 实测值 296.086 5。
4-(N-(2-氯苯基)-4-(1-甲基-1H-吡唑-5-基) 噻吩-2-甲酰胺 (3l):淡黄色固体,收率83.5 %, m.p. 130~131 ℃;1H NMR (400 MHz, DMSO-d6),δ: 10.27 (s, 1H), 8.27 (d,J=1.4 Hz, 1H), 8.11 (d,J= 1.4 Hz, 1H), 7.60 (td,J= 7.9, 1.5 Hz,1H), 7.47 (d,J= 1.9 Hz, 1H), 7.39 - 7.17 (m, 3H), 6.51 (d,J=1.9 Hz, 1H), 3.97 (s, 3H).13C NMR (101 MHz, DMSO-d6),δ:159.7, 139.8, 138.0, 137.4, 131.1, 129.5, 129.4, 127.3, 127.3,125.1, 125.0, 124.6, 124.5, 116.1, 115.9, 105.9, 38.1.HRMS(m/z, ESI-) 计算值 C15H11ClN3OS [M-H]-316.031 7,实测值 316.032 2。
N-(4-氟苯基乙基)-4-(1-甲基-1H-吡唑-5-基) 噻吩-2-甲酰胺 (3m):淡黄色液体,收率90.1 %;1H NMR (400 MHz,DMSO-d6),δ: 8.69 (t,J= 5.3 Hz, 1H), 8.00 - 7.93 (m, 2H),7.45 (s, 1H), 7.31- 7.24 (m, 2H), 7.12 (t,J= 8.8 Hz, 2H), 6.44(s, 1H), 3.93 (s, 3H), 3.51 - 3.40 (m, 2H), 2.85 (t,J= 7.3 Hz,2H);13C NMR (101 MHz, DMSO-d6),δ: 160.8 (d,J=241.3 Hz), 160.6, 140.6, 137.8, 137.3, 135.4 (d,J= 3.1 Hz),130.6, 130.4 (d,J= 7.9 Hz), 127.9, 127.7, 115.0 (d,J=21.0 Hz), 105.5, 40.7, 37.9, 34.1. HRMS(m/z, ESI-) 计算值C17H15FN3OS [M-H]-328.092 5, 实测值 328.093 0。
N-(4-(叔丁基) 苯基)-4-(1-甲基-1H-吡唑-5-基) 噻吩-2-甲酰胺 (3n):淡黄色液体,收率82.8 %;1H NMR (400 MHz,DMSO-d6),δ: 9.09 (t,J= 5.9 Hz, 1H), 8.05 (d,J= 1.4 Hz,1H), 7.98 (d,J= 1.4 Hz, 1H), 7.43 (d,J= 1.9 Hz, 1H), 7.35 (d,J= 8.4 Hz, 2H), 7.26 (d,J= 8.4 Hz, 2H), 6.44 (d,J= 1.9 Hz,1H), 4.43 (d,J= 5.8 Hz, 2H), 3.93 (s, 3H), 1.26 (s, 9H);13C NMR (101 MHz, DMSO-d6),δ: 160.8, 149.5, 140.7, 137.9,137.6, 136.3, 130.9, 128.2, 128.1, 127.4, 125.2, 105.7, 42.5,38.1, 34.3, 31.3. HRMS(m/z, ESI-) 计算值 C20H22N3OS [MH]-352.148 9, 实测值 352.149 3。
4-(1-甲基-1H-吡唑-4-基)-N-苯基噻吩-2-甲酰胺 (4a):白色固体,收率68.6 %. m.p. 182~183 ℃;1H NMR (400 MHz, DMSO-d6),δ: 10.25 (s, 1H), 8.19 (d,J= 1.4 Hz, 1H),8.03 (s, 1H), 7.82 (d,J= 1.4 Hz, 1H), 7.77 (d,J= 0.9 Hz, 1H),7.75 - 7.73 (m, 2H), 7.37 (t,J= 7.9 Hz, 2H), 7.11 (t,J=7.4 Hz, 1H), 3.88 (s, 3H);13C NMR (101 MHz, DMSO-d6),δ:159.9, 140.3, 138.8, 136.3, 134.2, 128.8, 128.0, 127.7, 123.9,123.7, 120.4, 117.3, 38.8. HRMS(m/z, ESI-) 计算值C15H12N3OS [M-H]-282.070 7, 实测值 282.070 9。
4-(1-甲基-1H-吡唑-4-基)-N-(4-(三氟甲氧基) 苯基) 噻吩-2-甲酰胺 (4b):白色固体,收率71.6 %, m.p. 185~187 ℃;1H NMR (400 MHz, DMSO-d6),δ: 10.44 (s, 1H), 8.18 (d,J= 1.3 Hz, 1H), 8.04 (s, 1H), 7.88 - 7.81 (m, 3H), 7.80 - 7.75(m, 1H), 7.38 (d,J= 8.4 Hz, 2H), 3.88 (s, 3H);13C NMR (101 MHz,DMSO-d6),δ: 160.1, 144.03 (d,J= 2.0 Hz), 139.8, 138.1,136.3, 134.2, 128.0, 128.0, 124.1, 121.7, 121.7, 120.26 117.3,38.8. HRMS(m/z, ESI-) 计算值 C16H11F3N3O2S [M-H]-366.366.052 7, 实测值 366.052 9。
4-(1-甲基-1H-吡唑-4-基)-N-(间甲苯基) 噻吩-2-甲酰胺(4c):白色固体,收率77.8 %, m.p. 195~196 ℃;1H NMR(400 MHz, DMSO-d6),δ: 10.16 (s, 1H), 8.19 (d,J= 1.3 Hz,1H), 8.02 (s, 1H), 7.81 (d,J= 1.3 Hz, 1H), 7.76 (d,J= 0.6 Hz,1H), 7.56 (s, 1H), 7.53 (d,J= 8.3 Hz, 1H), 7.24 (t,J= 7.8 Hz,1H), 6.93 (d,J= 7.5 Hz, 1H), 3.88 (s, 3H), 2.31 (s, 3H);13C NMR (101 MHz, DMSO-d6),δ: 159.8, 140.3, 138.7, 138.0,136.3, 134.2, 128.7, 127.9, 127.7, 124.6, 123.7, 120.9, 117.5,117.4, 38.8, 21.3. HRMS(m/z, ESI-) 计算值 C16H14N3OS [MH]-296.086 0, 实测值296.086 1。
4-(1-甲基-1H-吡唑-4-基)-N-(4-氯苯基) 噻吩-2-甲酰胺(4d)[22]:白色固体,收率84.5 %, m.p. 171~173 ℃(文献值[22]:收率82.5 %. m.p. 172~173 ℃);1H NMR (400 MHz, DMSOd6),δ: 10.40 (s, 1H), 8.19 (d,J= 1.4 Hz, 1H), 8.06 (d,J= 0.7 Hz,1H), 7.87 (d,J= 1.3 Hz, 1H), 7.82 - 7.77 (m, 3H), 7.45 (d,J=8.9 Hz, 2H), 3.90 (s, 3H).13C NMR (101 MHz, DMSO-d6),δ:160.1, 139.9, 137.9, 136.3, 134.3, 128.8, 128.1, 127.9, 127.6,124.0, 121.9, 117.4, 38.8. HRMS(m/z, ESI-) 计算值C15H11ClN3OS [M-H]-316.031 7, 实测值 316.031 9。
1.4 杀菌活性测定
1.4.1 杀菌活性初筛 采用菌丝生长速率法[23]测定。以噻呋酰胺为对照药剂。称取0.05 g (精确到0.000 1 g) 待测化合物,用2.50 mL 含质量分数1%吐温-20 的DMF 溶液溶解,配制成20 000 mg/L的母液。各取母液0.20 mL,加入PDA 培养基中,制作含药培养基,药剂最终质量浓度为50 mg/L。将直径为6.00 mm 的供试病原菌块转移至含药培养基中。每处理3 次重复。以仅用DMF 处理过的菌块为空白对照,于 (23±2) ℃下培养4 d 后测量菌落直径,计算其生长抑制率[22]。
1.4.2 杀菌活性复筛 采用菌丝生长速率法[23]测定。选择水稻纹枯病菌、马铃薯早疫病菌、小麦赤霉病菌和草莓灰霉病菌为供试病原菌,对于初筛活性较好的化合物测定其EC50值。化合物的质量浓度梯度为50、25、12.5、3.125 和0.78 mg/L。
1.5 结合模式研究
通过分子对接研究配体和受体之间相互作用预测其结合模式。参考刘幸海等[24-25]的研究,在SDH 的活性口袋中对接活性较强的化合物3m。首先在蛋白数据库 (Protein Data Bank) 中,找到并下载SDH 的结构 (PDB 代码:2FBW)[26],对受体蛋白进行预处理,去除受体2FBW 的水分子和其他金属原子,定义对接位点,然后绘制化合物3m 的分子结构 (Discovery Studio 2.5),对其进行能量最小化优化,最后执行对接程序[27],详细方法参考本课题组以往工作[22,28]。
2 结果与讨论
2.1 目标化合物合成
参考文献方法,以4-溴噻吩-2-甲酸甲酯为原料,在四 (三苯基膦) 钯催化作用下与1-甲基-1H-吡唑-5-硼酸频哪醇酯 (或1-甲基-1H-吡唑-4-硼酸频哪醇酯) 反应后得黄色固体;加入甲醇和氢氧化钠溶液进一步水解,反应完成后立即加入盐酸,调节pH 值至3~4,抽滤后得到中间体2-1(或2-2[22])。中间体2 溶于二氯甲烷 (DCM) 中与草酰氯反应生成酰氯,低温 (冰水浴) 下滴加各种胺类中间体和三乙胺的混合物,得到衍生物3[28]和4[21]。该合成路线操作简单,反应条件温和。共合成了18 个目标衍生物,其中17 个未见报道,其结构均得到1H NMR、13C NMR 和HRMS 确证。
2.2 杀菌活性
初步离体杀菌活性测定结果 (表1) 表明,在50 mg/L 下,化合物3m 和4d 对水稻立枯丝核菌、化合物3k 和4d 对小麦赤霉病菌、化合物4d 对马铃薯早疫病菌、化合物3k、3m 和3n 对草莓灰霉病菌均具有优异的抑制作用,抑制率均在80 %以上,尤其是化合物3m 对草莓灰霉病菌的杀菌活性高于对照药剂噻呋酰胺。所有化合物对油菜菌核病和水稻恶苗病菌活性均较弱。
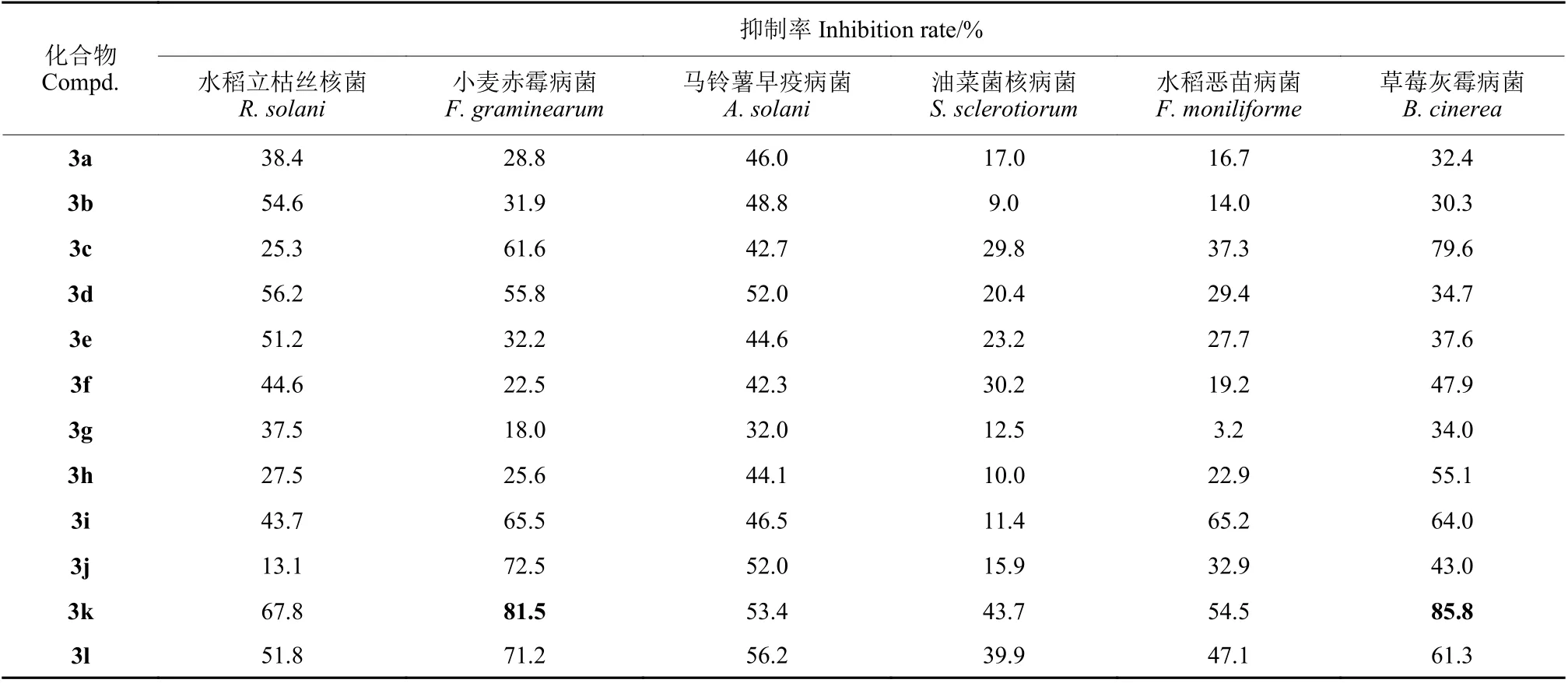
表1 目标化合物对6 种植物病原菌的抑制作用Table 1 Inhibition of target compounds against six pathogenic fungi in vitro
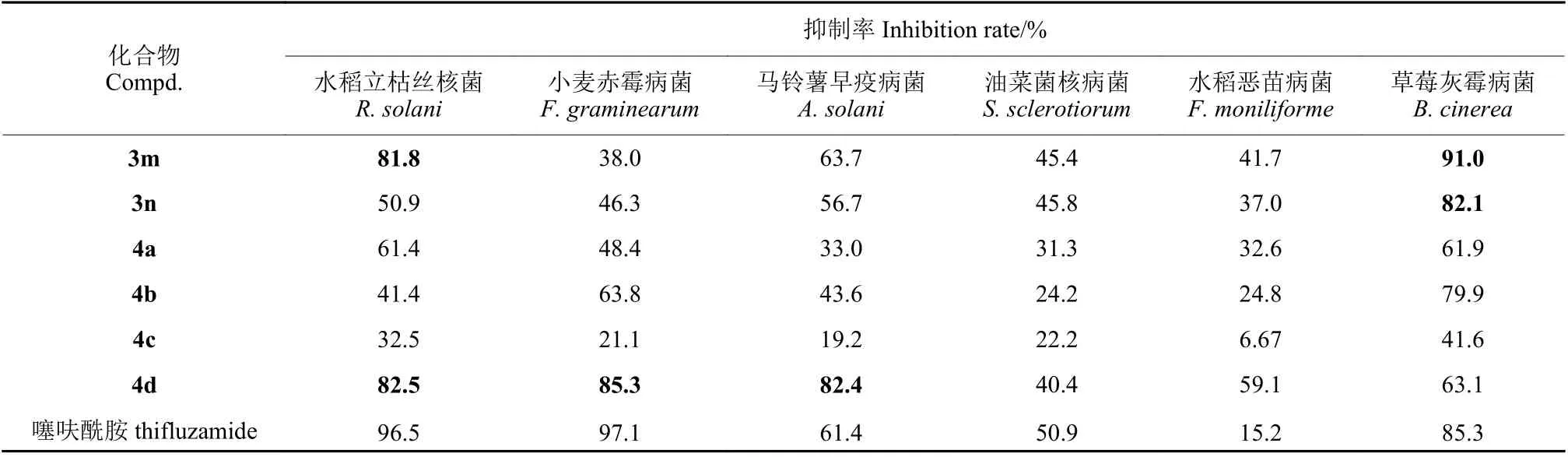
续表1Table 1 (Continued)
根据初筛试验结果,以商品化噻呋酰胺为对照药剂,测定了部分化合物的EC50值。从表2 数据可以看出,化合物3m 和4d 对水稻立枯丝核菌具有一定的抑制活性,化合物3k 和4d 对小麦赤霉病菌的活性较强,化合物4d 对马铃薯早疫病菌的EC50值为15.7 mg/L,活性略高于噻呋酰胺,化合物3k 和3m 对草莓灰霉病菌的EC50值分别为15.3 和9.9 mg/L,活性与对照药剂噻呋酰胺相当。
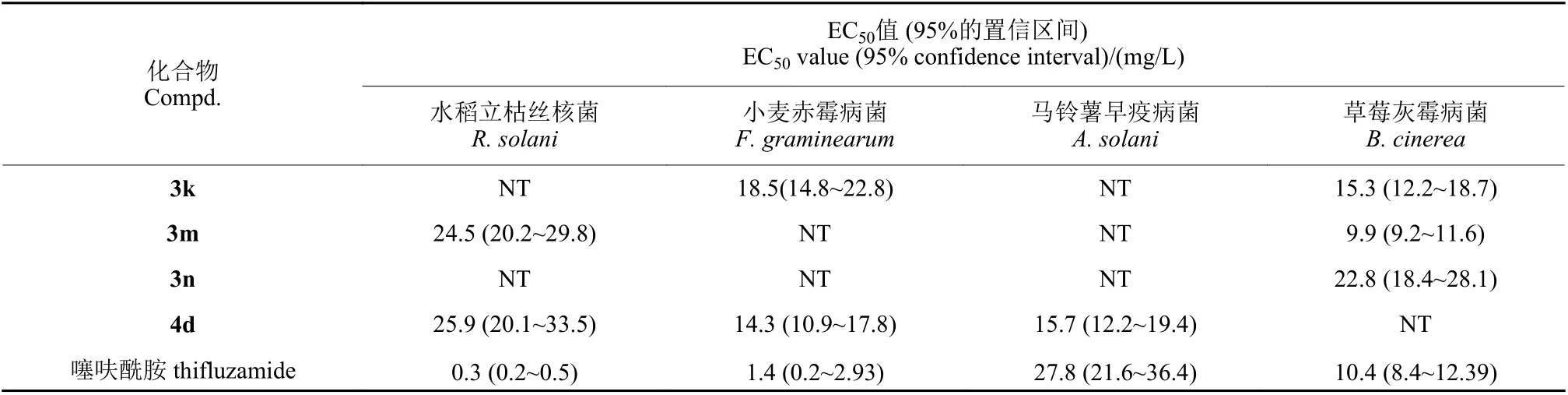
表2 部分目标化合物对4 种植物病原菌的EC50 值Table 2 EC50 value of some target compounds against four tested phytopathogens
从目标化合物的分子结构来分析,化合物3d/4d、3h/4c 和3j/4a 是3 对吡唑环的位置异构体,当胺部分为取代苯胺和间甲基苯胺时,3h/4c,3j/4a 对6 种病原菌的活性差异都不大,说明吡唑环取代位置影响不大,但是当胺部分为对氯苯氨基时,4-吡唑取代化合物4d 与5-取代吡唑化合物3d 相比,对6 种病原菌的活性明显都偏高,说明4-吡唑位取代比5-吡唑位取代的位置异构体活性要高,可能与对位氯原子的吸电子效应有关。另外,在化合物3k、3m 和3n 结构中,当中间体的-NHR 与苯环间插入亚甲基或亚乙基时,-NHR 上氮原子的孤对电子无法与苯环共轭,从而使胺的碱性增强,由于苯乙胺的碱性强于苄胺,且均强于芳香胺,导致活性有所增强;对于化合物3m,在胺部分中苯乙氨基的对位引入氟原子时,由于氟原子具有吸电子效应、模拟特性、渗透效应和阻碍效应等[29],再加上对氟苯乙氨基具有较强的碱性,可能导致了化合物3m 对水稻立枯丝核菌和草莓灰霉病菌的杀菌活性明显提高。其他苯环上的各种取代基与杀菌活性之间没有明显的规律性。根据我们先前的研究,吡唑联苯[21]、吡唑联吡咯[28]和吡唑联呋喃甲酰胺类[28]等吡唑杂环甲酰胺类衍生物对病原真菌都表现出优异的杀菌活性,而引入噻吩环时,可能由于硫原子电负性小于氮原子和氧原子,导致目标衍生物对油菜菌核病菌的特异性下降,但对草莓灰霉病菌的活性明显增强。
2.3 结合模式研究
通过分子对接,将活性较高的衍生物3m 和异丙噻菌胺 (配体) 分别对接到SDH (受体) 的活性位点,对接结果如图1 所示,衍生物3m 分子结构中的羧酸骨架插入到SDH 受体的疏水性口袋中,酰胺键上的羰基O 原子与受体B 链173 Trp上H 原子的距离为0.219 nm,形成了较强的氢键相互作用,这种氢键作用增强了配体和受体的结合力,从而提高了配体化合物的生物活性;异丙噻菌胺的噻吩五元环与D 链的TYR58 氨基酸残基形成π-π 堆叠相互作用,较氢键相互作用弱,酰胺氧与氨基酸残基H 距离0.466 nm。
3 结论
采用骨架跃迁优化策略,将吡唑联苯酰胺骨架中的苯环替换为异丙噻菌胺中的活性基团噻吩,设计合成了18 个N-取代苯基-4-(1-甲基-1H-吡唑-5-基) 噻吩-2-甲酰胺类衍生物,其中17 个为新化合物。离体杀菌活性试验结果表明,部分目标化合物对草莓灰霉病菌、小麦赤霉病菌和马铃薯早疫病菌显示出较好的活性, 其中化合物3k 和4d 对小麦赤霉病菌的EC50值分别为18.5和14.3 mg/L,有一定的抑制活性,化合物4d 对马铃薯早疫病菌的EC50值为15.7 mg/L,活性略高于噻呋酰胺 (EC50值27.8 mg/L);化合物3k 和3m 对草莓灰霉病菌的EC50值为15.3 和9.9 mg/L,与对照药剂噻呋酰胺活性 (EC50值10.4 mg/L) 相当。分子对接研究结果表明:具有较高活性的配体N-(4-氟苯基乙基)-4-(1-甲基-1H-吡唑-5-基) 噻吩-2-甲酰胺 (3m) 上的酰胺官能团与受体琥珀酸脱氢酶 (SDH) 关键氨基酸残基形成较强的氢键作用,从而增强了配体与受体间的结合力,提高了杀菌活性。因此通过骨架跃迁策略合成的含新颖吡唑噻吩羧酸骨架结构的衍生物,尤其是3k、3m、4d 可作为SDHI 类杀菌先导化合物进一步研究。

