uVEGF、α1-mG及β2-MG水平变化在DN患者中的意义
周树萍,何 琴
流行病学研究表明,糖尿病肾病(DN)的发病率可超过869/1万人左右[1],在合并有基础性高血压或者高脂血症的群体中,DN的发病率可进一步上升[2]。临床上DN的发生,不仅能够导致患者生活质量的下降,同时还能够增加远期肾功能衰竭或者多器官功能障碍的发生风险。DN的早期诊断有重要的意义,其能够在DN的早期临床干预方面发挥作用。尿液细胞因子的分析能够在DN的早期诊断过程中发挥作用。血管内皮细胞生长因子(uVEGF)是血管内皮生长因子家族成员,其能够通过诱导血管内皮的损伤,加剧肾小球入球小动脉的痉挛,加剧肾脏组织的缺血缺氧性损伤,促进DN的发生[3]。α1微球蛋白(α1-mG)、β2微球蛋白(β2-MG)是红细胞、间质细胞等有核细胞分泌的糖蛋白因子,在肾小球近端小管重吸收后被分解利用[4-5]。为了揭示uVEGF、α1-mG及β2-MG的表达与DN患者的病情关系,从而为临床上DN的诊疗提供参考,本次研究选取我院确诊的DN患者,探讨了uVEGF、α1-mG及β2-MG的表达及其DN患者肾损害评估的临床价值。
1 资料与方法
1.1 一般资料:选取我院确诊T2DM伴微量清蛋白尿患者90例(微量组)、T2DM伴大量清蛋白尿患者90例(大量组)、健康对象90例作为对照组。微量组患者年龄50~75岁,平均年龄(60.2±8.1)岁,男53例、女37例,BMI(23.3±2.2) kg/m2。大量组患者年龄52~79岁,平均年龄(61.4±7.5)岁,男50例、女40例,BMI (23.2±2.5)kg/m2。对照组年龄45~79岁,平均年龄(59.6±10.2)岁,男50例、女40例;,BMI(22.9±3.0)kg/m2。三组研究对象的年龄、性别、BMI比较差异均无统计学意义(P>0.05)。
1.1.1 诊断及入选标准:①DN患者的诊断标准参考中华医学会制定的标准[6]:尿清蛋白排泄率≥20 μg/min可确诊为DN,其中UAER20~200 μg/min为微量组、UAER≥200 μg/min为大量组;②对照组为健康体检对象;③本研究符合《赫尔透辛基宣言》相关医学伦理规定,经我院医学伦理委员会批准。
1.1.2 研究对象的排除标准:①恶性肿瘤患者;②脑血管疾病患者;③原发性肾脏疾病患者;④高血压疾病患者;⑤长期应用免疫性制剂的患者;⑥严重的肝肾功能疾病患者。
1.2 指标检测方法:采用一次性静脉血采集器进行肘部静脉血采集,采集5 mL静脉血后自然放置,取上清液体进行检测。采用杭州精密仪器公司生产的BIOSYS-2008全自动生化检测仪器进行尿素氮(BUN)、血肌酐(Scr)、空腹血糖(FPG)、糖化血红蛋白(HbA1c)检测,配套试剂盒购自北京博奥森生物公司;采用一次性采集器清洁中段尿液5 mL自然放置,1 000 r/min离心10 min,取上清液体进行检测,采用贝克曼库尔特公司UniCel DxI 800免疫发光仪器进行α1-mG及β2-MG的检测,配套试剂盒购自北京九强生物公司;采用ELISA法进行uVEGF的检测,配套仪器A4500酶标仪购自罗氏检测公司。

2 结果
2.1 3组研究对象的uVEGF、α1-mG及β2-MG水平比较:微量组和大量组的uVEGF、α1-mG及β2-MG显著高于对照组(P<0.05);大量组的uVEGF、α1-mG及β2-MG显著高于微量组(P<0.05),见表1。
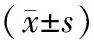
表1 3组研究对象的uVEGF、α1-mG及β2-MG水平比较
2.2 3组研究对象的血糖及肾功能指标水平比较:微量组和大量组的BUN、Scr显著高于对照组(P<0.05);大量组的BUN、Scr显著高于微量组(P<0.05);微量组和大量组的FPG及HbA1c显著高于对照组(P<0.05),见表2。
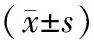
表2 3组研究对象的血糖及肾功能指标水平比较
2.3 uVEGF、α1-mG及β2-MG水平诊断DN的价值:uVEGF水平诊断DN的ROC曲线下面积(AUC值)为0.936,截断值为24.08 mg/24h,灵敏度为88.24%(60/68)、特异度为86.36%(19/22);α1-mG水平诊断DN的AUC值为0.866,截断值为23.16 mg/L,灵敏度为84.29%(59/70)、特异度为85.00%(17/20);β2-MG水平诊断DN的AUC值为0.844,截断值为2.38 mg/L,灵敏度为87.69%(57/65)、特异度为84.00%(21/25),见图1(目录后)、表3。

表3 uVEGF、α1-mG及β2-MG水平诊断DN的价值
3 讨论
临床观察发现,通过糖皮质激素及免疫抑制剂等治疗措施,能够显著改善DN患者的临床结局,降低DN进展为终末期肾功能衰竭的风险。半胱氨酸或者胱抑素C等指标能够在DN肾损害评估过程中发挥一定的早期参考价值。本次研究通过对DN患者尿液中uVEGF、α1-mG及β2-MG的表达分析研究,在揭示DN肾损害进展机理的同时,也为临床上DN肾损害诊断提供了理论方面的参考。
uVEGF是血管内皮生长因子调控成员,其能够通过诱导血管内皮细胞的凋亡,加剧肾脏血管内皮细胞的损伤,进而参与肾小球的损伤及肾单位的损伤过程。基础方面的研究认为,uVEGF的表达上升还能够增加血管内皮细胞的氧化应激性损伤,影响到血管内皮细胞的损伤修复能力[6]。α1-mG及β2-MG是有核细胞分泌的细胞外糖蛋白成分,在体细胞正常生理代谢的过程中,α1-mG及β2-MG可显著释放,并能够通过肾小球进行滤过和重吸收。在肾小球早期滤过功能损伤的过程中,α1-mG及β2-MG的漏出明显增多,同时肾小球对于α1-mG及β2-MG的重吸收明显增加。部分研究者探讨了微球蛋白的表达与DN的关系,认为在DN患者中微球蛋白的表达浓度明显上升[7],但缺乏对于uVEGF的分析研究。
本次研究发现,在尿蛋白组患者中,uVEGF、α1-mG及β2-MG的表达浓度均明显上升,特别是在大量尿蛋白组患者中,uVEGF、α1-mG及β2-MG的表达浓度的上升更为显著,提示了uVEGF、α1-mG及β2-MG的高表达均能够影响到DN肾损害进程。分析其内在的原理,可能与uVEGF、α1-mG及β2-MG的下列几个方面的病理性作用有关[ 8]:①uVEGF的表达浓度的上升,能够加剧肾小球入球小动脉的痉挛程度,加剧肾脏血管的代偿性纤维化改变,影响肾单位的血流灌注水平,进而参与到DN肾损害进展过程;②α1-mG及β2-MG的表达上升,主要是由于DN患者局部肾小球近端小管生理功能的下降,导致α1-mG及β2-MG的灭活分解减少,未经吸收的α1-mG及β2-MG通过尿液排出体外,增加了尿液中α1-mG及β2-MG水平。刘利祥等[9]研究者也发现,在DN患者中,尿液β2-MG的表达浓度可上升30%~45%,同时在肌酐值上升较为明显和肾小球滤过率下降显著的患者中,β2-MG的表达浓度的上升更为显著。BUN、Scr是反应患者肾功能的指标,FPG、HbA1c是反映患者体内血糖控制程度的指标,可以发现在尿蛋白组特别是大量蛋白组患者中,相关血糖及肾功能指标的波动较为显著,提示大量组患者的肾功能损伤较为严重,同时其血糖控制情况较差。诊断学价值分析可见,uVEGF、α1-mG以及β2-MG水平诊断DN肾损害的AUC值、灵敏度、特异度均较高,提示uVEGF、α1-mG及β2-MG在DN肾损害评估中均具有一定的价值,临床上对于uVEGF、α1-mG及β2-MG超过临界值的患者,应早期进行临床干预,进而改善DN患者的临床结局。

