拮抗miR-21对人工合成高效孕激素作用下子宫内膜癌细胞增殖和凋亡的影响
田春花,张 娇,杨梅芳,杨威龙,吴 阳,金 秋,马鸿云
子宫内膜癌(EC)是女性生殖系统恶性肿瘤之一,发病率位于女性恶性肿瘤首位,近年来发病率、死亡率呈逐年递增且年轻化趋势[1],其中有14%左右子宫内膜癌患者是育龄女性[2],这部分人群中约70%仍未生育[3]。以孕激素为基础的保守治疗为这些年轻患者保留生育能力提供了临床选择[4]。然而,孕激素治疗的完全缓解率(CR)仅70%左右,仍有约30%的患者对孕激素治疗不敏感[5],这给有生育要求的早期子宫内膜癌患者的治疗带来困难,究其原因可能与PR 表达水平下降、功能异常以及相关基因突变、信号通路异常等有关[6]。孕激素抵抗机制的靶向治疗可能逆转孕激素抵抗,孕激素联合靶向治疗可能成为早期且有生育要求子宫内膜癌保守治疗的新手段。有研究发现,子宫内膜癌患者中存在多种 mi-RNA的异常表达,这说明 mi-RNA 参与子宫内膜癌的发生、发展[7-8],同时Lai 等[9]的研究发现miR-21具有促进子宫内膜癌发生的作用。本实验在人工合成高效孕激素作用下,研究拮抗miR-21对子宫内膜癌 Ishikawa 细胞的增殖与凋亡的影响。
1 资料与方法
1.1 一般资料:人子宫内膜癌细胞系 Ishikawa(BNCC338359,北纳生物)。
1.2 主要实验试剂与仪器:完全DMEM培养基(KGM12800S-500,凯基生物);LipofectamineTM3000 Transfection Reagent(L3000015,invitrogenTM);miR-21拮抗剂(中洪博元分子实验室提供);人工合成高效孕激素(左炔诺孕:LNG)(S1727);倒置荧光显微镜(MF53,广州市明美光电有限公司);多功能酶标分析仪(SAFIREII,TECAN);离心机(TD4A,长沙英泰仪器有限公司);紫外可见分光光度计(UV-1600PC,上海美谱达仪器有限公司);超高灵敏度化学发光成像系统(Chemi DocTM XRS+,伯乐生命医学产品(上海)有限公司)。
1.3 实验方法
1.3.1 CCK8检测:将人子宫内膜癌细胞消化、重悬、计数、铺96孔板(细胞密度为5×103个/孔),待子宫内膜癌细胞贴壁后,按照分组进行相应处理,处理24 h向待测板中每孔加入10 μl CCK-8(KGA317,凯基生物)反应2 h,分别采用酶标仪(SAFIREII TECAN)在波长450 nm处检吸光值并计算细胞的存活率。
1.3.2 细胞划线:待子宫内膜癌细胞铺板密度达到90%以上后进行细胞划线,使用200 μl枪头(梅特勒-托利多仪器(上海)有限公司)在每孔进行划痕,弃去培养基,用PBS(KGB5001凯基生物)清洗3次,换成无血清培养基后给每孔划痕拍照;将细胞放入培养箱中,24 h后再次给每孔的划痕拍照;48 h后再次给每孔的划痕拍照。测量细胞划痕宽度,进而计算出细胞的迁移速率。
1.3.3 细胞侵袭:将子宫内膜癌细胞消化收集后离心,用无血清培养基重悬细胞并且计数,使每个小室细胞数为3×104个;在小室加入500 μl完全培养基,上室细胞与无血清培养基总体积约300 μl;48 h后进行结晶紫(G1061,Solarbio)染色。去除各孔中的培养基,然后加入PBS(KGB5001 凯基生物)清洗5 min,加配好的0.1%结晶紫染色1 h,染完后擦去小室的内室细胞,之后将小室倒置拍照,拍照完成后去除孔中的染色液,在每个孔中加入配制好的33%乙酸(取33 mL 100%乙酸加到67 mL纯水中混匀)2 mL溶解细胞中的染液,充分混匀静置后,用分光光度计(波长为570 nm),用33%乙酸调零,测定每孔中的溶液的吸光值,平行三次。
1.3.4 流式检测凋亡:在使用流式细胞前,首先对样品进行预处理。弃子宫内膜癌细胞株上清液,每孔1 mL PBS(KGB5001 凯基生物)润洗2边,加200 μl含EDTA胰蛋白酶消化液(T1300 Solarbio),放入37℃培养箱(型号:BPN-80CM,上海一恒科学仪器有限公司),当子宫内膜癌细胞消化后,用含血清的完全培养基终止子宫内膜细胞消化、吹散后收集子宫内膜癌细胞悬液。将子宫内膜癌细胞悬液在2 500 r/min离心(常州中捷实验仪器制造有限公司,型号:TGL-16D)3 min并弃上清液。加1 mL PBS(KGB5001 凯基生物)后再2 500 r/min离心3 min后弃去子宫内膜癌细胞上清液,每管加PBS 300 μl混匀后再加入 5 μl Annexin V-FITC(AP101-100-kit,MULTI SCIENCES 联科生物) 和 5 μl PI,轻混匀后,待室温避光孵育10 min后上机。
1.4 实验分组:空白细胞组为未经任何处理的 子宫内膜癌Ishikawa 细胞;高效孕激素组为经人工合成高效孕激素处理的子宫内膜癌Ishikawa 细胞;高效孕激素+miR-21组为经人工合成高效孕激素联合miR-21拮抗剂处理的子宫内膜 Ishikawa 细胞。

2 结果
2.1 各组干预前、后Ishikawa细胞增殖情况的变化: 干预前与干预24 h后高效孕激素组细胞增殖率、高效孕激素+miR-21组细胞增殖率比较差异有统计学意义(P<0.05);干预后,高效孕激素+miR-21组细胞增殖率最低(P<0.05),见表1。
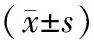
表1 各组干预前、后细胞增殖情况的比较
2.2 各组干预前、后Ishikawa细胞迁移情况的变化:干预前与干预24 h后高效孕激素组细胞迁移率、高效孕激素+miR-21组细胞迁移率比较差异有统计学意义(P<0.05)。干预后,高效孕激素+miR-21组细胞迁移率最低(P<0.05),见表2。
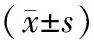
表2 各组干预前、后细胞迁移情况的比较
2.3 各组干预前、后Ishikawa细胞侵袭情况的变化:干预前与干预24h高效孕激素组细胞侵袭力、高效孕激素+miR-21组细胞侵袭力比较差异有统计学意义(P<0.05);高效孕激素+miR-21组细胞侵袭力最低(P<0.05),见表3。
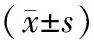
表3 各组干预前、后细胞侵袭情况的比较
2.4 各组干预前、后Ishikawa细胞凋亡情况的变化:干预前与干预24 h后高效孕激素组细胞凋亡率、高效孕激素+miR-21组细胞凋亡率比较差异有统计学意义(P<0.05);干预后高效孕激素+miR-21组细胞凋亡率最高(P<0.05),见表4
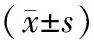
表4 各组干预前、后细胞凋亡情况的比较
3 讨论
单独应用孕激素或联合宫腔镜病灶切除是年轻早期子宫内膜癌患者最常用、最有效保留生育能力的治疗方式[1,10-12]。本次实验结果显示,子宫内膜癌Ishikawa 细胞经人工合成高效孕激素处理24 h后,其增殖率、迁移力及侵袭力降低(P<0.05),凋亡率增高(P<0.05),进一步证实人工合成高效孕激素对子宫内膜癌Ishikawa 细胞的抑制作用,为人工合成高效孕激素用于早期子宫内膜癌患者保留生育功能治疗提供了理论依据。
虽然孕激素治疗早期子宫内膜癌的效果已得到肯定,但仍有约30%的患者对孕激素治疗不敏感或无反应,这给年轻患者保留生育功能治疗带来巨大困难。针对孕激素抵抗机制的靶向治疗可能逆转孕激素抵抗,应用孕激素联合靶向治疗可能成为有生育要求的子宫内膜癌患者治疗的新手段。
微小RNA(miRNA)属于内源性非编码小分子RNA,它以互补配对的方式与靶基因的3′UTR区结合,降解靶基因mRNA或抑制靶基因mRNA的翻译,并在转录后负责调控靶基因的表达,从而影响肿瘤的增殖、凋亡、侵袭和转移[13]。有研究发现子宫内膜癌细胞中存在多种微小RNA表达异常,这预示着miRNA参与子宫内膜癌的发生、发展[7-8]。近年来的研究表明,miRNA与子宫内膜癌的发生、发展过程密切相关,参与调节子宫内膜癌发生、发展的分子机制和孕激素受体的表达[14]。miR-21在多种肿瘤中高表达[15],大量研究证实,多发性肿瘤抑制基因mRNA的3′非编码区含有miR-21特异性识别和结合位点[16]。在子宫内膜癌患者血清、癌组织中均见miR-21高表达,且其表达的程度与淋巴转移、不良预后密切相关[9],这提示miR-21可能参与了子宫内膜癌的发生、发展。秦晓燕[17]等的研究证实了上述观点。这为临床子宫内膜癌的基因治疗提供了依据。本研究显示,在人工合成高效孕激素作用下,联合使用miR-21 拮抗剂,子宫内膜癌Ishikawa细胞增殖率、迁移和侵袭能力较联合处理前降低(P<0.05),而细胞凋亡率较联合处理前升高(P<0.05)。这说明联合使用人工合成高效孕激素和miR-21拮抗剂可以抑制子宫内膜癌细增殖,促进凋亡。此外,本研究还表明,与空白组及高效孕激素相比,高效孕激素+miR-21组的Ishikawa 细胞增殖率、迁移力及侵袭力最低,而凋亡率最高,组间比较差异具有统计学意义(P<0.05)。这说明在使用人工合成高效孕激素的作用下,拮抗miR-21可以增加抑制子宫内膜癌Ishikawa细胞增殖及促进其凋亡的作用,提示人工合成高效孕激素与miR-21拮抗剂可能存在协同抗癌效应。

