黄精皂苷对脂多糖诱导RAW264.7细胞炎症模型的抗炎作用及其机制
李思媛, 崔玉顺, 李新星, 何 佳, 唐红珍, 杨世林, 高红伟*
(1.广西中医药大学药学院,广西 南宁 530200;2.广西优势中成药与民族药开发工程技术中心,广西 南宁 530020)
炎症是对入侵病原体,受损细胞和刺激物的自我保护反应[1],实质上也是指机体与致炎因子进行斗争的反应,在整个炎症过程中这种斗争反映会一直存在于机体各部分组织和器官,常见的有扁桃体炎、肺炎、肝炎、肾炎等,过度的炎症反应对人体产生损伤,严重的会导致中风、风湿性关节炎、神经退行性疾病、心血管疾病等[2]。炎症根据其性质可分为急性和慢性,当机体受到外来刺激时首先会产生急性炎症,伴随着等离子和粒细胞从血液运输到了受损组织,然后血管和免疫系统对受损组织作出免疫应答,进一步开始释放炎症介质,从而诱发急性炎症进入慢性期[1]。因此,关于炎症作用机制的研究对其引起相关疾病的治疗具有重要的指导意义。
黄精化学成分包括皂苷、多糖、黄酮、生物碱等,目前对多糖的研究最广泛[3],但鲜有涉及皂苷。以往研究显示,其他植物皂苷都具有抗炎、抗肿瘤、抗真菌等作用[4-5],其中从黄精中分离出的甾体皂苷可抑制脂多糖诱导的RAW264.7细胞分泌NO、TNF-α,具有一定的抗炎作用,但该成分对炎症反应作用的确切药理机制尚未见报道。因此,本实验以RAW264.7细胞为对象,研究黄精皂苷通过NF-κB/MAPKs信号通路发挥体外抗炎作用及其机制。
1 材料
1.1 药材 黄精购于广西临山殿中草药种植有限公司,经苏州大学李笑然教授鉴定为正品。取粗粉100 g,1 L甲醇浸提18 h后于30~40 ℃下超声1 h,滤过,滤液浓缩至无醇味,加入适量纯水混悬,乙酸乙酯萃取,浓缩萃取液,除去溶剂,即得黄精提取物,黄精皂苷质量分数为84%。
1.2 细胞与试剂 小鼠腹腔巨噬细胞RAW264.7购于中国科学院上海细胞库。DMEM培养基(2327860)、胎牛血清(2176404)、PBS(2200918)购自美国Gibco公司;BCA蛋白定量试剂盒(TE266615)购自美国Thermo公司;GAPDH(8884S)、NF-κB/p65(8242S)、iNOS(2977S)、COX-2(4842S)、IKKα(2682S)、IKKβ(8943S)、IκBα(4814S)、p-IKKα/β(2697S)、p-IκBα(2859S)、P-NF-κB/p65(3033S)、p38(9212S)、ERK(4370S)、JNK(9252S)、p-p38(4511S)、p-ERK(4370S)、p-JNK(4668S)抗体购自美国Cell Signaling Technology公司;JC-1线粒体膜电位检测试剂盒(100918190307)购自北京索莱宝科技有限公司;小鼠TNF-α(M200115-102a)、IL-6(M210125-004a)ELISA试剂盒购自欣博盛生物科技有限公司;ROS试剂盒(1630212)购自美国Sigma-Aldrich公司。
2 方法
2.1 细胞培养及贮存液配制 RAW264.7细胞加入含10%胎牛血清的DMEM培养基,于37 ℃、5% CO2恒温培养箱中培养,每1 d传代1次。黄精皂苷浸膏溶于DMSO配制成20 mg/mL贮存液,避光-20 ℃保存,实验时用含1%胎牛血清的DMEM培养基稀释成相应浓度(DMSO终体积分数不超过0.1%)。
2.2 MTT比色法检测细胞活性 将RAW264.7细胞按照每孔5×104个的密度接种于96孔板中过夜培养,待细胞贴壁后,弃去孔内培养基,加入用1%培养基配制好的不同质量浓度黄精皂苷(20、40、80、100 μg/mL)药液,培养细胞24 h,加入MTT工作液,避光于37 ℃、5% CO2培养箱中孵育4 h,每孔加入DMSO 100 μL,室温避光,于摇床上摇晃溶解结晶,多功能微孔板检测仪在570 nm波长处测定光密度(OD)值。细胞存活率=(OD给药组/OD空白组)×100%
2.3 LPS诱导的RAW264.7细胞炎症因子检测 RAW264.7细胞以每孔5×104个的密度接种于96孔板中过夜培养,将细胞分为空白组、模型组、给药组,给药组用不同质量浓度黄精皂苷预处理细胞1 h,LPS诱导炎症模型。
2.3.1 上清培养液NO水平 模型组和给药组给予LPS(终质量浓度为1 μg/mL)刺激18 h。各组吸取50 μL上清培养液至96孔细胞培养板中,加入50 μL Griess试剂,轻轻摇晃使其充分混匀,在37 ℃下放置反应30 min后,多功能微孔板检测仪在540 nm波长处测定光密度。
2.3.2 上清培养液TNF-α、IL-6水平 模型组和给药组给予LPS(终质量浓度为1 μg/mL)刺激18 h,取上清培养液,按照ELISA试剂盒说明书操作,检测黄精皂苷对TNF-α、IL-6释放的影响。
2.4 JC-1荧光染色法检测胞内线粒体膜电位(MMP)水平 LPS(终质量浓度为1 μg/mL)诱导8 h,弃去孔中液体,加入含JC-1染色液的培养基,置于培养箱中培养1 h,孵育完成后加入100 μL冰PBS洗涤细胞,弃去液体后每孔加入100 μL PBS,在荧光显微镜下观察拍照。
2.5 活性氧(ROS)释放检测
2.5.1 流式细胞仪 将RAW264.7细胞以每孔1.5×105个的密度接种于24孔板过夜培养,将细胞分为空白组、模型组、给药组,给药组用黄精皂苷(20、40、80 μg/mL)预处理1 h后,LPS(终质量浓度为1 μg/mL)诱导8 h,将ROS探针DCFH2-DA(10 μg/mL)加入96孔板中,在37 ℃下避光孵育30 min,冰PBS清洗细胞1次,加入冰胰酶进行消化后加入300 μL冰PBS将细胞冲洗下来,收集到流式管中,上机检测。
水稻纹枯病俗称“烂脚病”“花脚杆”,苗期至穗期都可发病。湿度低时叶鞘中部组织破坏呈半透明状,边缘暗褐,发病严重时病斑融合形成大病斑,呈不规则状云纹斑,致叶片发黄枯死。叶片上的病斑呈云纹状,边缘褪黄,发病快时病斑呈污绿色,叶片很快腐烂。茎秆受害症状似叶片,后期呈黄褐色,易折。穗颈部受害常不能抽穗,抽穗的秕谷较多,千粒重下降。高温条件下病斑上产生一层白色粉霉层,即病菌的担子和担孢子[3]。
2.5.2 ROS试剂盒 RAW264.7细胞以每孔5×104个的密度接种于96孔板中过夜培养,将细胞分为空白组、模型组、给药组,给药组用黄精皂苷(20、40、80 μg/mL)预处理细胞1 h,LPS(终质量浓度为1 μg/mL)诱导8 h,诱导完成后弃去上清液,按照ROS检测试剂盒操作步骤进行ROS检测。
2.6 Western Blot法检测炎症相关蛋白表达 RAW264.7细胞以每孔6×105个的密度接种于6孔板过夜培养,将细胞分为空白组、模型组、给药组,给药组用黄精皂苷(20、40、80 μg/mL)预处理1 h后,LPS(终质量浓度为1 μg/mL)分别诱导8、24 h,从培养箱中取出细胞置于冰上,弃掉培养基,预冷的PBS缓冲液洗涤2次,加入适量蛋白裂解液,裂解10 min后细胞刮将其刮下来收集于1.5 mL EP管,4 ℃、15 000 r/min离心15 min,取上清,BCA试剂盒检测蛋白浓度,酶标仪于562 nm波长处检测其光密度,蛋白样品中加入5×SDS-PAGE Loading buffer,于97 ℃金属浴中煮沸7 min使蛋白变性,10%SDS-PAGE凝胶电泳并转于PVDF膜上,脱脂奶粉封闭2 h后,分别使用iNOS、COX-2、IKKα、IKKβ、p-IKKα/β、IκBα、p-IκBα,NF-κB/p65、p-p65、ERK、p-ERK、JNK、p-JNK、p38、p-p38、GAPDH的抗体(1∶1 000)于4 ℃孵育过夜,TBST洗涤3次,二抗在室温下孵育2 h,TBST洗涤3次,化学发光法显影。

3 结果
3.1 黄精皂苷对RAW264.7细胞活性的影响 RAW264.7细胞用黄精皂苷药液处理24 h后,存活率没有受到抑制,说明黄精皂苷(20、40、80 μg/mL)对RAW264.7细胞不具有毒性,见图1。

注:与空白组比较,#P<0.05。
3.2 黄精皂苷对LPS诱导的RAW264.7细胞释放NO的影响 由图2可知,与空白组比较,模型组NO水平增加(P<0.01);与模型组比较,黄精皂苷3个剂量组NO水平减少(P<0.01),表明黄精皂苷对LPS诱导的RAW264.7细胞释放NO具有抑制作用。
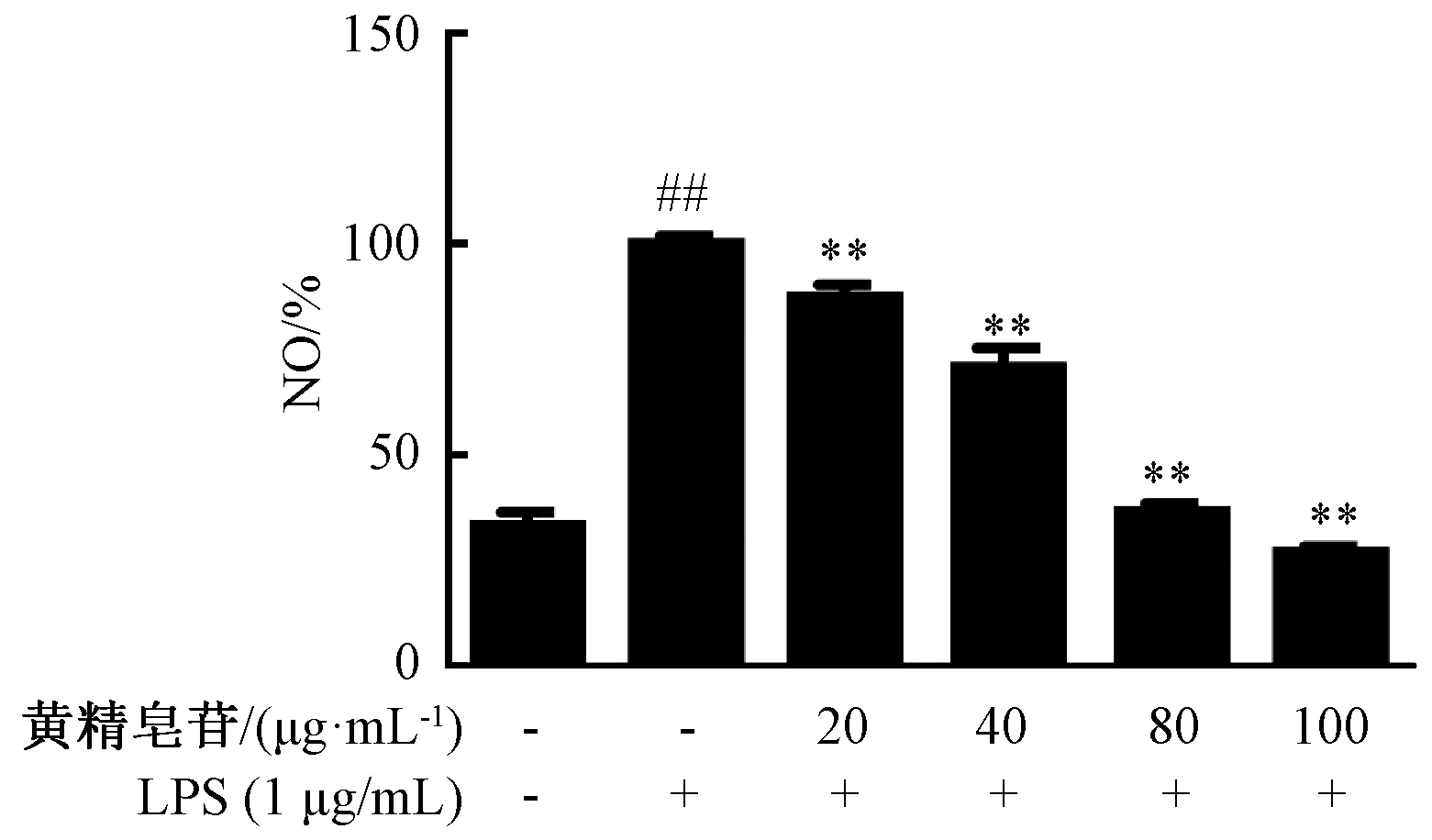
注:与空白组比较,##P<0.01;与LPS组比较,**P<0.01。
3.3 黄精皂苷对LPS诱导的RAW264.7细胞中IL-6、TNF-α释放的影响 图3表明,与空白组比较,模型组IL-6、TNF-α释放增多(P<0.01);与模型组比较,黄精皂苷40、80 μg/mL组IL-6释放减少(P<0.05、P<0.01),80 μg/mL组TNF-α释放减少(P<0.05),说明黄精皂苷对LPS诱导的RAW264.7细胞中IL-6、TNF-α释放具有抑制作用。

注:与空白组比较,#P<0.05,##P<0.01;与LPS组比较,*P<0.05,**P<0.01。
3.4 黄精皂苷对细胞线粒体膜电位(MMP)的影响 如图4所示,与空白组比较,模型组中LPS破坏了线粒体膜电位的稳定性,JC-1单体(绿色荧光)增加;黄精皂苷预处理后,JC-1单体降低,聚合体(红色荧光)增加,表明黄精皂苷可维持线粒体膜电位的稳定。
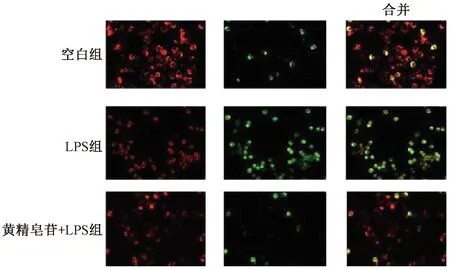
图4 MMP显微荧光图(×10)
3.5 黄精皂苷对LPS诱导的ROS产生的影响 如图5所示,模型组ROS生成增加(P<0.01);与模型组比较,黄精皂苷80 μg/mL组ROS产生减少(P<0.05)。ROS试剂盒检测结果显示,与空白组比较,模型组ROS生成增加(P<0.05);与模型组比较,黄精皂苷3个剂量组ROS产生有所减少(P<0.05),表明黄精皂苷对LPS诱导RAW264.7细胞产生的ROS具有抑制作用。

注:A为ROS流式细胞仪检测结果,B为 ROS试剂盒检测结果。与空白组比较,##P<0.01;与LPS组比较,*P<0.05,**P<0.01。
3.6 黄精皂苷对LPS诱导的RAW264.7细胞中iNOS、COX-2表达的影响 如图6所示,与空白组比较,模型组iNOS、COX-2的表达增加(P<0.01);与模型组比较,给药组iNOS、COX-2表达减少(P<0.01),表明黄精皂苷对两者表达具有抑制作用。
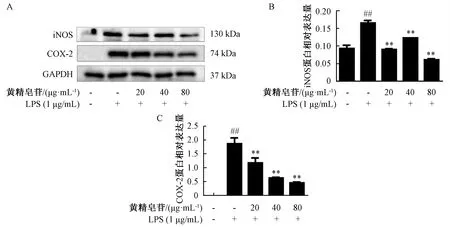
注:A为iNOS及COX-2蛋白表达图,B~C为iNOS及COX-2蛋白相对表达量统计柱状图。与空白组比较,##P<0.01;与LPS组比较,**P<0.01。
3.7 黄精皂苷对LPS诱导的RAW264.7细胞中NF-κB信号通路的影响 如图7所示,1 μg/mL LPS作用于RAW264.7细胞8 h后,NF-κB p65磷酸化蛋白(p-p65)、IKKα/β磷酸化蛋白(p-IKKα/β)、IκBα磷酸化蛋白(p-IκBα)表达提高(P<0.01);与模型组比较,不同质量浓度黄精皂苷均可以降低磷酸化蛋白的表达(P<0.01),说明黄精皂苷能在一定程度上降低RAW264.7细胞炎症模型中NF-κB信号通路磷酸化蛋白的表达,而且在不同剂量下对IκBα总蛋白的降解具有抑制作用。
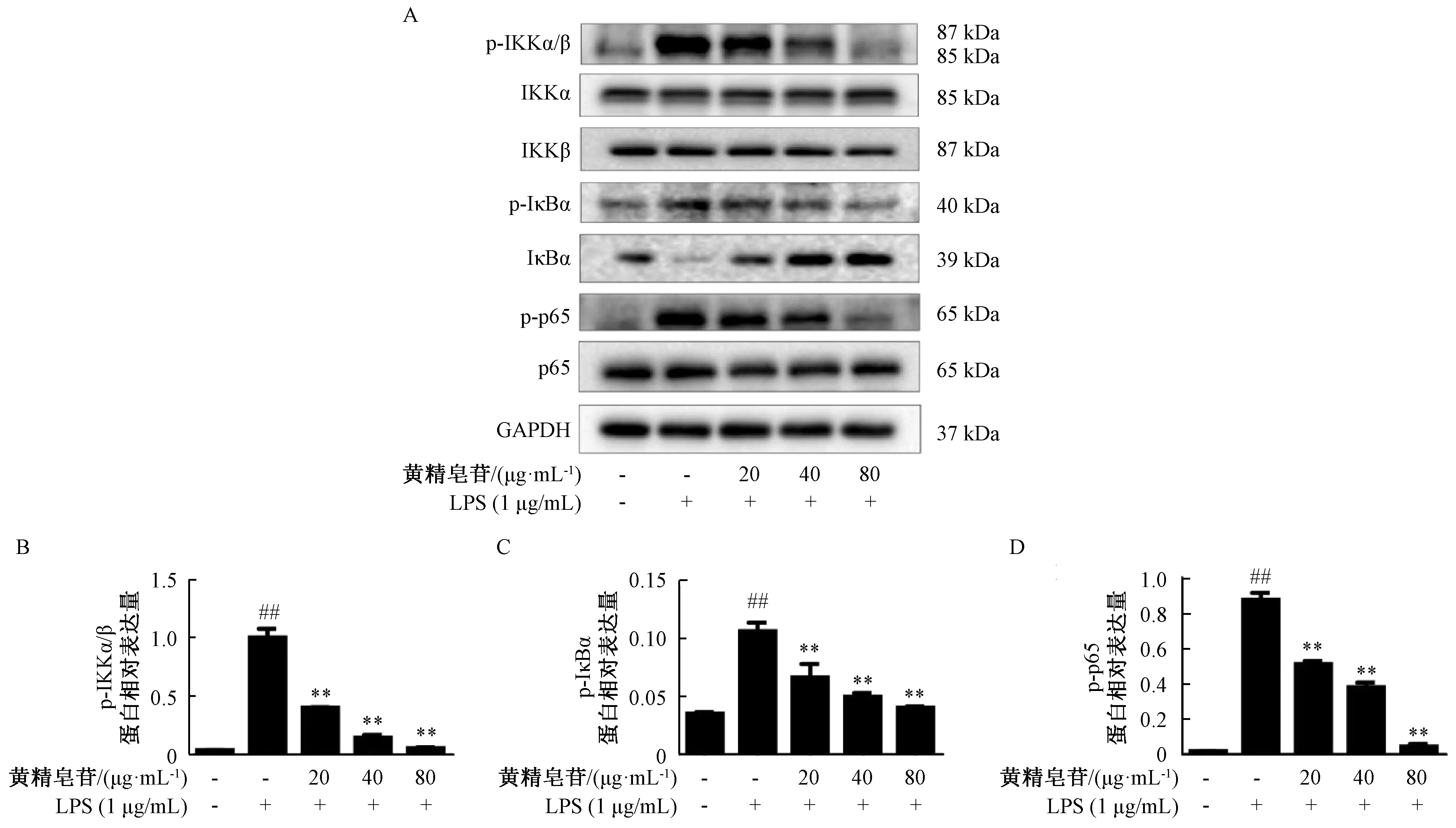
注: A为NF-κB信号通路蛋白表达图,B~D为p-IKKα/β、p-IκBα、p-p65蛋白相对表达量统计柱状图。与空白组比较,##P<0.01;与LPS组比较,**P<0.01。
3.8 黄精皂苷对LPS诱导的RAW264.7细胞中MAPK信号通路的影响 如图8所示,1 μg/mL LPS作用于RAW264.7细胞8 h后,ERK磷酸化蛋白(p-ERK)、JNK磷酸化蛋白(p-JNK)、p38磷酸化蛋白(p-p38)的表达提高(P<0.01);与模型组比较,不同质量浓度的黄精皂苷均可以降低磷酸化蛋白的表达(P<0.01),说明黄精皂苷能在一定程度上降低RAW264.7炎症细胞模型中MAPK信号通路磷酸化蛋白的表达,从而发挥抗炎作用。
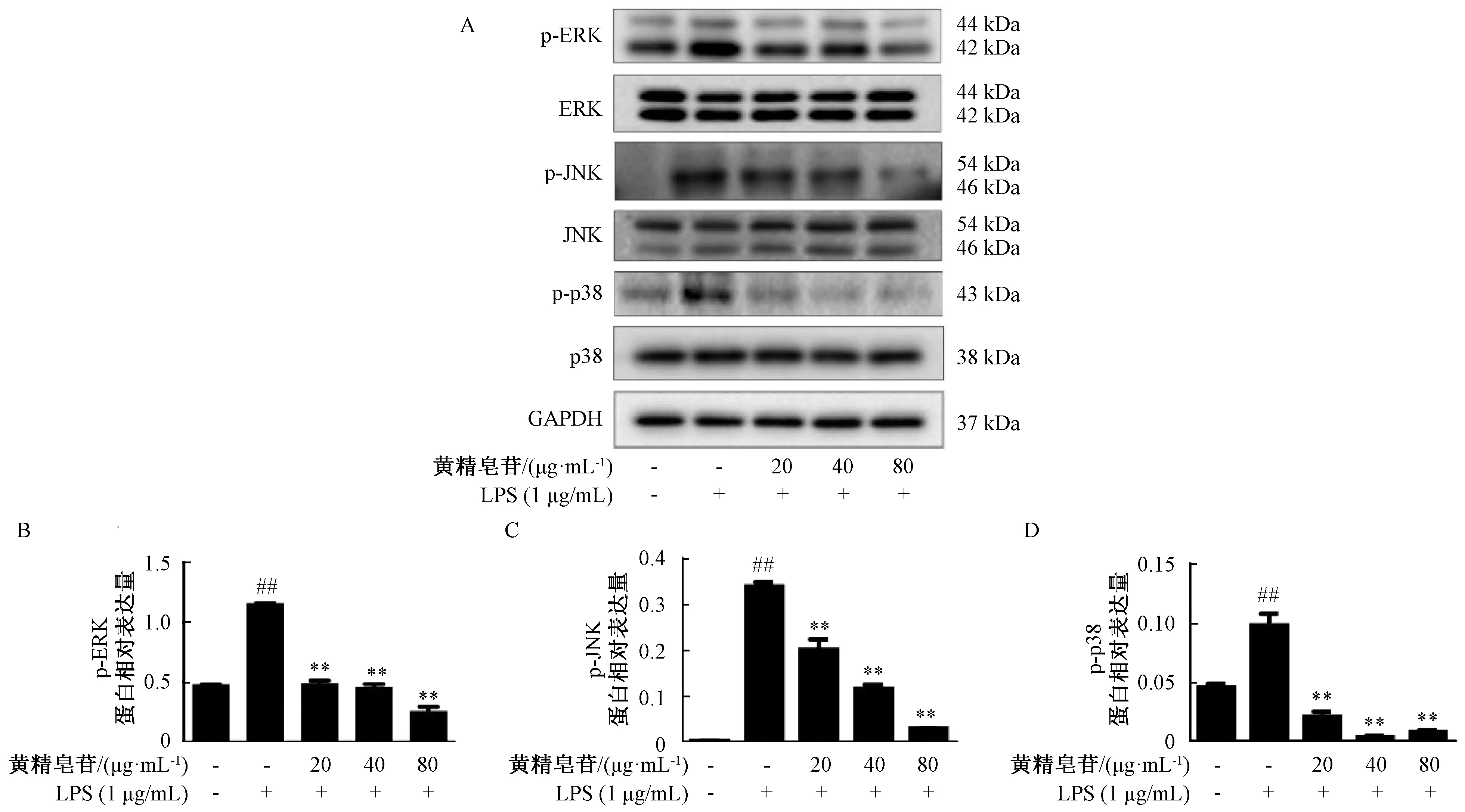
注:A为MAPK信号通路蛋白表达图,B~D为p-ERK、p-JNK、p-p38蛋白相对表达量统计柱状图。与空白组比较,##P<0.01;与LPS组比较,**P<0.01。
4 讨论
小鼠腹腔巨噬细胞RAW264.7是其机体抗炎免疫以及防御的主要成员[6],在炎症过程中会分泌炎症相关细胞因子,参与炎症反应[7],常用于细胞生物学研究。脂多糖(LPS)是革兰氏阴性细菌外膜主要成分之一,多用于建立炎症模型[8-10]。LPS可以促使很多细胞模型大量释放炎症介质及因子如NO,PGE2,IL-6,IL-1β和TNF-α等[10],特别是对于巨噬细胞模型。一氧化氮是一种与多种免疫病理变化相关的反应性自由基。经LPS刺激,RAW264.7细胞中的iNOS过度表达,导致一氧化氮大量产生,从而触发多重炎症病理反应。COX-2是COX同工酶中的一种,是介导炎症的关键酶[1]。过度分泌的细胞因子IL-6和TNF-α是重要的炎症介质[11-12]。黄精皂苷抑制LPS诱导的iNOS、COX-2表达,以及亚硝酸盐,IL-6的产生,其高浓度对TNF-α的释放具有抑制作用。LPS刺激巨噬细胞之后,其产生的活性氧(ROS)显著增高,线粒体的膜电位也明显降低[13]。过多的ROS产生可能会通过降低线粒体膜电位从而损伤线粒体,而黄精皂苷对ROS生成有抑制作用,对MMP的降低有抑制作用,结果表明其对线粒体具有一定的保护作用。
NF-κB是该家族的核转录因子,参与细胞对细胞因子等各种外界刺激的响应,在细胞的炎症及免疫应答等过程中起到关键性作用[1,14-17]。NF-κB通过IKK刺激IκB从而被激活。激活的p65从细胞质中转移到细胞核,与靶基因的启动子区域结合[18],导致一连串促炎性靶因子转录,其中包括IL-6,TNF-α,iNOS等。黄精皂苷对LPS诱导的磷酸化的IKKα/β、IκBα和p65蛋白表达有抑制作用,这表明NF-κB通路可能是它的抗炎作用机制之一。MAPKs通路调控从增殖分化到细胞凋亡等多种过程[19-20],也积极参与免疫防御和炎症反应,该通路主要有ERK、p38和JNK三条途径[21],特别是p38途径,是炎性介质合成的主要途径之一,因此被认为是抗炎药物的重要靶点。在LPS刺激的蛋白中,黄精皂苷对磷酸化的p38MAPK和JNK、ERK蛋白表达也具有抑制作用,这表明它们也可能参与了黄精皂苷的抗炎作用。
综上所述,黄精皂苷可以抑制LPS刺激的RAW264.7细胞产生的炎症,其作用机制可能与抑制NF-κB、MAPKs信号通路有关,更深入的机制及作用有效成分的确认,还有待进一步研究发现。