敲除SOCS1a基因对斑马鱼肝脏氧化应激的影响
戴梓茹,孔 艳,王 培,娄气永,李东亮
(1.广西北部湾海洋生物多样性养护重点实验室,钦州 535011;2.广西大学 轻工与食品工程学院,南宁 530004;3.中国科学院大学 水生生物研究所 水生生物多样性与保护重点实验室,武汉 430072;4.华东师范大学 生命科学学院 水生动物营养与环境健康实验室,上海 200241)
SOCS家族蛋白(suppressors of cytokine signaling)是一类在细胞内分泌的蛋白,并可以作为负向调节因子反馈性抑制细胞因子信号转导引起的细胞信号转导过程。目前在哺乳动物中发现SOCS 家族蛋白有细胞因子诱导的含有SH2 结构域的蛋白(cytokine inducible SH2-containing protein,CIS)以及SOCS1~SOCS7共8种[1]。其中能够抑制细胞信号转导的蛋白被命名为SOCS1[2],是一个由外显子编码的基因,并能够参与多种细胞信号通路的调节,如:SOCS1能够负反馈调节JAK/STAT(janus kinase/signal transduction and activators of transcription;络氨酸激酶/信号转导子和转录激活子)应激反应信号通路[3]。此外,SOCS1还具有调节机体免疫系统[4]、调节机体造血功能[5]、调节机体生长和机体代谢等生物学功能[6]。
氧化应激(oxidative stress,OS)是机体内氧化与抗氧化系统的平衡被打破而倾向于氧化,从而促进细胞内活性氧分子(ROS)大量积累而引起机体产生的一种氧化损伤,它会对人体产生负面的影响,是导致衰老的一个重要因素。目前,已有大量报道证实了SOCS1基因的生物功能,SOCS1基因对氧化应激的影响也有报道,选择性诱导SOCS蛋白可阻止宿主巨噬细胞氧化应激介导的凋亡[7],SOCS-1 蛋白表达升高,能够减轻LPS引起的小鼠成骨细胞氧化应激水平[8]。为进一步探讨SOCS1基因与氧化应激的关系,本文分析斑马鱼SOCS1基因敲除系在高脂诱导的条件下,肝脏抗氧化酶含量变化,并通过转录组数据分析肝脏氧化应激基因表达和信号通路变化情况,为SOCS1基因功能的研究提供依据。
1 材料和方法
1.1 材料和仪器
总超氧化物歧化酶(T-SOD)测试盒(A001-1-2)、过氧化氢酶(CAT)测定试剂盒 (A007-1-1)、谷胱甘肽还原酶(GR)测定试剂盒(A062-1-1)均购自南京建成生物工程研究所;其余化学试剂均为国产分析纯试剂。Evolution 300紫外-可见分光光度计;MIKRO 200R 型离心机;Hitach-7650 透射电镜。
1.2 斑马鱼喂养方法
SOCS1a基因敲除系(SOCS1a-/-)和野生型(SOCS1a+/+)斑马鱼均由中国科学院水生生物研究所分子病理课题组提供。成年斑马鱼的养殖条件为水温28 ℃,pH值为7.2~7.6,电导率为500~550 μs/cm,日光灯照射和黑暗各12 h。常规喂养90 d后,分为4组,分别是SOCS1a-/-高脂饲料组(MH)和普通饲料组(MC)、SOCS1a+/+高脂饲料组(CH)和普通饲料组(CC),每组15条鱼。斑马鱼饲料配方见表1。每天分别投喂饲料用量为鱼体重的6%,分为2次喂养(早上9:00和下午5:00),每隔2周测1次体重和体长并重新计算饲料用量,投喂6周。

表1 斑马鱼饲料实验配方Table 1 Experimental formula of zebrafish feed
1.3 电镜实验(TEM)
采用透射电镜观察斑马鱼肝组织线粒体,参考Iregui等[9]的方法并稍加修改。将斑马鱼活体用冰块麻醉后,用生理盐水漂洗后放入2.5% 戊二醛磷酸缓冲液中固定24 h后,再用1% 锇酸固定1 h,然后梯度酒精脱水,丙酮置换,包埋在Epon 812树脂中后进行定位、切片(超薄),最后用醋酸铀及柠檬酸铅双重染色,并在透射电镜下观察、拍照并记录。
1.4 抗氧化酶活性测定
取各试验组斑马鱼肝脏,加入无菌的生理盐水(1∶9,W/V),在冰水浴条件下,制备成10% 的组织匀浆,2 500 r/min离心10 min,取上清液,用于蛋白含量及各抗氧化酶活力测定。蛋白含量的测定采用考马斯亮蓝法[10]。SOD、CAT和GR的测定均严格参照相应试剂盒说明书进行。
1.5 转录组分析
剖解采集实验斑马鱼的肝脏样品,迅速放入液氮,置于-80℃保存。由北京诺禾致源公司负责cDNA文库构建、Illumina高通量平台测序和比对工作。根据提供的数据和比对结果,对转录组数据进行分析,以差异倍数的对数绝对值(︱log2FoldChange︱≥1)为阈值,筛选差异表达基因(DEGs)后,分析氧化应激相关的DEGs,并对DEGs 进行GO 富集分析,用超几何分布检验方法计算每个GO 条目富集的显著性,P≤0.05 时,表明DEGs 显著富集。
1.6 数据处理
2 结果与分析
2.1 敲除SOCS1a导致肝细胞线粒体功能异常
取90 dpf的SOCS1a突变系斑马鱼和野生型斑马鱼肝脏组织进行电镜(TEM)实验,TEM研究结果发现,与对照组相比,SOCS1a突变系肝脏线粒体出现数量减少、异常的膨胀等现象,且线粒体脊密度明显减少(图1),此外,还观察到突变系肝细胞中有明显的脂滴积累[11]。

(a)和(b)野生型斑马鱼肝脏线粒体形态[(a)3 000×;(b)25 000×,图中箭头表示脂滴]。(c)和(d)SOCS1a突变系异常肝脏线粒体形态[(c)3 000×,bars=2 μm;(d)25 000×,bar=150 nm]。高倍图像(b)和(d)分别对应于(a)和(c)中红色方框部分。图1 敲除SOCS1a导致肝细胞线粒体功能异常Figure 1 Abnormal mitochondrial pattern of hepatocytes in SOCS1a ablation zebrafish
2.2 敲除SOCS1a对肝脏抗氧化酶作用的影响
敲除SOCS1a对肝脏SOD、CAT和GR的影响如图2(a)所示。由图2(a)可知,普通饲料喂养时,CC处理组的SOD活力显著高于MC处理组27.813 U/mg(prot);在高脂诱导条件下,CH处理组显著高于MH处理组14.015 U/mg(prot)。由图2(b)可知,CC处理组的CAT活力显著高于MC处理组16.254 U/mg(prot),MH处理组显著高于CH处理组10.415 U/mg(prot)。由图2(c)可知,CC处理组的GR活力显著高于MC处理组3.879 U/mg(prot),CH处理组显著高于MH处理组3.865 U/mg(prot)。在普通饲料和高脂饲料喂养的条件下,SOCS1a敲除系的GR活力均低于SOCS1a+/+。

MH:SOCS1a-/-高脂饲料组;MC:SOCS1a-/-普通饲料组;CH:SOCS1a+/+高脂饲料组;CC:SOCS1a+/+普通饲料组。图2 敲除SOCS1a对肝脏抗氧化酶活力的影响Figure 2 Effects on liver antioxidant enzyme activity with knockout of SOCS1a
2.3 敲除SOCS1a对肝脏氧化应激基因表达的影响
为进一步探讨敲除SOCS1a对斑马鱼肝脏氧化应激效应引起的分子过程和信号通路的影响,对4个处理组斑马鱼肝脏mRNA进行转录组检测。以CC和CH处理组为对照,分析不同喂养条件下各处理组的氧化应激相关基因的表达情况。结果(图3)显示:MC处理组中显著上调的基因有10个,分别是ndufa4、acoxl、foxred2、selenou1b、dao.1、gpx8、ccs、aoc2、dao.3和pcyox1;其中gpx8和ccs属于抗氧化类基因,其余上调基因均为氧化类基因。MH处理组中显著上调的基因有11个,分别是dao.1、foxred2、acoxl、epx、sod3a、aoc2、pcyox1、pyroxd2、dao.3、cyp1a和foxred1(log2FC>1和log2FC<-1表示具有显著性差异),其中epx和sod3a属于抗氧化基因,其余上调基因均为氧化类基因。

图3 敲除SOCS1a对肝脏中氧化应激基因表达的影响Figure 3 Regulation effects on oxidative stress gene expression of SOCS1a in liver tissue
在MC处理组中,显著下调的基因有8个,其中,bco2b、epx和PPARG等3个基因的下调最大;在MH处理组中,显著下调的基因也有8个,其中有6个抗氧化相关基因,分别是prdx1、prdx6、prdx5、mpx、gpx8和oxr1b,另外2个下调的基因分别是ndufa4和ndufs7。
2.4 敲除SOCS1a对肝脏氧化应激信号通路的影响
分别以CC和CH处理组为对照组,结合转录组数据,分析分子功能基因本体论(Gene Ontology;GO),结果(图4)显示,SOCS1a突变系中,MC和MH处理组的氧化应激反应通路基因差异表达均显著上调(P<0.05)。其中,在高脂诱导下,MH处理组参与氧化应激的信号通路上调更为显著,如氧化还原过程通路和氧分子结合通路。
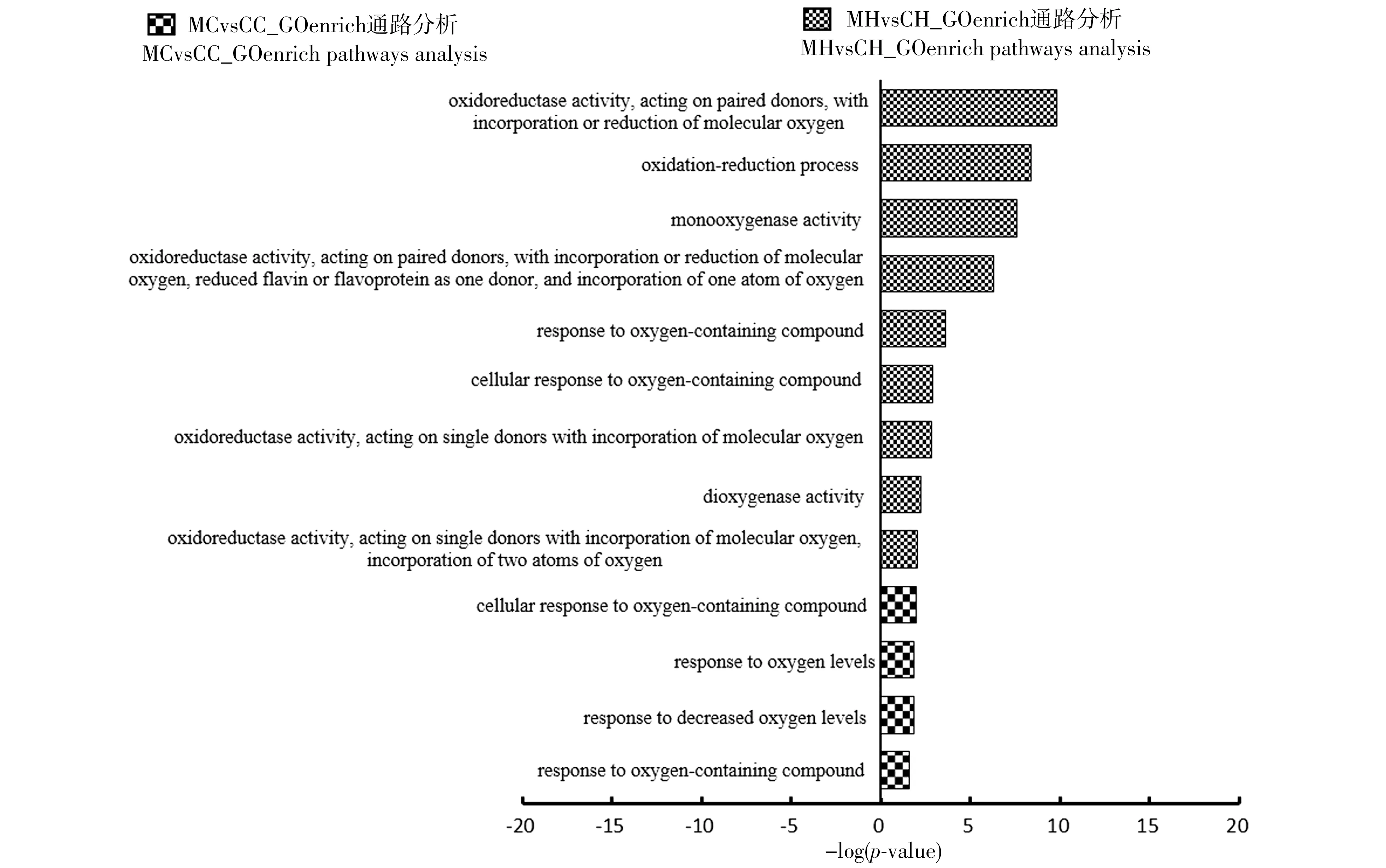
图4 敲除SOCS1a对肝脏中氧化应激信号通路的影响Figure 4 Effects on oxidative stress signaling pathways on the liver with knockout of SOCS1a
3 讨论
高脂饮食可引起细胞氧化应激损伤,氧化应激发生时,可导致脂类、蛋白质、碳水化合物和核酸的氧化损伤[12]。我们的研究从敲除SOCS1a基因的角度,证明SOCS1a对机体的重要作用。TEM实验结果表明,敲除SOCS1a导致斑马鱼肝脏线粒体出现了损伤(图1),而线粒体的氧化损伤可能进一步促进氧化应激反应[13]。
MC组斑马鱼肝脏抗氧化酶(SOD、GR)活力均比CC处理组低[图2(a)和(c)],这可能是敲除SOCS1a引起的氧化应激效应。高脂诱导条件下,大鼠产生氧化应激,肝脏SOD活力显著下降[14];在高氯氰菊酯诱导下,斑马鱼产生氧化应激,GR活力在15 dpf后也显著下降[15]。机体被持续诱导产生氧化应激时,SOD及GR活力下降,研究中SOD和GR活力的变化与上述结果具有相似的变化趋势。氧化应激产生初期,机体通过增加SOD和CAT活性以消除ROS的产生,但是,当SOD和CAT不能清除过量产生的ROS时,它们的活性降低。此外,SOD活性降低,导致超氧阴离子积累,如果不能及时清除,就会产生羟基自由基,抑制CAT活性,进一步促进氧化应激,此外,还说明体内ROS水平升高,CAT酶先被激活后逐渐降低[16]。因此,推断在高脂诱导条件下,MH处理组产生了更为强烈的氧化应激效应,机体中氧化和抗氧化平衡进一步被打破,开始倾向于氧化而使得CAT被激活,从而导致MH处理组肝脏中的CAT活力较高[图2(b)]。GR的作用是维持细胞内还原型谷胱甘肽的含量,然而调控GR 活性变化的机制目前尚不明确[17]。有研究认为,诱导GR 活性的关键因素可能是氧化态谷胱甘肽含量升高[18],这与我们的研究结果一致,即SOCS1a敲除系的MC和MH处理组均产生了氧化应激效应。
ndufa4(NADH:ubiquinone oxidoreductase subunit A4)是线粒体细胞色素C氧化酶,其作用是把呼吸底物的电子直接传递给分子态氧,并传递到氧分子上将氧气转化为水分子[19];ndufs7(NADH:ubiquinone oxidoreductase core subunit S7)是位于细胞核内的基因编码的蛋白质结合在线粒体膜上,参与构成辅酶Q 氧化还原酶复合体Ⅰ[20],两种基因均属于氧化磷酸化相关基因。在高脂诱导下,MH处理组中ndufa4和ndufs7基因显著下调,其下调可能是为了减弱氧化磷酸化,来应对高脂诱导所产生的更为激烈的氧化应激,达到提高生物对伤害的抵抗力。敲除斑马鱼SOCS1a基因后,通过上调氧化通路相关基因,导致氧化应激的发生,而在高脂诱导下,这种氧化应激效应显得更为激烈(图3)。
敲除SOCS1a后,MC处理组中氧化相关的信号通路上调,如氧水平反应、降低氧水平反应和细胞对含氧化合物的反应等信号通路。并且高脂诱导之后,氧化相关的信号通路上调幅度更大,如氧化还原反应和氧化还原酶相关的信号通路等(图4),提示这可能是氧化应激反应打破了机体的氧化平衡引起的。研究显示,SOCS1的低水平表达增强了P-JAK2、P-STAT3蛋白表达,而SOCS1的过表达能够通过抑制JAK/STAT信号通路来阻止细胞的氧化应激[18,21]。同时,我们前期研究显示,敲除SOCS1a后,JAK/STAT信号通路被过度激活[22]。因此推断,敲除SOCS1a后,由于JAK/STAT信号通路被过度激活,导致氧化应激效应产生,并且在高脂诱导条件下,这种应激效应更为显著。
研究初步阐明SOCS1a基因敲除的斑马鱼会导致脂代谢紊乱,并产生氧化应激;在高脂诱导下,敲除系斑马鱼表现为更为激烈的氧化应激反应。造成这一结果的原因,还有待进一步研究。

