利用天青石制备碳酸锶(SrCO3)的直接法及其动力学
(1.中国科学院过程工程研究所绿色过程与工程重点实验室,北京 100190;2.中国科学院大学化学工程学院,北京 100049)
1 前 言
碳酸锶(SrCO3)是一种重要的锶化合物。广泛应用于许多工业领域,例如:彩色电视机阴极射线管是用碳酸锶作为原料[1]制造的,按氧化锶含量计算高达5%~7%。如今,碳酸锶仍是一个重要的原材料,可用于制备具有宽磁滞回线的永磁铁氧体和高剩磁功能性材料等,这些材料被广泛应用于汽车和家电等行业[2], 随着我国城市化的进程不断加快,对高档工业产品的需求将持续增长,从而可以看到对碳酸锶的需求量会稳步增加。我国碳酸锶年产量为17万t,并且以每年5%的速度增长[3]。碳酸锶也是制备其它锶化合物的基础原料,例如硝酸锶、氯化锶和氢氧化锶等。
工业上制备碳酸锶以天青石矿(SrSO4)为原料,主要工艺有:黑灰工艺(black ash)和纯碱工艺(soda ash)[4-7]。
黑灰方法包括以下步骤:
1)将细天青石矿与碳在约1000 ℃下还原反应生成硫化锶和二氧化碳(eq 1);
2)所得硫化锶加入热水浸取,过滤后分离出固体杂质;
3)所得滤液为硫化锶溶液,加入碳酸钠(2)或通入二氧化碳(3)沉淀碳酸锶,离心分离干燥得到碳酸锶产品[5, 8-10]。
图1为黑灰工艺流程图,具体三个工段包含的基本化学反应如下:
2C+SrSO4=SrS+2CO2
(1)
SrS+Na2CO3=SrCO3(s)+Na2S
(2)
SrS+CO2+H2O=SrCO3(s)+H2S
(3)
第二种生产碳酸锶的工艺方法是纯碱法。该方法使用较高品位的天青石粉末与纯碱溶液发生复分解反应,得到碳酸锶结晶,分离过滤干燥后得到碳酸锶产品。纯碱工艺中包含的化学反应如下:
SrSO4(s)+Na2CO3(aq)=SrCO3(s)+Na2SO4(aq)
(4)
黑灰法是目前最广泛使用的制备碳酸锶的工艺,但是存在以下缺点:煅烧工段生成的碳酸锶,会在浸取工段流失;高温煅烧能耗高,并且产生对环境造成危害的污染物,例如硫化钠、硫化氢等[6, 11]。纯碱法不产生有害气体,但是有两个主要缺点:为了得到合格碳酸锶产品,需要使用较高品位的天青石矿;回收反应产生的硫酸钠通常使用蒸发结晶方法,能耗较高[12-14]。为提高纯碱工艺水平,Iwai和Toguri[11]以及Castillejos[13]等人从热力学和动力
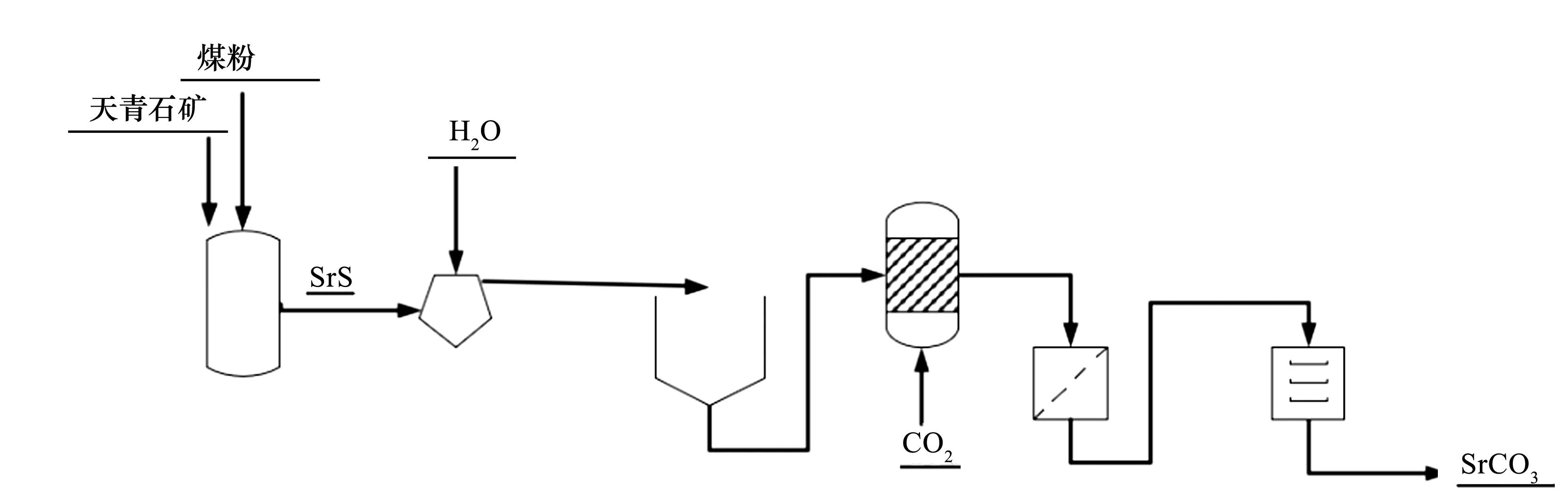
图1 黑灰工艺制备碳酸锶的流程图
学角度研究了SrSO4在Na2CO3溶液中的转化过程。此外,一些学者使用碳酸铵代替碳酸钠作为反应介质制备碳酸锶。De Buda[15]采用两级纯化工艺:首先使用HCl溶液洗涤天青石矿粉,去除其中的镁钙铁等杂质;然后使用(NH4)2CO3溶液浸取矿粉生成SrCO3。
为了提高现行工艺产品质量,节约能源,本文提出了一个新的工艺方法:使用碳酸铵作为反应介质,与天青石矿反应制备高纯碳酸锶。工艺方法如图2所示。在反应器中加入天青石矿粉和过量碳酸铵溶液,发生如式(5)所示的复分解反应。待反应完成后过滤洗涤干燥得到碳酸锶产品。滤液中含有较高浓度的硫酸铵,通过冷却结晶回收,剩余含有少量碳酸铵的滤液循环利用。本工艺所得碳酸锶中所包含的少量碳酸铵,可通过干燥去除,从而得到较高纯度产品。此外,冷却结晶回收硫酸铵能耗显著低于传统蒸发结晶技术。
SrSO4(s)+(NH4)2CO3(aq)=SrCO3(s)+(NH4)2SO4(aq)
(5)
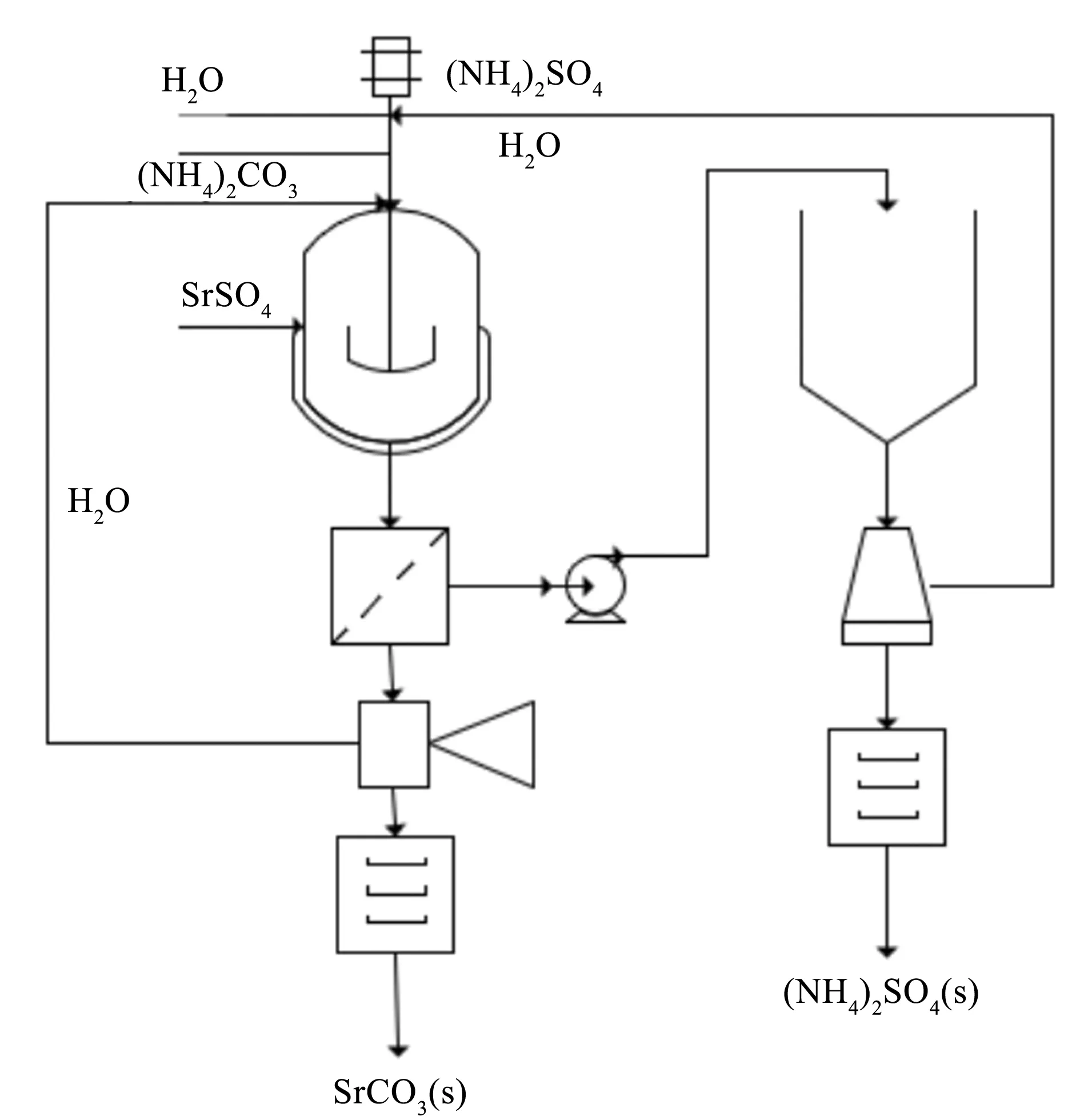
图2 直接制备碳酸锶的新工艺流程图
根据该流程包含的复分解反应,我们对碳酸铵沉淀硫酸锶的动力学进行了研究,考察了反应温度、反应物浓度等因素对硫酸锶转化率及反应速率的影响。通过实验测定反应转化率,建立了反应动力学模型,发现了反应过程中的速率控制步骤,并且回归得到了反应活化能。
2 实 验
2.1 材料与试剂
本研究实验所用主要试剂如表1所示,包括分析纯级的碳酸铵[(NH4)2CO3],硫酸锶(SrSO4)和天青石矿粉(-200目)。其中天青石矿粉使用盐酸洗涤去除了部分杂质,去离子水实验室自行制作,所用化学试剂无需进一步纯化即可使用。

表1 实验中使用的化学试剂
2.2 天青石矿成分分析
使用X射线荧光(XRF)分析了天青石矿粉成分组成,各主要元素质量分数见表2。经过换算可得到硫酸锶质量分数约为60%。

表2 矿粉中元素质量分数
2.2 实验设备与分析仪器
本研究实验所使用的仪器设备包括:玻璃结晶反应釜(自行加工),磁力搅拌器(84-1A),由天津市华兴科学仪器厂提供;智能节能恒温槽(DC-3006),来自宁波新芝生物科技股份有限公司;电热恒温鼓风干燥箱(DHG-9053A),来自上海精宏实验设备有限公司;蠕动泵(BT100-1J),由保定兰格恒流泵有限公司提供;分析天平等。使用X射线衍射(XRD)表征物相,扫描电子显微镜(SEM)表征物质形貌,粒径分布仪测量粒径分布,X射线荧光光谱仪(XRF)测定矿物成分。
2.3 实验方法
碳酸锶沉淀反应在一个带有搅拌的反应器中进行,搅拌速度500 r/min,反应器温度由恒温水浴控制。先后加入碳酸铵溶液和-200目天青石矿粉,反应一定时间后对沉淀采样,过滤洗涤干燥后得到固体产物。使用XRD分析产物成分,使用SEM表征表面形貌。
2.3.1 硫酸根的分析方法
上述反应溶液,经过滤稀释后,使用国标(GBT13025.8)容量法测定硫酸根离子浓度。基本原理是用过量钡离子完全沉淀溶液中的硫酸根离子,然后用 EDTA 滴定剩余的钡离子,从而计算出溶液中硫酸根离子的浓度。具体操作为吸取一定体积的待测滤液,加一滴盐酸,加入5.00 mL氯化钡标准溶液,于搅拌器上搅拌片刻,放置 5 min 后,加入 5 mL Mg-EDTA 溶液,10 mL无水乙醇,5 mL氨-氯化铵缓冲溶液,4滴络黑T 指示剂,之后用 EDTA 标准滴溶液从粉红色滴定到亮蓝色为止。记录消耗的 EDTA 溶液体积,计算溶液中硫酸根浓度和反应转化率。
3 结果与讨论
3.1 碳酸铵浓度对反应的影响
首先考察了碳酸铵浓度对硫酸锶转化率的影响,反应条件如下:温度T=13.15 K,硫酸锶浓度0.5 mol/L,碳酸铵浓度0.5~1.5 mol/L。在反应器中加入100 mL 碳酸铵溶液,达到设定温度后一次性加入9.19 g 硫酸锶。反应进行一段时间后采集固体样品,经过滤洗涤烘干后进行XRD分析,XRD谱图见图3。结果显示,3种碳酸铵浓度下,硫酸锶均能完全转化为碳酸锶。当碳酸铵浓度由0.5 mol/L提高至1.5 mol/L 时,硫酸锶完全转化所需时间由5 h缩短至 2 h。图4所示SEM 照片表明,反应生成的碳酸锶颗粒直径为10 μm数量级。
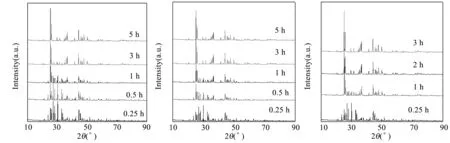
图3 反应时间对转化率的影响(碳酸铵浓度从左到右分别为 0.5 mol/L、1.0 mol/L、1.5 mol/L)

图4 反应时间为15 min、30 min、1 h、3 h、5 h时所得固体样品SEM图片(碳酸铵浓度为0.5 mol/L)

图5 反应温度为293 K、303 K和313 K下固体样品SEM图
3.2 硫酸锶浸取动力学研究
实验测定了不同温度下使用碳酸铵浸取天青石矿的反应速率。碳酸铵浓度0.5 mol/L,硫酸锶浓度 0.46 mol/L,反应温度分别为293.15 K、303.15 K和 313.15 K。图6显示了反应转化率α与反应时间t的关系,可以看出提高温度能够显著提高反应速率。基于Castillejos 和 Cruz[13]对于硫酸锶在碳酸钠溶液中的反应动力学建模,本文采用缩核模型描述硫酸锶与碳酸铵的反应过程:
ln(1-α)-3[1-(1-α)-1.3]=kt
(6)
其中α为反应转化率,k为反应速率常数,t为反应时间。图7表明该模型与实验数据吻合良好,说明透过硫酸锶颗粒表面产物层的离子扩散速率为本反应的速率控制步骤。基于实验数据回归可以计算得到本反应的表观反应活化能,Ea=89.1 kJ/mol。虽然该活化能高于文献记载的碳酸钠与硫酸锶反应活化能(41.9 kJ/mol)[16],但是仍然处于较低水平,说明碳酸铵与硫酸锶的复分解反应较容易进行。
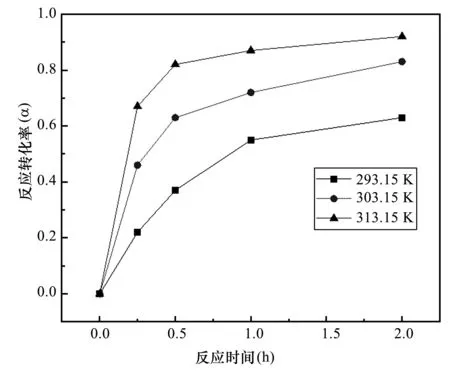
图6 不同反应温度下硫酸锶转化率随时间的变化
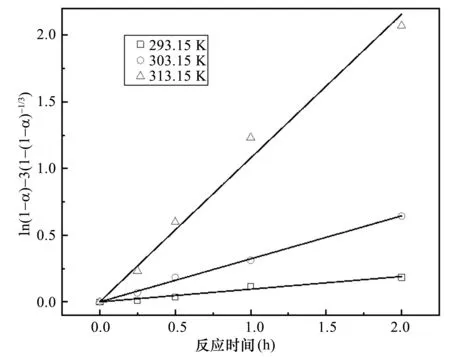
图7 不同反应温度下ln(1-α)-3[1-(1-α)-1/3]与反应时间t的关系
4 结 论
本研究提出了在高浓度硫酸铵溶液中,使用碳酸铵浸取天青石矿制备碳酸锶的新工艺,并对浸取反应动力学进行了研究。考察了碳酸铵浓度对反应速率的影响,在T=303.15 K温度下,当碳酸铵浓度从0.5 mol/L上升至1.5 mol/L 时,硫酸锶完全转化时间由 5 h减少至 2 h。通过滴定硫酸根离子浓度,测定了不同温度下硫酸锶转化率与反应时间的关系,并使用实验数据拟合了缩核模型。动力学实验结果表明碳酸铵与硫酸锶反应的速率控制步骤为透过产物层的离子扩散速率,表观反应活化能Ea=89.1 kJ/mol。

