miRNA⁃199a⁃5p在热损伤人皮肤成纤维细胞中的表达及其功能研究
熊 亮,胡 寅,王立夫,曹咬脐,钱莉丽,刘泾科
1南京医科大学附属江苏盛泽医院整形烧伤科,江苏 苏州 215228;2南京医科大学第一附属医院整形烧伤科,江苏 南京210029
miRNA是一类较短的单链RNA,参与许多靶基因的表达与调控,影响细胞生物学功能[1-2]。miRNA⁃199a作为高度保守microRNA,在正常皮肤和肿瘤细胞中表达丰富,影响细胞的增殖和迁移[3-4]。目前对miRNA⁃199a⁃5p的研究主要集中在癌细胞[5-6],本研究构建人皮肤成纤维细胞(human skin fibroblasts HSF)热损伤模型[7],通过逆转录实时定量PCR 对miRNA⁃199a⁃5p 的表达量进行检测,分析热损伤对HSF 增殖和迁移功能的影响;用miRNA⁃199a⁃5p 模拟物转染热损伤细胞,观察其对热损伤细胞的增殖和迁移能力[8],旨在为由热损伤引起的皮肤功能恢复提供研究依据。
1 材料和方法
1.1 材料
正常HSF 购自无锡博慧斯生物医药科技有限公司。低糖细胞培养液(Dulbecco’s modified Eagle’s medium,DMEM)、胎牛血清(fetal bovine Serum,FBS)购自美国Gibco 公司;RNA 提取试剂(TRIzol)、LipofectamineTM 2000 转染试剂、RT⁃PCR 试剂盒购自美国Invitrogen 公司;microRNA mimics(5′ ⁃CCCAGUGUUCAGACUACCUGUUCACAGGUAGU ⁃CUGAACACUGGGGUU⁃3′)、阴性对照mimics(5′⁃CCCAGUGUUCAGACUACCUGUUCACAGGUAGUC⁃UGAACACUGGGUU⁃3′)购自苏州吉玛生物科技有限公司;U6 RT 引物(5′⁃CGAGCACAGAATCGCTT⁃CACGAATTTGCGTGTCAT⁃3′)、miR⁃199a⁃5p RT 引物(5′⁃GTCGTATCCAGTGCAGGGTCCGAGGTATTC⁃GCACTGGATACGACGAACAG⁃3′)、U6 扩增引物(正向引物:5′⁃CGAGCACAGAATCGCTTCA⁃3′;反向引物:5′⁃CTCGCTTCGGCAGCACATAT⁃3′)、miR⁃199a⁃5p 扩增引物(正向引物:5′⁃GTGCAGGGTCCGAGG⁃TATT⁃3′;反向引物:5′⁃CTAACCCAGTGTTCAGAC⁃TAC⁃3′)由苏州金唯智公司合成;四甲基偶氮唑盐(MTT)试剂盒购自上海碧云天生物公司;Transwell小室(康宁公司,美国);Matrigel(B&D 公司,美国);转染试剂Lipo2000(Invitrogen公司,美国)。
1.2 方法
1.2.1 细胞培养
复苏后的HSF常规培养,FBS浓度为10%,胰蛋白酶消化传代。
1.2.2 HSF热损伤处理及热损伤模型的制作
细胞生长至80%~90%,胰蛋白酶消化,分成3个培养皿进行培养:对照组和实验组的培养皿均用封口膜封好,两个热损伤组在同一温度(52 ℃)水浴中热损伤不同时间(30 s和60 s),对照组细胞悬液培养皿在37 ℃水浴中水平面下浸泡30 s。细胞均保持在水平面以下。分别在0 h和24 h进行拍照,并结合瑞⁃姬氏染色法观察热损伤对HSF形态的影响。HSF热损伤模型的制作参照文献[7]:将封口膜密封的培养皿放入52 ℃水浴箱中水平面下浸泡30 s。
1.2.3 MTT实验
将经过热损伤处理的HSF(52 ℃30 s)计数,调节细胞数量至25 000个/mL,每孔200 μL,加入到96孔培养板中。一组培养24 h,另一组培养48 h。培养结束时,每孔分别加入MTT 20 μL,2 h后加入DMSO溶解,570 nm处测吸光度值。
1.2.4 实时定量PCR
将经过热损伤处理的HSF(52 ℃30 s)分为两组,一组培养24 h,另一组培养48 h。收集培养皿中的细胞,用TRIzol 试剂提取细胞miRNA。配制逆转录及PCR 扩增体系。逆转录条件为:50 ℃逆转录30 min,94 ℃失活2 min。PCR 条件为:94 ℃变性15 s,60 ℃退火30 s,68 ℃延伸30 s,共40 个循环后72 ℃继续延伸10 min。通过2-△△Ct法检测miR⁃199a⁃5p的相对含量。
1.2.5 细胞迁移实验
将经过热损伤处理的HSF(52 ℃30 s)调节细胞密度,以过夜铺满为准,接种于6孔板。用100 μL 的枪头在每孔中线轻轻划过,PBS 清洗。用FBS 浓度为4%的DMEM 培养基补充培养液至3 mL/孔。培养24 h后观察细胞的迁移。
1.2.6 细胞侵袭实验
在Transwell 小室膜的上室面加入稀释后基质胶(基质胶与无血清培养稀释比例为1∶7),每孔100 μL,30 min 后吸掉基质胶。将HSF 用DMEM 制成无血清悬液,在上室层各加入250 μL,细胞数为1.5×104个/孔。下室加入10%FBS的DMEM,常规培养24 h。擦净上室面细胞,用4%的多聚甲醛固定下室面剩余细胞,Giemsa 染色,统计细胞个数,以每个小室的平均细胞数为最终计数。
1.2.7 细胞转染实验
HSF稳定传代2~3代,待细胞长满70%时,消化接种至6孔板中继续培养。细胞正常生长后制作热损伤模型(52 ℃30 s)。模拟物组,用100 pmol miR⁃NA⁃199a⁃5p模拟物加5 μL 转染试剂混合转染细胞;对照组,用100 pmol的阴性对照模拟物加5 μL转染试剂Lipo2000 混合转染细胞。添加DMEM 培养液至1 mL/孔。4 h 后更换培养液,用10%FBS 的DMEM继续培养。
1.3 统计学方法
数据分析采用SPSS 13.0统计软件,定量资料以均数±标准差()表示,采用t检验或方差分析进行组间比较,P<0.05为差异有统计学意义。
2 结果
2.1 热损伤对正常HSF形态的影响
正常HSF 呈梭形或三角形,个体饱满,细胞膜光滑透亮。热损伤后HSF 变圆钝,体积增大,表面有较多突起,胞浆中有大量的异常疏松透亮区,核浆比例变小(图1)。
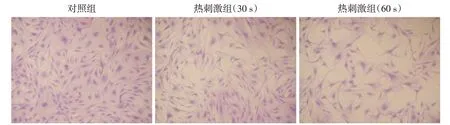
图1 热损伤对HSF形态的影响(Giemsa染色,×200)Figure 1 Effects of thermal injury on HSF morphology(Giemsa staining,×200)
2.2 热损伤对HSF增殖的影响
热损伤24 h 和48 h 后,HSF 增殖明显受到了抑制。相对于正常细胞增殖,热损伤24 h后细胞平均抑制率为(17.10±3.21)%(P<0.002,n=3)、热损伤48 h 后细胞平均抑制率为(25.93±1.74)%(P<0.001,n=3,图2)。

图2 热损伤对HSF增殖的影响Figure 2 Effects of thermal injury on proliferation of HSF
2.3 热损伤对HSF miR⁃199a⁃5p表达的影响
荧光实时定量PCR结果见表1。热损伤后HSF miRNA⁃199a⁃5p的表达明显得到了抑制(图3),24 h HSF miRNA⁃199a⁃5p 表达率为(2.67±0.35)%,与对照组比较,差异有统计学意义(P<0.001),48 h表达率为(18.42±0.44)%,与对照组比较,差异有统计学意义(P<0.001)。
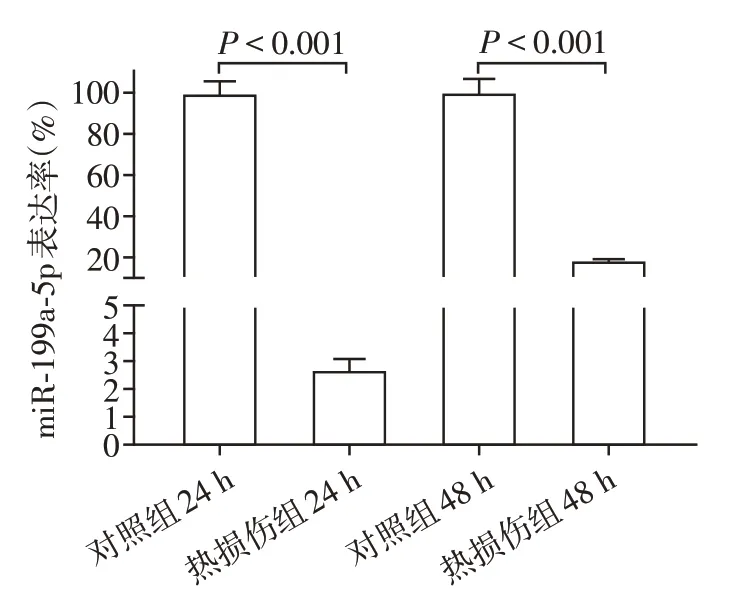
图3 热损伤对HSF miRNA⁃199a⁃5p表达的影响Figure 3 Effects of thermal injury on miRNA⁃199a⁃5p expression in HSF
表1 24 h、48 h热损伤HSF miRNA⁃199a⁃5p qRT⁃PCR结果Table 1 miRNA⁃199a⁃5p qRT⁃PCR results of thermal injury HSF at 24 h and 48 h(n=4,)
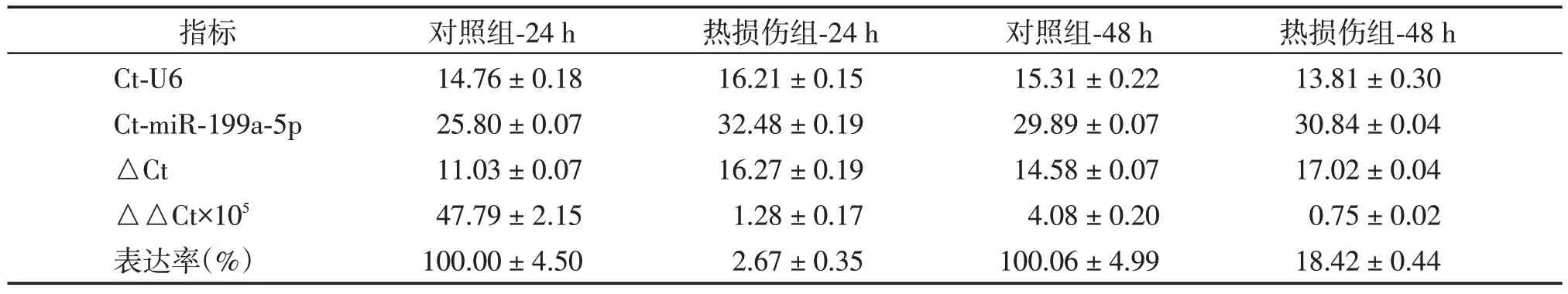
表1 24 h、48 h热损伤HSF miRNA⁃199a⁃5p qRT⁃PCR结果Table 1 miRNA⁃199a⁃5p qRT⁃PCR results of thermal injury HSF at 24 h and 48 h(n=4,)
2.4 热损伤对HSF迁移的影响
热损伤后,HSF 细胞迁移速率明显降低。显微镜下进行细胞计数(n=4),对照组计数结果为(24.75±2.06)个,热损伤组计数结果为(8.75±2.06)个,热损伤对细胞迁移的抑制率为(35.35±7.07)%,与对照组比较迁移功能下降(P<0.001,图4)。

图4 热损伤对HSF迁移的影响Figure 4 Effects of thermal injury on HSF migration
2.5 热损伤对HSF侵袭的影响
热损伤后,HSF 侵袭速率明显降低。显微镜下进行细胞计数(n=4),对照组细胞数量为(21.00±5.56)个,热损伤组细胞数量为(12.00±2.58)个,热损伤对细胞侵袭的抑制率为(57.14±9.52)%,与对照组比较侵袭功能亦下降(P<0.007,图5)。
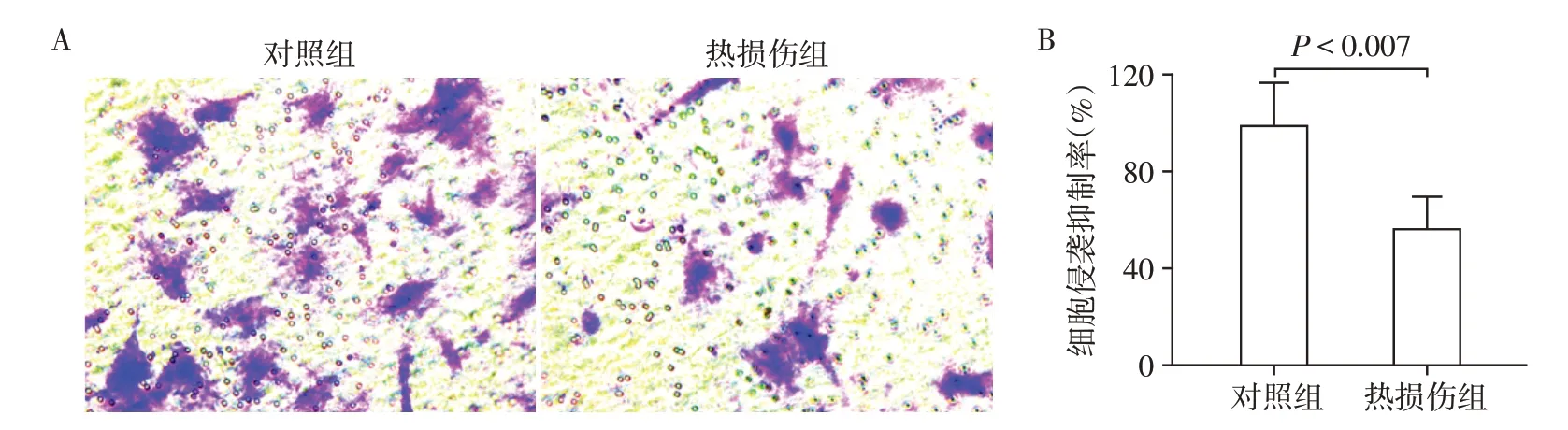
图5 热损伤对HSF侵袭的影响Figure 5 Effect of thermal injury on HSF invasion
2.6 miRNA⁃199a⁃5p 模拟物对热损伤后HSF 增殖的影响
加入阴性模拟物组的细胞增殖率为(104.52±5.46)%,加入miR⁃199a⁃5p 模拟物组的细胞增殖率为(136.55±6.14)%,后者的热损伤细胞增殖明显升高(P<0.003,n=3,图6)。

图6 miRNA⁃199a⁃5p模拟物对热损伤后HSF增殖的影响Figure 6 Effects of miRNA⁃199a⁃5p mimics on prolifera⁃tion of HSF after thermal injury
2.7 miRNA⁃199a⁃5p 模拟物对热损伤后HSF 侵袭的影响
显微镜下对侵袭的细胞进行计数(n=4),加入阴性对照模拟物组细胞数量为(9.00±2.16)个,细胞侵袭率为(112.50±18.75)%;加入miR⁃199a⁃5p 模拟物组细胞数量为(15.75±1.71)个,细胞侵袭率为(196.88±15.63)%,后者的热损伤细胞侵袭率明显升高(P<0.003,图7)。

图7 miRNA⁃199a⁃5p模拟物对热损伤后HSF侵袭的影响Figure 7 Effects of miRNA⁃199a⁃5p mimics on invasion of HSF after thermal injury
3 讨论
在深度烧伤及热压伤中,真皮细胞的代谢、功能、形态等都发生了病理性改变。能够可逆修复创面、恢复功能的间生态真皮是影响手术修复及预后的重要因素[9]。临床治疗过程中,医生时常处于尽可能去除坏死组织和保留间生态组织两难的境地,通过研究影响变性真皮转归的重要因素及其机制,可以为临床治疗提供更多的理论依据。真皮中含有多种细胞,HSF是其中的重要细胞之一,它由胚胎时期的间充质干细胞分化而来。深度烧伤及热压伤后HSF增殖并迁移至创面,大量分泌胶原纤维及各种生长因子,还可以和新生毛细血管、各种炎症细胞形成肉芽组织促进创面的愈合,在创面修复过程中发挥着重要作用。
作为高度保守的micorRNA,miRNA⁃199a⁃5p 广泛存在于皮肤、炎症反应、血管内皮细胞、癌细胞中,参与细胞增殖、凋亡、迁移、侵袭等活动与功能[4,6,10-12]。研究发现,过表达miRNA⁃199a⁃5p 后,U2OS细胞的增殖能力显著降低(P<0.05),同时cy⁃clin D1、p Rb表达水平显著下降,而P27、LC3Ⅱ/Ⅰ、Beclin 1 的表达水平显著增加(P<0.05)[5]。miR⁃199a⁃5p 通过调节EGF、SP1 下调ERK5 的表达并抑制其磷酸化,进而发挥对乳腺癌MDA⁃MB⁃231 细胞侵袭的抑制作用[13]。
大鼠真皮热压伤实验显示,在不同时间点获取组织样本,检测样本中miRNA⁃199a⁃5p 的相对表达量,结果显示miRNA⁃199a⁃5p 相对表达量为先抑制后上调的趋势[14]。推测在大鼠皮肤组织受损初期,真皮层受到影响,变性真皮细胞在短时间内无法恢复正常功能,因此细胞内miRNA⁃199a⁃5p 的表达量相对减少,表现为表达抑制。此结论可能也适用于人的皮肤组织。因此,本研究利用HSF,通过构建热损伤模型观察细胞的形态变化,检测细胞中miRNA⁃199a⁃5p表达量的变化,以及人为干扰miRNA⁃199a⁃5p表达量来观察热损伤对HSF的影响。
本研究观察到,热损伤模型中HSF形态发生了改变,miRNA⁃199a⁃5p表达量显著下调,并显著抑制HSF 的增殖、迁移和侵袭能力。通过转染模拟物的方式提高热损伤人成纤维细胞中miRNA⁃199a⁃5p的量,可以显著提高热损伤细胞的增殖和侵袭能力,提示HSF热损伤后的细胞功能与miRNA⁃199a⁃5p的表达量密切相关。这与之前的动物实验结果相对应。而如何在皮肤热损伤后提高人皮肤成纤维细胞中miRNA⁃199a⁃5p 的表达量,加快热损伤皮肤的恢复与治疗,成为下一步研究的方向。

