叶面喷施脂肪酸对甜菜幼苗抗低温胁迫的影响
何硕,范国凯,张广华,於丽华,耿贵
(黑龙江大学现代农业与生态环境学院,哈尔滨 150080)
0 引言
低温是影响植物生长发育和产量、品质形成的主要环境因子[1]。对植物的伤害表现为膜相改变以及膜的损害而引起的代谢紊乱[2-3]。植物生长的各个阶段都会受到温度的影响。为缓解其伤害,植物体内会积累一些可溶物质,如脯氨酸、可溶性糖、可溶性蛋白等,这些物质可在细胞受到低温胁迫时起到渗透调节作用[4]。细胞膜作为细胞与外界环境联系的界面,最先感知低温伤害。脂肪酸作为细胞膜的必要组分之一,对于植物适应低温环境最为关键,因此对脂肪酸进行调整是植物适应低温胁迫的重要方式之一[1]。
甜菜(Beta vulgarisL.)属藜科二年生草本植物,是全球最重要的糖料作物之一,为全球提供接近20%的糖产量[5]。甜菜具有喜冷凉湿润,耐低温、耐盐碱等特点,是我国的主要糖料作物之一[6]。内蒙古、新疆、黑龙江是我国甜菜的主要产区,近年来这些地区无法控制的极端低温天气是制约甜菜高产、稳产的重要因素。因此,探究甜菜幼苗耐寒性,对选育甜菜耐寒品种,提升甜菜幼苗抗低温胁迫能力,延长生长期以及扩大种植面积具有重要意义。研究发现,甜菜在低温条件下,会通过一系列生理生化反应诱导合成新蛋白质、提高脯氨酸和可溶性糖含量、提高抗氧化酶活性等,来减轻或消除逆境伤害下产生的不利因素[7]。喷施外源物质能够提高低温条件下植物的抗寒性,如氨基酸水溶肥、蔗糖、芸苔素内酯[8]和脱落酸[9]等。尽管国内外已有大量关于甜菜抗低温胁迫及植物抗逆物质调控的研究,但利用脂肪酸调控、预防甜菜低温冻害的相关研究仍然较少。本研究以甜菜品种‘KWS1176’为试验材料,在室内进行盆栽试验,研究叶面喷施脂肪酸对低温胁迫下甜菜幼苗生长及生理指标的影响,了解脂肪酸对甜菜幼苗低温胁迫的调控效应。
1 材料与方法
1.1 试验材料
供试甜菜品种为‘KWS1176’。盆栽试验采用室内培养,光照常温培养条件为LED 灯光照,HPG-280HX人工气候箱,低温处理使用LRH-250CL低温培养箱。
1.2 试验设计
试验共设置4 种处理,分别为T0:蒸馏水对照;T1:叶面喷施2.5%脂肪酸溶液;T2:叶面喷施5%脂肪酸溶液;T3:叶面喷施7.5%脂肪酸溶液。每组7 次重复。播种方式:每盆先放400 g 土壤,再均匀摆入20 粒种子,100 g 土覆盖。每盆加入100 mL 改良的1/2 Hoagland 营养液[3.5 mmol/L Ca(NO3)2·4H2O、1 mmol/L Mg-SO4·7H2O、0.5 mmol/L NH4H2PO4、3.5 mmol/L KCl和3 mmol/L NaCl]、EDTA-Fe(0.06 mmol/L FeSO4-EDTA)、阿农微量元素。放入LED灯下培养,光照14 h/d,黑暗10 h/d,开灯温度25 ℃、关灯温度20 ℃。培养5 d至发芽出苗后,放入光照培养箱内培养,培养温度设置见表1。光照14 h/d,黑暗10 h/d,温度为8~20 ℃(从20 ℃开始,以2 ℃/h为标准先降低至8 ℃后,再升高到20 ℃),培养5 d后叶面喷施脂肪酸溶液处理,2 d一次,共两次。培养期间定时浇水,保持土壤相对含水量在70%左右,定时倒盆换位,保证每盆所受光照一致。
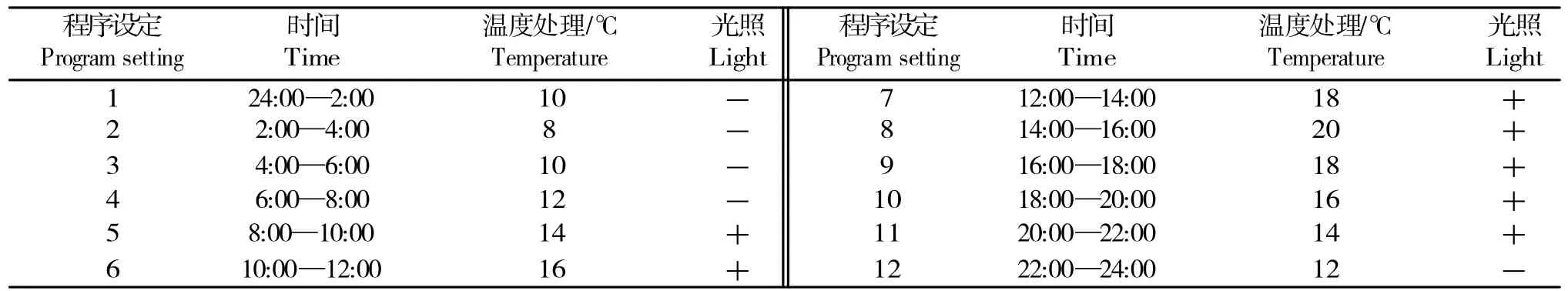
表1 光照培养箱温度设置情况Table 1 Temperature setting of the light incubator
播种3 d后开始记录各处理的出苗数,叶面喷施脂肪酸后,待幼苗第一对真叶显现时,保留每盆中长势一致的甜菜幼苗进行3 h的-2 ℃低温锻炼处理,24 h后进行3 h的-4 ℃冷冻处理。冷冻结束取样测定指标。训练和冷冻处理培养箱设置情况见表2。低温处理后统计甜菜幼苗低温冻害死亡率且进行数据分析。

表2 低温培养箱温度设置情况Table 2 Temperature setting of the low temperature incubator
1.3 测定指标和方法
1.3.1 冻害死亡率、地上部干重和鲜重的测定
冻害死亡率为植株死亡数与总株数的比值。从各处理每盆中取5 株叶片完整的幼苗,测定其地上部鲜重。将已知鲜重的甜菜幼苗放入105 ℃烘箱中杀青30 min,再以75 ℃烘至恒重,用万分之一分析天平称量幼苗干重。每个处理重复3次。
1.3.2 生理指标的测定
参考李合生等[10]的方法进行以下生理指标的测定。采用硫代巴比妥酸法测定MDA。抗氧化酶活性测定:采用抑制NBT 光还原比色法测定SOD 活性;采用愈创木酚法测定POD 活性;采用紫外线吸收法测定APX 活性;采用过氧化氢紫外线法测定CAT 活性。渗透调节物质测定:采用考马斯亮蓝G-250 染色法测定可溶性蛋白含量;采用蒽酮乙酸乙酯法测定可溶性糖含量[11]。
叶片的相对电导率(REC)参考LI等[12]的方法进行测定。将处理后的甜菜幼苗用去离子水冲洗干净,剪成小份,混合均匀,称取2 g 放入20 mL 刻度试管中,加入20 mL 去离子水,真空抽气30 min,摇匀后用DDS-307 电导率仪测定初始电导率R1。再将试管封口,沸水浴加热1 h,冷却后摇匀,测定最终电导率R2。相对电导率=R1/R2×100%。根系活力采用α-萘胺法测定[13]。
1.4 数据分析
采用Office 2019 和DPS 7.05 软件对数据进行处理和统计分析。采用单因素试验统计分析方法(LSD法),对不同处理的试验数据进行差异显著性检测(显著性水平为0.05)。
2 结果与分析
2.1 不同浓度脂肪酸对甜菜幼苗冷冻死亡率的影响
由图1可知,甜菜幼苗喷施不同浓度脂肪酸使甜菜幼苗冷冻死亡率明显降低。T0 蒸馏水处理的幼苗死亡率达到79.50%,比T1、T2、T3 组分别高出8.22、45.22、5.56 个百分点。T1、T2 与T0 之间幼苗死亡率差异显著(P<0.05),T2组幼苗死亡率最低,冻害缓解效果最好。

图1 不同浓度脂肪酸对低温胁迫下甜菜幼苗死亡率的影响Fig.1 Effects of different concentrations of fatty acids on seedling mortality of sugar beet under low temperature stress
2.2 不同浓度脂肪酸对低温胁迫下甜菜幼苗地上部干重、鲜重和根系活力的影响
由表3可知,叶面喷施不同浓度脂肪酸处理在低温胁迫下,甜菜幼苗地上部干重、鲜重与T0 相比有所增加,其中,T2 增加最为明显,鲜重比T1、T3 及T0 组分别增加31.51%、48.69%、68.42%;干重分别比T1、T3 及T0 组分别增加14.29%、52.38%、68.42%,T3 与T0 之间差异不显著,其他处理与T0 差异显著。随着脂肪酸浓度的加大,幼苗根系活力出现先升高后降低的趋势,T1、T2 与T0 之间差异显著,根系活力表现最好的为T2[75.238µg/(g·h)],较T0处理根系活力增加71.74%。

表3 不同浓度脂肪酸对低温胁迫下甜菜幼苗地上部鲜重、干重和根系活力的影响Table 3 Effects of different concentrations of fatty acids on fresh weight,dry weight of above ground part and root activity of sugar beet seedlings under low temperature stress
2.3 不同浓度脂肪酸对低温胁迫下甜菜幼苗叶片质膜透性的影响
甜菜幼苗叶面喷施不同浓度脂肪酸经低温胁迫后,叶片相对电导率均呈降低趋势(图2A)。T0 的甜菜叶片相对电导率较高(87.87%)。T1、T2、T3 处理电导率较T0分别降低37.01、62.90、13.78 个百分点,除T3与T0 差异不显著外,其他处理之间差异显著(P<0.05),T2(5%脂肪酸)处理喷施效果最佳,因此推测,叶面喷施脂肪酸可以保护甜菜叶片细胞膜,减缓低温胁迫下电导率的上升幅度。
叶面喷施不同浓度脂肪酸经过低温胁迫后,甜菜叶片细胞内MDA 含量较T0 显著降低(图2B),各处理间均具有显著性差异(P<0.05)。T1、T2、T3 处理MDA 含量较T0 分别降低13.86%、22.74%、10.52%,T2 下降幅度最大。甜菜叶片MDA 含量随着喷施脂肪酸浓度增加呈先降低后升高的趋势。其中,T2(5%脂肪酸)处理喷施效果最佳。

图2 低温胁迫下不同浓度脂肪酸对甜菜幼苗相对电导率(A)和MDA(B)含量影响Fig.2 Effects of different concentrations of fatty acids on relative electrical conductivity(A)and MDA content(B)of sugar beet seedlings under low temperature stress
2.4 不同浓度脂肪酸对低温胁迫下甜菜幼苗叶片抗氧化酶活性的影响
由表4 可知,与T0 处理相比,叶喷脂肪酸甜菜幼苗在低温胁迫下叶片SOD 活性下降,T1、T2 与T0 之间SOD活性差异显著(P<0.05)。T1、T2、T3处理SOD活性比T0分别降低12.57%、37.72%、0.57%。随着脂肪酸喷施浓度的增大,SOD活性在T1、T2处理间呈下降趋势,并显著差异(P<0.05)。与T0处理相比,叶喷脂肪酸甜菜幼苗低温胁迫下叶片POD 活性均显著降低,T1、T2、T3 处理的POD 活性较T0 分别降低15.38%、33.35%、19.88%。T1、T2、T3处理的CAT活性与T0相比均差异显著,较T0分别降低12.78%、25.28%、9.19%。T1、T2、T3处理的APX 活性与T0相比均有下降,T1、T2、T3 活性较T0分别降低25.12%、44.08%、13.74%,T1、T2 与T0 相比差异显著(P<0.05)。低温胁迫下甜菜幼苗叶片各抗氧化酶活性随脂肪酸的喷施而活性降低,T2(叶面喷施5%脂肪酸)处理下,POD、SOD、CAT和APX酶的活性最低。

表4 不同浓度脂肪酸对低温胁迫下甜菜幼苗叶片抗氧化酶活性的影响Table 4 Effects of different concentrations of fatty acids on antioxidant enzyme activities of sugar beet seedling leaves under low temperature stress
2.5 不同浓度脂肪酸对低温胁迫下甜菜幼苗叶片渗透调节物质的影响
可溶性蛋白作为植物体内必不可少的渗透调节物质,参与渗透调节过程,其含量的多少直接反映植物在低温胁迫下的适应能力。由图3A可知,与对照T0处理相比,可溶性蛋白含量随着脂肪酸浓度的提升而呈现先升高后降低的趋势,各处理之间差异显著,T1、T2、T3 可溶性蛋白含量比T0 分别增加13.31%、31.12%、9.65%。叶面喷施脂肪酸溶液可提高甜菜幼苗叶片可溶性蛋白含量,T2(5%脂肪酸)处理效果最佳。
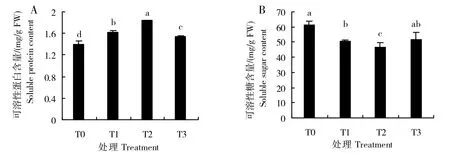
图3 低温胁迫下不同浓度脂肪酸对甜菜幼苗可溶性蛋白含量(A)和可溶性糖含量(B)的影响Fig.3 Effects of different concentrations of fatty acids on soluble protein content(A)and soluble sugar content(B)of sugar beet seedlings under low temperature stress
可溶性糖是冷害和冻害条件下细胞内的保护物质,是植物体内重要的调节物质之一。低温胁迫下甜菜幼苗叶片内可溶性糖含量T1、T2、T3 与T0 比均有下降(图3B),T1、T2、T3 可溶性糖含量较T0 分别降低17.56%、24.05%、15.06%,T1、T2与T0差异显著(P<0.05)。随着喷施浓度的增加低温胁迫下甜菜幼苗叶片内可溶性糖含量呈先降低后升高的趋势,且对甜菜幼苗保护能力以T2(5%脂肪酸)处理效果最佳。
3 讨论与结论
3.1 脂肪酸对低温胁迫下甜菜幼苗生物量、根系活力和冻害死亡率的影响
低温作为自然环境胁迫之一,它影响植物的生长发育及其产量。农业生产中常因低温伤害而导致农作物减产,造成农业经济损失惨重[14]。低温条件下,植物能通过转导系统调控自身的生理生化代谢途径,合成有关物质,以缓解低温伤害[15]。在本试验中,叶面喷施不同浓度脂肪酸,甜菜幼苗的地上部干重、鲜重及根系活力均有增加,死亡率下降。叶面喷施蒸馏水的幼苗受冻害最为严重,死亡率达到79.50%,根系活力显著下降。而随着不同浓度脂肪酸的喷施,甜菜子叶期幼苗的干重、鲜重以及根系活力呈先升高后下降的趋势,而幼苗死亡率呈先下降后升高的趋势。说明脂肪酸能够减缓低温对幼苗生长的抑制作用,保证幼苗正常生长,使幼苗地上部干重、鲜重及根系活力维持在较高水平,从而降低幼苗死亡率。试验初步得出,当喷施脂肪酸溶液浓度为5%时,抗冻效果最佳。
3.2 脂肪酸对低温胁迫下甜菜幼苗抗氧化酶活性、MDA含量和相对电导率的影响
抗氧化酶对植物的调节作用是抗氧化调节系统的重要组成部分,能清除并稳定因低温导致的细胞膜和内部结构的变化所产生的活性氧(AOS),从而维持植物正常的生长发育[16-17],使细胞避免过氧化伤害。试验结果表明,叶面喷施脂肪酸溶液的甜菜幼苗经-4 ℃低温胁迫后,与对照组相比,SOD、POD、CAT、和APX 的活性均下降。说明甜菜叶片经脂肪酸处理后将直接提高叶片耐低温能力,减少细胞过氧化物质产生,同时也说明低温处理使甜菜幼苗细胞结构遭受伤害,细胞生物酶活性降低,使其调节能力降低。这与张淑英等[17]对低温胁迫下棉花幼苗生长研究结果相同。在低温胁迫下叶面喷施脂肪酸的甜菜幼苗叶片MDA 含量和相对电导率与对照相比呈显著下降趋势,说明喷施脂肪酸能够保护细胞膜结构,减少细胞膜的脂质过氧化和细胞内溶质的外渗,对正常的生理代谢和维持细胞微环境起着重要的作用,这与茉莉酸对低温胁迫水稻幼苗的生理效应[18]研究结果相同。在正常情况下,当植物受到低温危害时,不仅会使细胞内的电解质外泄,细胞膜透性也会随之提高,导致植物细胞浸提液的电导率增大[19]。与对照组相比,叶面喷施浓度为5%浓度脂肪酸溶液可以降低MDA 含量和相对电导率。推测是因为脂肪酸能够稳定细胞壁、细胞膜和膜蛋白,使细胞膜的代谢系统趋于正常。
3.3 脂肪酸对低温胁迫下甜菜幼苗叶片渗透调节物质的调节作用
可溶性蛋白和可溶性糖是植物体内重要的渗透调节物质,主要作用是降低渗透势,增强细胞的吸水能力,从而适应低温胁迫的过程[20-21]。本试验结果表明,与对照处理相比,叶面喷施脂肪酸处理经-4 ℃的低温胁迫后甜菜幼苗叶片中可溶性蛋白含量均显著提高,而可溶性糖含量呈下降趋势。说明低温对甜菜幼苗造成了伤害,触发了甜菜幼苗的抗冷机制,促使甜菜主动积累可溶性蛋白,降低细胞渗透势,缓减甜菜幼苗因低温而导致的细胞失水,从而减轻甜菜幼苗的低温伤害[22-24]。本试验研究表明,与对照相比,叶面喷施一定浓度的脂肪酸溶液低温胁迫下可提高甜菜幼苗叶片可溶性蛋白含量,在5%的浓度达到最佳,可以有效减轻甜菜幼苗在低温条件下受到的伤害。
本试验发现,在5%的脂肪酸处理下,甜菜幼苗地上部干重、鲜重和根系活力较其他处理增高,死亡率降低,MDA 含量及电导率较其他处理降低明显。脂肪酸浓度过低虽能提高甜菜幼苗的抗寒能力,但效果并不显著;而当喷施的脂肪酸浓度过高时,则会对幼苗的生长产生明显的抑制作用。因此,初步得出叶面喷施5%浓度的脂肪酸能最大程度地缓解因低温胁迫对甜菜生长产生的抑制作用。在今后的生产实践过程中,可以考虑合理施用脂肪酸来防止或降低低温对农业生产带来的损失。

