QuEChERS/液相色谱-串联质谱测定猪肉中赛拉嗪及其代谢产物2,6-二甲基苯胺
张译文,任苏瑜,翟明燕,何 欣,谭 峰
(大连理工大学 环境学院,工业生态与环境工程教育部重点实验室,辽宁 大连 116024)
赛拉嗪是一种α受体激动剂,可直接作用于中枢神经系统,起到镇静、镇痛和麻醉效果,常作为肌肉注射镇静剂、止痛药和肌肉松弛剂用于动物的基础麻醉[1-2]。赛拉嗪在动物体内的主要代谢产物为2,6-二甲基苯胺(DMA),其可引起高铁血红蛋白症,对中枢神经和肝脏有一定损伤,严重时造成昏迷、休克,且具有基因毒性和致癌作用,世界卫生组织国际癌症研究机构将DMA列为2B类致癌物[3-4]。因此,动物源性食品中赛拉嗪和DMA的分析具有重要意义。
目前,赛拉嗪和DMA的分析主要采用液相色谱和液相色谱-质谱联用技术[1,5-8]。如高雪和崔晶晶等[5-6]对血液和尿液中的赛拉嗪及DMA含量进行了检测。Zheng等[7]测定了动物组织中赛拉嗪和DMA的残留量。由于生物样品基质的复杂性,样品前处理过程尤为关键。目前生物样品常用的前处理方法为液液萃取、固相萃取等,这些前处理方法操作较复杂且有机溶剂用量较多。QuEChERS是一种操作简便、快速的样品前处理技术,广泛用于生物、食品及环境样品的净化处理[9-11]。本文将QuEChERS方法用于猪肉样品中赛拉嗪和DMA的前处理,考察了不同提取溶剂、吸附剂种类及用量对目标物回收率的影响,建立了猪肉中赛拉嗪及DMA的QuEChERS/液相色谱-串联质谱(LC-MS/MS)测定方法。该法具有简单、快速、灵敏度高等优点,可用于市售猪肉样品中赛拉嗪及DMA的筛查。
1 实验部分
1.1 仪器与试剂
Agilent RPLC/6410B液相色谱-三重四极杆串联质谱(美国安捷伦科技有限公司),KQ-20DE超声波清洗器(昆山市超声波仪器公司),D-130匀浆机(德国Wiggens公司),VM-02U涡旋仪(美国Crystal公司),BSA224S电子天平(德国Sartorius公司),H1750离心机(湖南湘仪公司),Smart-S15实验室纯水系统(上海和泰公司),WD-12氮吹仪(杭州奥盛公司)。
甲醇、乙腈(色谱纯,Sigma-Aldrich公司),甲酸(色谱纯,天津市科密欧化学试剂有限公司),赛拉嗪和DMA标准品(纯度大于98%,Dr.Ehrenstorfer公司);C18吸附剂(50µm)和N-丙基乙二胺(PSA,40~63µm)均购于天津博纳艾杰尔科技有限公司;猪肉样品购于当地超市。
1.2 液相色谱-质谱条件
色谱条件:色谱分析在Agilent RPLC/6410B液相色谱-三重四极杆串联质谱上完成。色谱柱为Waters C18(100mm×2.1 mm,3.5 µm),柱温为40℃,进样体积为10µL,流速为0.25 mL/min。流动相:A相为0.1 %甲酸-水溶液,B相为0.1 %甲酸-乙腈溶液。梯度洗脱条件:0~0.5 min,20% B,0.5 ~4min,20%~70%B;4~4.01 min,70%~20%B。
质谱条件:电喷雾正离子采集模式,雾化气压力为0.31 MPa,干燥气温度为250℃,干燥气流速为14L/min,鞘气温度为350℃,鞘气流速为12L/min,毛细管电压为4kV,喷嘴电压为1kV,碰撞解离电压为120V,扫描范围为m/z50~500,定量分析采用多反应监测模式。
1.3 标准溶液配制
准确称量赛拉嗪和DMA标准品各1.0 mg于10.0 mL容量瓶中,用乙腈溶解后定容,配制得到质量浓度为100mg/L的标准储备液,于-20℃冷藏保存。
1.4 样品前处理
1.4.1 QuEChERS法 称取匀浆后的猪肉组织5g(“2.2.1 ”进行提取方法比较时均使用0.25 g)于离心管中,加入赛拉嗪和DMA混标溶液,使每种待测物的含量均为100µg/kg,涡旋后加入2%乙酸-乙腈溶液使总体积为20mL,匀浆1min,涡旋振荡,然后加入3g无水Na2SO4和1g NaCl[12-13],超声1min,离心并收集全部上清液。向其中加入50mg PSA和100mg C18吸附剂,涡旋并超声1min,于4℃离心得上清液,取2mL提取液氮吹至近干,用1mL初始流动相复溶,过0.22 µm滤膜后待LC-MS/MS分析。
1.4.2 液液萃取法 称取匀浆后的猪肉组织0.25 g于离心管中,加入混标溶液,使每种待测物的含量均为300µg/kg,涡旋混匀后,加入2%乙酸-乙腈溶液使总体积为3mL,匀浆1min,涡旋振荡,离心收集上清液,残渣用乙腈洗涤,重复提取1次,合并上清液。向其中加入2mL乙腈饱和的正己烷,水平振荡提取5min,收集下层,相同步骤用正己烷重复提取2次,合并提取液后氮吹至近干,用1mL初始流动相复溶,过0.22 µm滤膜后待LC-MS/MS分析。
2 结果与讨论
2.1 液相色谱-质谱检测条件的优化
根据待测物分子结构,赛拉嗪和DMA中均含有氨基,易质子化带正电荷,因此采用正离子模式。以乙腈-水为流动相,并在流动相中添加0.1 %甲酸,以提供质子化所需H+。对流动相梯度洗脱条件进行了优化,实验发现采用“1.2”所示的简单梯度洗脱程序,赛拉嗪和DMA即能实现很好的分离,整个分析过程可在4min完成(图1A)。
为准确定性样品中的赛拉嗪和DMA,每个化合物须有2个定性离子。通过对赛拉嗪和DMA的二级谱图进行分析,发现赛拉嗪碎裂后产生的碎片离子中,以m/z为90.3 和164.3 的碎片离子信号最强且稳定;而DMA以m/z为105.4 和107.4 的碎片离子信号最强且稳定,因此分别选择上述碎片离子作为赛拉嗪和DMA的定性离子,与母离子构成定性离子对(如表1),对样品中赛拉嗪和DMA进行确认。此外,分别选择m/z为90.3 和105.4 两个碎片离子作为赛拉嗪和DMA的定量离子。进样质量浓度为100µg/L时,赛拉嗪和DMA碎片离子的提取离子色谱图分别为图1B和C。
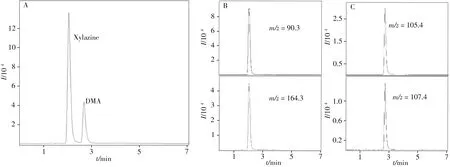
图1 赛拉嗪和DMA的总离子流图(A)及赛拉嗪(B)和DMA(C)碎片离子的提取离子色谱图Fig.1 Total ion chromatogram of xylazine and DMA(A)and extracted ion chromatograms of xylazine(B)and DMA(C)

表1 赛拉嗪及DMA的质谱分析参数Table1 Analytical parameters of tandem mass spectrometry for xylazine and DMA
2.2 提取条件的优化
2.2.1 提取方法的选择 将市购猪肉组织绞碎后按“1.4 ”两种方法进行溶剂提取、净化处理,结果未检出赛拉嗪和DMA,因此采用该样品制备基质空白溶液。首先对比分析了液液萃取法和QuEChERS法对猪肉中赛拉嗪和DMA的提取、净化效果及回收率,猪肉组织取样量均为0.25 g,提取溶剂体积为3mL。结果显示,使用液液萃取法获得的样品背景较复杂,出现较多杂峰,干扰赛拉嗪和DMA的定量分析,目标物的回收率为39.4 %~70.3 %。而采用QuEChERS法的除杂效果明显,色谱图的峰形较好,赛拉嗪和DMA的回收率为78.1 %~81.9 %,高于液液萃取法的回收率。因此实验选择QuEChERS法对样品进行前处理。
2.2.2 提取溶剂的优化常见的提取溶剂有甲醇、正己烷、乙酸乙酯和乙腈等。研究表明,提取过程中加入微量有机酸(如甲酸、乙酸)能够促进目标物在水相和有机相之间的分配和转移[12]。考虑到猪肉样品中大量的蛋白质、脂质在乙腈或甲醇体系中有较好的沉淀效果,且目标物在乙腈和甲醇中的溶解度高,因此分别考察了乙腈(ACN)、甲醇(MeOH)、乙腈-2%乙酸(HAc)、甲醇-2%乙酸作为提取溶剂时的效果。向空白样品中添加混合标准溶液使每种待测物的含量均为100µg/kg,按照“1.4.1”中QuEChERS方法以上述4种溶剂提取样品后测定。结果显示,4种溶剂对赛拉嗪的提取效率为67.3 %~88.9 %,而对DMA的提取效率较低,仅为9.3 %~36.5 %。其中以乙腈-2%乙酸为提取溶剂时赛拉嗪和DMA的提取效果最好(图2)。因此,选择乙腈-2%乙酸作为提取溶剂。

图2 不同提取溶剂对赛拉嗪和DMA回收率的影响Fig.2 Effects of extraction reagents on the recoveries of xylazine and DMA
2.2.3 吸附剂种类与用量的优化PSA是一种极性吸附剂,对目标物的保留机理为弱阴离子交换(水溶性基质)、极性相互作用(非极性有机基质)、螯合作用,可有效去除脂肪酸、有机酸、极性色素和糖,广泛用于农残样品的前处理[13-14]。C18的疏水性强,对非极性组分有吸附作用,主要用于反相萃取,适用于非极性到中等极性的化合物。实验考察了PSA(75mg)、C18(75mg)、PSA/C18(25mg/50mg)分别作为吸附剂对赛拉嗪和DMA回收率的影响。按照“1.4.1 ”中QuEChERS方法进行前处理,结果如图3所示,使用上述3种吸附剂时,赛拉嗪的回收率为70.6 %~77.1 %,差异较小;而DMA使用PSA和C18混合吸附剂的回收率为59.9 %,明显高于单独使用PSA或C18的回收率(15.9 %和48.0 %)。因此,实验选择PSA/C18混合吸附剂进行样品净化处理。

图3 吸附剂种类对赛拉嗪与DMA回收率的影响Fig.3 Effects of adsorbents on the recoveries of xylazine and DMA
进一步对比了PSA/C18(10mg/20mg、25mg/50mg和50mg/100mg)不同用量组合条件下赛拉嗪和DMA的回收率。结果显示,上述3种条件下赛拉嗪的回收率为89.1 %~90.4 %,DMA的回收率为59.9 %~79.3 %。实验选择PSA和C18的用量分别为50mg和100mg,此时两目标物的回收率总体较好。
2.3 基质效应
在液相色谱-质谱分析时,基质效应常对分析过程有显著干扰,影响分析结果的准确性。考虑到猪肉中含有较多蛋白质和脂肪,本文考察了赛拉嗪和DMA在空白样品中的基质效应。分别用纯乙腈溶剂和空白基质溶液稀释赛拉嗪和DMA样品的标准储备液,制备成不同质量浓度的系列溶液,然后按照本方法进行测定,以目标物定量离子的峰面积对质量浓度做校正曲线,并以2种曲线斜率的比值作为基质效应。结果表明,赛拉嗪与DMA的基质效应分别为0.86 和0.89 ,均表现为弱抑制效应。为减少基质效应的影响,提高准确性和重复性,实验采用基质匹配校准曲线对目标物进行定量。
2.4 方法学评价
向空白基质溶液中加入不同质量浓度的混合标准溶液,按照“1.4.1”方法进行前处理后测定,以目标物定量离子的峰面积对其质量浓度进行线性拟合,得到赛拉嗪和DMA的线性范围均为0.2 ~500µg/L。以3倍信噪比时的质量浓度作为检出限(LOD),以10倍信噪比时的质量浓度作为定量下限(LOQ),计算得到赛拉嗪和DMA的LOD分别为0.05 、0.15 µg/L,LOQ分别为0.16 、0.50 µg/L,换算成以样品质量计算LOD分别为0.10 、0.30 µg/kg,LOQ分别为0.32 、1.00 µg/kg(见表2)。
为考察方法的回收率,取不同质量浓度赛拉嗪和DMA的混标溶液加入匀浆后的肉类样品,使不同样品间目标物的含量为10、100、1000µg/kg,每个加标样品设6个平行组。经前处理及LC-MS/MS测定后,计算得到赛拉嗪和DMA的回收率分别为95.6 %~108%和70.3 %~79.5 %,相对标准偏差(RSD)分别为2.6 %~2.8 %和3.1 %~5.0 %(见表2)。
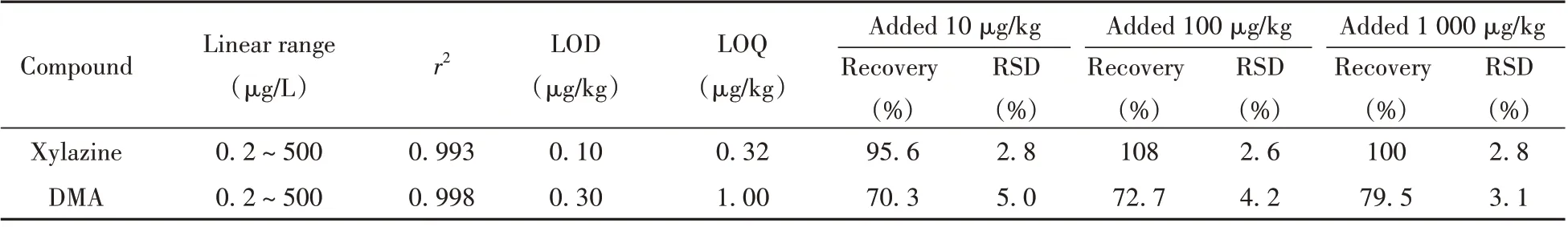
Compound Linear range(µg/L)0.2 ~500 0.2 ~500 r2 Xylazine DMA 0.993 0.99 8 LOD(µg/kg)0.10 0.3 0 LOQ(µg/kg)0.32 1.0 0 Added10µg/kg Recovery(%)95.6 70.3 RSD(%)2.8 5.0 Added100µg/kg Recovery(%)108 72.7 RSD(%)2.6 4.2 Added1000µg/kg Recovery(%)100 79.5 RSD(%)2.8 3.1
2.5 实际样品的检测
为验证本方法的实用性和可靠性,在当地商场选择10个猪肉样品,按照本方法对样品进行净化后分析其中赛拉嗪和DMA的残留。结果发现所有样品均未检出赛拉嗪,但在1个样品中检出DMA,其含量为1.13µg/kg。图4为该样品的色谱图。
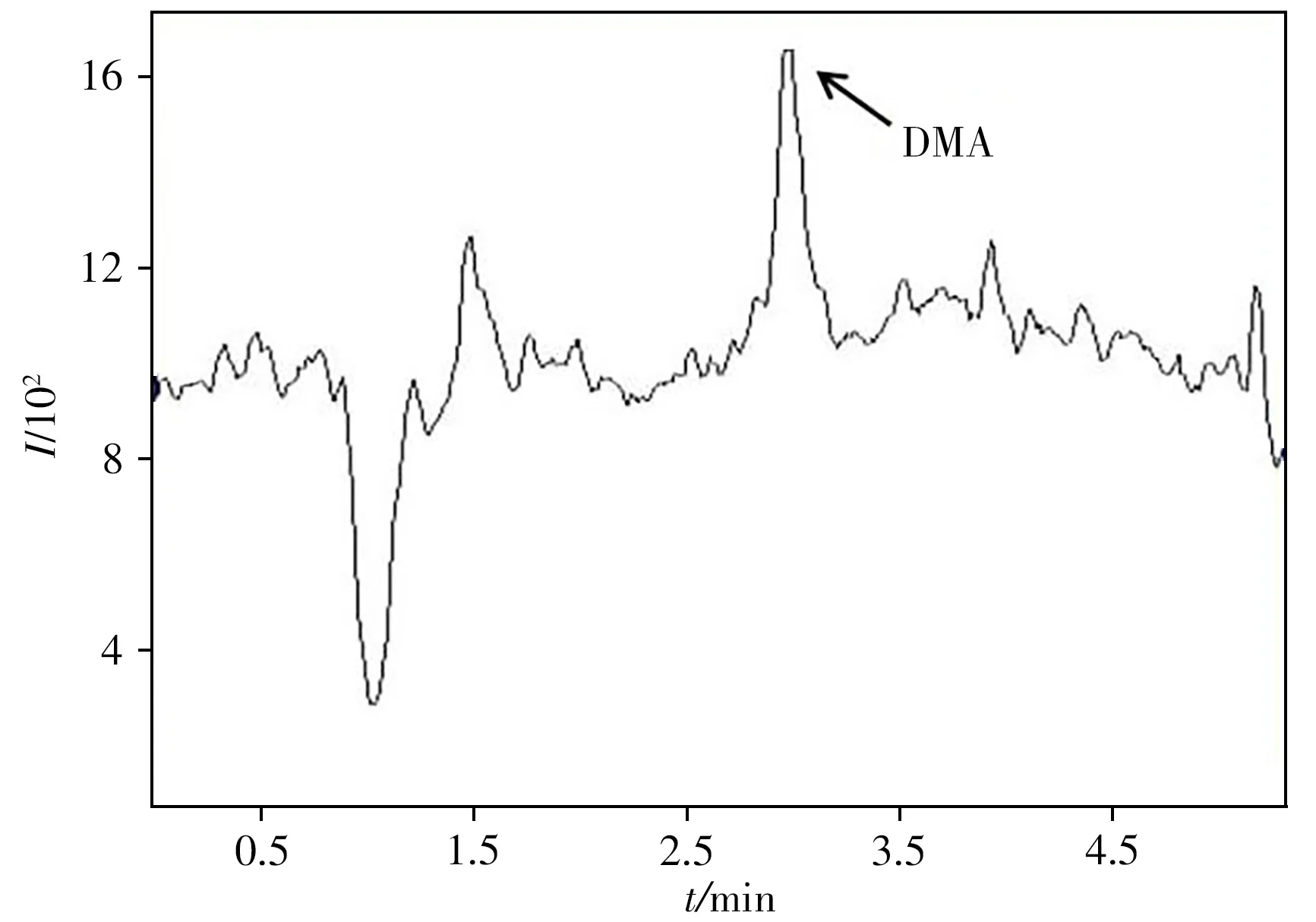
图4 实际样品测定的色谱图Fig.4 Chromatogram of an actual sample
3 结 论
本文建立了QuEChERS/液相色谱-串联质谱测定猪肉中赛拉嗪及其代谢产物DMA的分析方法,并优化了提取溶剂、吸附剂种类和用量以及色谱、质谱分析条件。所建立的方法操作简单、分析速度快,回收率高,对赛拉嗪和DMA的检出限分别为0.10 、0.30 µg/kg,能够满足实际样品分析的要求。该方法成功应用于市售猪肉中赛拉嗪和DMA残留的检测。

