畜禽肉及饲料中氟苯尼考残留免疫分析方法研究
谢美婵,杨金易,李 然,肖治理,王 弘,徐振林,孙远明,沈玉栋
(华南农业大学 食品学院/广东省食品质量安全重点实验室,广东 广州 510642)
氟苯尼考(Florfenicol,FF,图1)是新一代氯霉素类广谱抗菌药[1],具有抗菌广谱、吸收好、体内分布广、安全高效等特点。自氯霉素禁用后,氟苯尼考作为氯霉素的替代物,常用于畜禽呼吸道和消化道细菌性感染病的防治[2]。但氟苯尼考具有血液毒性和胚胎毒性等,且随着使用范围和剂量加大,细菌也会对其产生耐药性[3-4]。我国2019年发布的GB31650-2019《食品安全国家标准食品中兽药最大残留限量》中规定氟苯尼考在不同动物组织中的残留限量为0.1 ~30.0 µg/g[5]。然而,随着畜禽养殖业的发展,氟苯尼考滥用导致其在畜禽体内积累,引发的畜禽食品安全问题日益突出[6],对人们的健康产生了巨大潜在危害。因此,开发灵敏准确的检测方法对畜禽产品中的氟苯尼考残留进行监管至关重要。
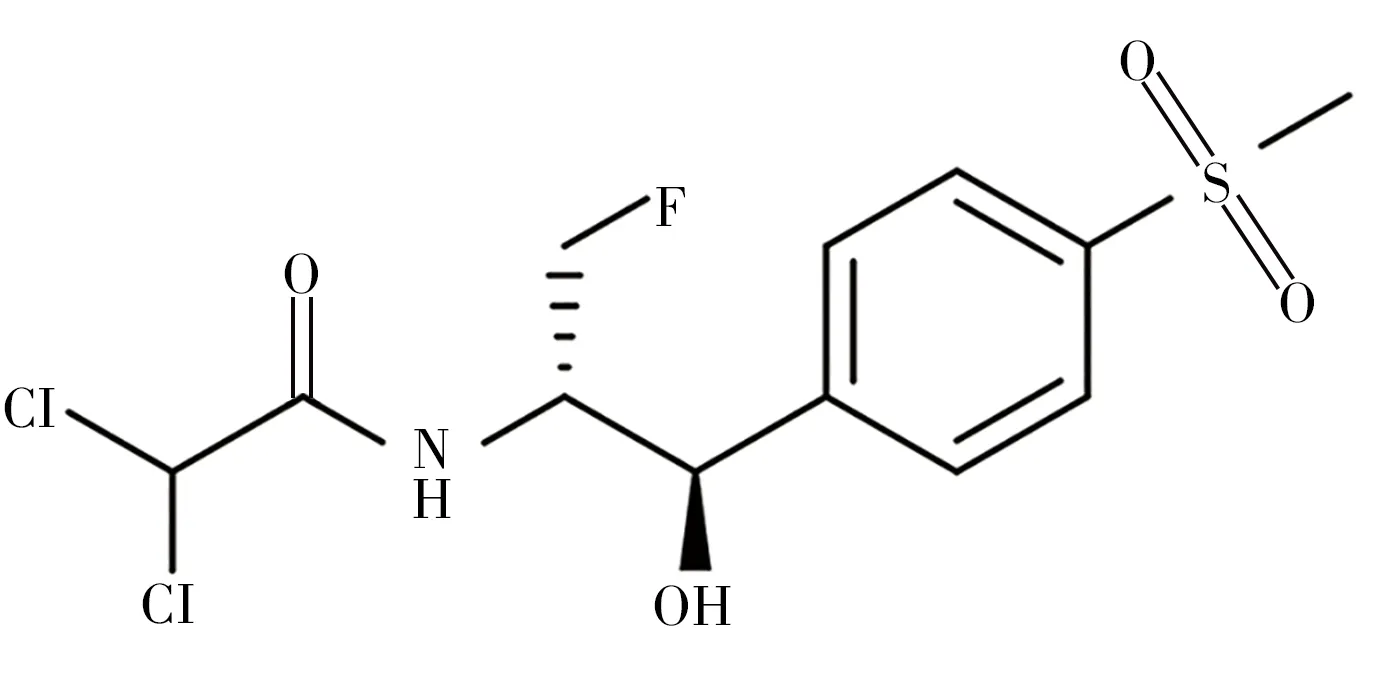
图1 氟苯尼考化学结构Fig.1 Chemical structure of florfenicol
目前,针对氟苯尼考残留的检测方法主要是仪器方法[7-9],这些方法灵敏度高、检测结果准确可靠,但是前处理要求高、操作专业性强,不能实现高通量现场筛查。免疫分析方法[10]具有低成本、高通量的优点,与大型仪器确证方法优势互补,显著提高了畜禽产品及饲料兽药残留的检测效率。近年来,食品中氟苯尼考残留的免疫分析方法有一定发展,但这些方法多数与同类的氯霉素有显著交叉反应[11-13]。而氯霉素为禁用兽药,氟苯尼考是限量兽药,两者的检测要求悬殊,其显著的交叉反应导致无法判别测定结果。孙法良等[14]建立的鸡肉中氟苯尼考残留检测的酶联免疫吸附分析方法与氯霉素等无显著交叉反应,但半抑制浓度(IC50)仅79.3 ng/mL,灵敏度并不十分理想。
本研究拟在前期基础上[15]筛选制备针对氟苯尼考的高特异性单克隆抗体,并建立灵敏准确的免疫分析方法,以期为食品安全监管提供技术支持。
1 实验部分
1.1 仪器与试剂
Multiskan MK3酶标仪(美国Thermo公司);EYELA旋转蒸发仪(上海爱郎仪器有限公司);氮吹仪(康宁科技有限公司);QP50质谱仪(日本岛津公司);DRX-600NMR核磁共振仪(德国瑞士Bruker公司);UV-3010紫外可见分光光度计(日本Hitachi公司)。
氟苯尼考、氯霉素、恩诺沙星等标准品(上海麦克林生化科技有限公司);牛血清白蛋白(BSA)、鸡卵清白蛋白(OVA)、N-羟基琥珀酰亚胺(NHS)、碳二亚胺(EDC)、Freund完全佐剂与不完全佐剂、辣根过氧化物酶(HRP)标记的羊抗鼠IgG抗体(美国Sigma公司);N,N-二甲基甲酰胺(上海阿拉丁试剂公司);T液为0.05 mol/L Tris-HCl缓冲液(pH8.0 );P液为0.025 mol/L磷酸缓冲液(pH7.5 );PBS为0.01 mol/L磷酸缓冲液(pH7.4 );PBST为0.01 mol/L含0.05 %吐温-20的磷酸缓冲液(pH7.4 );其它化学试剂均为国产分析纯。半抗原FFD为本实验室自制[15](图2);小鼠骨髓瘤SP2/0(本实验室保存);SPF级BALB/c雌性小鼠购于广东省医学实验动物中心(广东佛山)。
1.2 实验方法
1.2.1 人工抗原的制备与鉴定采用活泼酯法[16]将半抗原FFD(图2)分别与载体蛋白BSA和OVA偶联制备免疫原FFD-BSA和包被原FFD-OVA,并采用紫外扫描法和三硝基苯磺酸法(TNBS)对抗原进行鉴定和偶联比测算[17]。
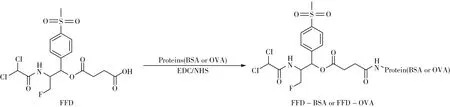
图2 抗原合成路线图Fig.2 Synthetic routes of antigens FFD-BSA and FFD-OVA
1.2.2 单克隆抗体的制备与评价参照文献[18],使用免疫原FFD-BSA平行免疫3只6~8周龄的雌性Balb/c小鼠,3免后对小鼠进行尾静脉取血,通过间接竞争酶联免疫吸附分析方法(icELISA)对抗血清性能进行评价,选用免疫应答最好的小鼠的脾脏与SP2/0进行融合[19-20],将筛选到的细胞株进行体外培养和腹水制备,经饱和硫酸铵沉淀法[21]分离纯化后保存至-20℃冰箱备用。采用酶联免疫吸附分析方法(ELISA)对抗体效价和抑制率进行测定评价。
1.2.3 icELISA方法的建立 参考文献[18],采用棋盘法选择A450nm在1.0 ~1.5 之间的包被原质量浓度(0.125 、0.083 、0.0625 、0.05 µg/mL)和抗体质量浓度(0.167 、0.125 、0.1 、0.083 µg/mL)组合进行抑制曲线绘制,并根据IC50确定最佳包被原质量浓度与抗体质量浓度;然后,采用单因素实验优化药物和抗体稀释液(PBST、T液、P液、PBS)、抗体稀释液吐温-20含量(0.05 %、0.1 %、0.2 %、0.5 %)、一抗竞争反应时间(20、30、40、50min)、酶标二抗稀释液(P液、T液、PBST、PBS)、初始质量浓度为1µg/mL的酶标二抗稀释倍数(4000、5000、6000、7000倍)、酶标二抗反应时间(20、30、40、50min)等影响因素。最佳反应条件应具备适当的吸光值(Amax)、较低的IC50和较高的Amax/IC50比值。Amax/IC50越高,IC50越低,即灵敏度越高,综合最佳反应条件建立氟苯尼考的icELISA标准曲线,其中,纵坐标B、B0分别表示添加和未添加氟苯尼考时的吸光度,横坐标为靶标药物质量浓度。
1.2.4 抗体的特异性以抗体对标准品靶标药物的IC50值为参照,采用以下公式测算结构及功能类似物的交叉反应率(CR):
CR(%)=[IC50(FF)/IC50(FF类似物)]×100%
1.2.5 稳定性试验精密度与稳定性是评价免疫检测试剂盒可靠性与应用性的重要参数。取不同时间包被的酶标板在同一时间进行icELISA实验,考察方法的精密度;同时将试剂盒置于37℃进行保存时间测试实验,在第0、2、4、6d各测定一次并绘制标准曲线,考察方法的稳定性。分别计算不同批次板和不同存放时间的IC50、Amax、IC20~IC80。
1.2.6 前处理及加标回收实验肉组织样品:称取3g打碎后的空白肉样于15mL离心管中,加入10mL乙酸乙酯和适量NaCl沉淀蛋白,振荡混匀5min后4000r/min离心5min,共提取2次。合并的上清液经氮气吹干后加入3mL PBS及3mL正己烷,混匀后4000r/min离心5min,PBS层备用。
饲料样品:称取空白动物饲料1g于15mL离心管中,加入10mL乙酸乙酯,混匀后于4℃下4000r/min离心10min,共提取2次。合并上清液经氮气吹干后加入1mL正己烷和1mL PBS,振荡混匀后4000r/min离心10min,PBS层备用。
根据所建立icELISA方法的灵敏度与样品处理情况,将上述制备的空白样品分别添加高、中、低3种浓度水平的氟苯尼考标准品,按照3孔平行,以icELISA进行测定,计算加标回收率及相对标准偏差(RSD)。
1.2.7 仪器确证方法比对采用中华人民共和国出入境检验检疫行业标准(SN/T1865-2016)[22]和农业部2483号公告-8-2016的HPLC-MS/MS方法[23],对样品中的氟苯尼考进行检测,并与icELISA方法结果进行确证比对。
2 结果与讨论
2.1 人工抗原制备与鉴定
载体蛋白和半抗原在紫外扫描下会表现出各自不同的特征吸收峰,半抗原成功偶联载体蛋白后,分子间通过共价键产生共轭与电子转移,导致峰形或峰位发生一定变化,基于此可判断人工抗原是否偶联成功[16]。UV-Vis图谱显示(图3),免疫原FFD-BSA的特征吸收峰变宽,且从BSA的280nm红移至287nm;包被原FFD-OVA的特征吸收峰也变宽,并从OVA的280nm红移至286nm,峰形及峰位与半抗原、载体蛋白区别明显。说明免疫原和包被原均合成成功。另外,用TNBS法测得标准载体蛋白BSA和OVA氨基消耗数量的标准曲线分别为y=0.1181 x(r2=0.9981 )和y=0.0516 x(r2=0.9913 ),经测算得到人工抗原FFD-BSA和FFD-OVA的偶联比分别为12∶1和17∶1。
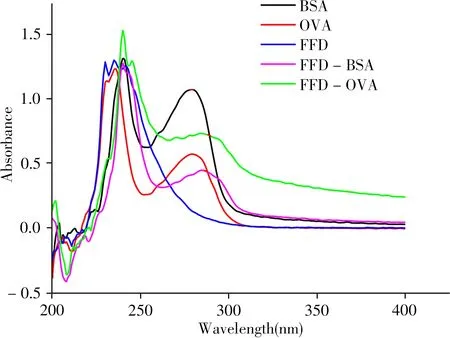
图3 半抗原、载体蛋白及人工抗原的紫外光谱Fig.3 Ultraviolet spectra of haptens,carrier protein and synthesized antigens
2.2 抗血清评价与单克隆抗体制备
第3次免疫后,检测鼠抗血清效价和抑制率[17]。结果显示,在1µg/mL包被原和1µg/mL氟苯尼考药物浓度下,3只平行实验小鼠抗血清的效价/抑制率分别为128k/74%、64k/75%和128k/70%。效价和抑制率越高,说明该抗血清的亲和力和识别氟苯尼考的灵敏度越好。因此,选取效价/抑制率为128k/74%的小鼠进行细胞融合。通过ELISA筛选,获得了细胞上清效价/抑制率为128k/92%的细胞株,并进一步通过细胞体外培养、腹水制备、纯化得到氟苯尼考单克隆抗体,用于后续实验。
2.3 标准曲线的建立
以Amax/IC50、IC50和Amax值作为考察依据[17],确定最佳工作条件为:包被抗原质量浓度为0.05 µg/mL,抗体质量浓度为0.1 µg/mL(稀释10000倍),最佳药物、抗体和二抗稀释液均为PBST,抗体稀释液的最佳吐温-20含量为0.05 %,竞争反应时间为30min,二抗质量浓度为0.167 µg/mL(稀释6000倍),二抗反应时间为30min。在该最佳条件下,建立氟苯尼考的icELISA标准曲线(图4),其对氟苯尼考的IC50为9.48 ng/mL,线性检测范围(IC20~IC80)为1.75 ~51.36 ng/mL,检 出 限(IC10,LOD)为0.64 ng/mL。
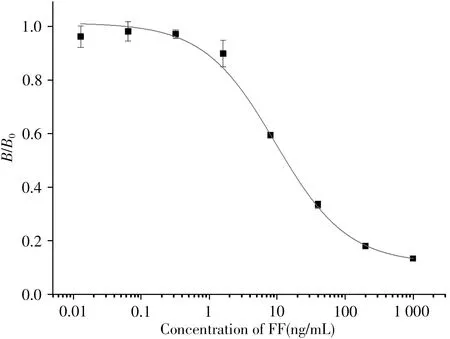
图4 氟苯尼考的icELISA标准曲线(n=3)Fig.4 Dose−response curve for florfenicol in icELISA(n=3)
2.4 特异性分析
测定抗体对类似物的交叉反应率(CR)可以评价抗体的特异性,CR越小说明抗体对靶标药物的特异性越高。实验结果表明,以氟苯尼考为参照,所建立的icELISA方法与氟苯尼考的CR为100%,与其它结构功能类似物氯霉素、氟苯尼考胺、恩诺沙星、西诺沙星、诺氟沙星、氧氟沙星、呋喃妥因、呋喃他酮、呋喃西林、四环素、磺胺二甲嘧啶基本不存在交叉反应,说明所建立的icELISA方法对氟苯尼考具有良好特异性。
2.5 精密度与稳定性
按照“1.2.5 ”考察icELISA方法的精密度和稳定性。结果表明,批次间IC50的平均值为5.19 ng/mL,Amax平均值为1.13 ,RSD<7.5 %;不同存放天数间的IC50平均值为5.25 ng/mL,Amax平均值为1.36 ,RSD<7.5 %。上述实验结果说明所建立的方法精密度和稳定性良好。
2.6 基质干扰效应消除
样品经“1.2.6 ”前处理后用PBST稀释适当倍数,以氟苯尼考做标准品进行icELISA测定并绘制标准曲线,考察基质效应消除情况。结果表明:猪肉、鸡饲料和猪饲料基质用PBST稀释5倍,牛肉、鸡肉基质用PBST稀释10倍后,基质条件下抑制曲线与氟苯尼考标准曲线均能基本重合,样品基质效应基本消除。
2.7 加标回收实验
选择猪肉、鸡肉、牛肉、鸡饲料和猪饲料5种阴性空白样品,添加高、中、低3个浓度水平,按“1.2.6”处理后将提取液稀释相应倍数,用icELISA方法和HPLC-MS/MS法分别检测其回收率。结果表明(表1):icELISA方法的加标回收率为88.1 %~107%,RSD<15%,与HPLC-MS/MS结果一致。说明建立的icELISA方法测定结果准确可靠。
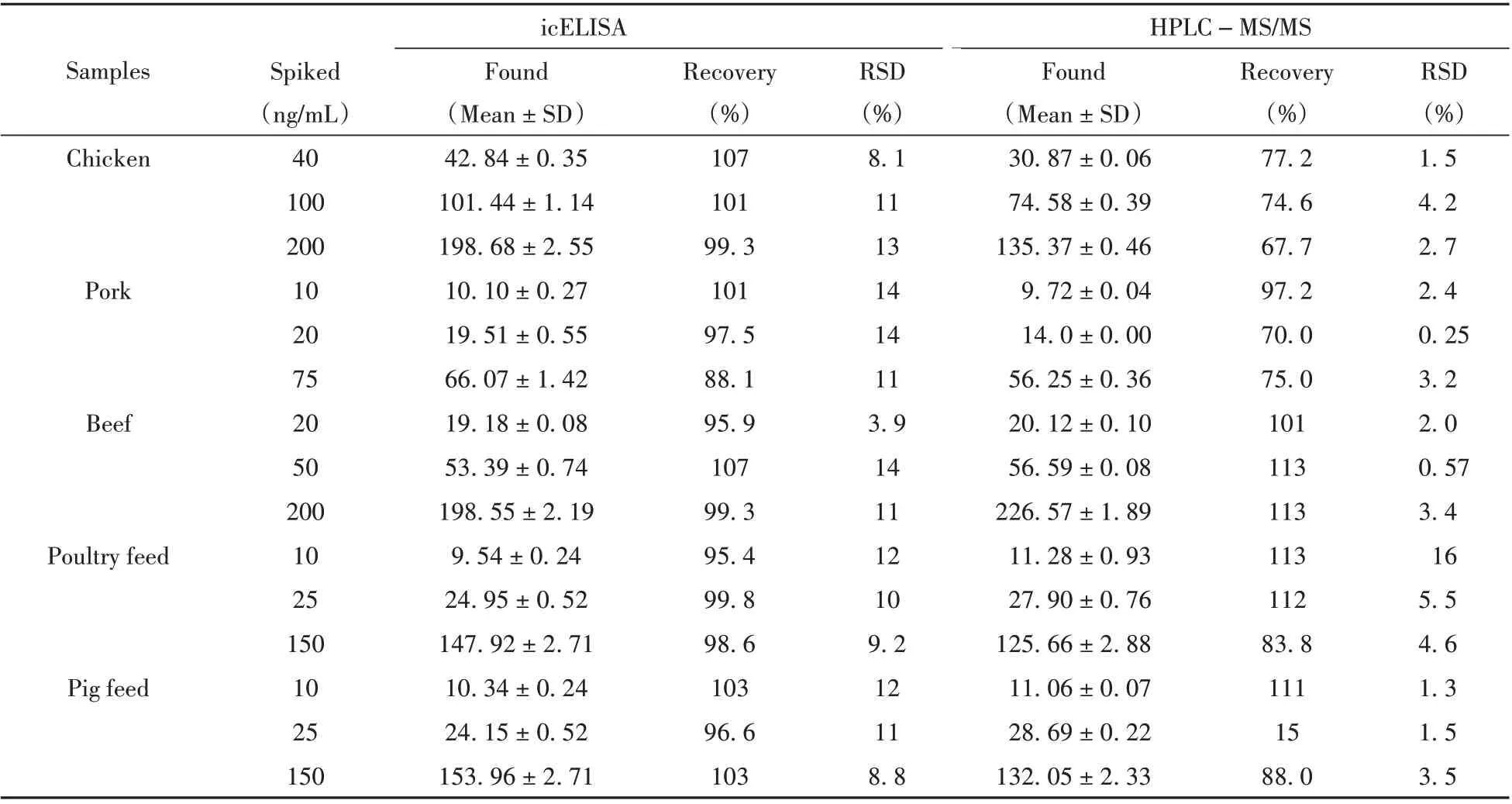
表1 氟苯尼考样品的加标回收率及相对标准偏差(n=3)Table1 Recoveries and RSDs of florfenicol in blank samples(n=3)
2.8 盲样检测
在当地超市及市场随机购买猪肉、鸡肉、牛肉、鸡饲料和猪饲料共15份样品,前处理后进行检测,其中4份检出氟苯尼考残留,但均低于50µg/kg,小于国家标准规定的最低限量值100µg/kg[5],因此均可判定为阴性。该结果与HPLC-MS/MS的测判结果一致,说明建立的icELISA方法可用于真实样品中氟苯尼考残留量的测定。
3 结 论
本研究基于特异性单克隆抗体,建立了畜禽肉及与饲料样品中氟苯尼考残留的icELISA检测方法,其检出限达0.64 ng/mL,且与其它结构功能类似物无明显交叉,特异性良好。样品的加标回收率为88.1 %~107%,与HPLC-MS/MS法检测结果一致,适用于动物源性食品及饲料中氟苯尼考的快速检测。

