溶胶-凝胶分子印迹CsPbBr3量子点的构建及其在胆固醇荧光检测中的应用
宋敏霞,管 杰,陈 璐,舒 韵,徐 琴,胡效亚
(扬州大学 化学 化工学院,江苏 扬州 225002)
胆固醇(CHO)是人和动物组织细胞中不可缺少的生物分子,然而大量医学调查研究表明,人体内的高CHO含量易引起动脉硬化等心血管疾病[1],因此准确、及时检测CHO具有十分重要的意义。目前检测CHO的常用方法中,色谱法[2]能实现复杂体系中胆固醇的测定,但需对样品进行前处理,仪器设备体积较大,价格较高,无法满足快速检测的需求;比色法[3]和电化学方法[4]相对简单,但需要利用胆固醇氧化酶提高其选择性,方法的重复性和稳定性受酶活性的限制。荧光法操作过程简便、响应快速、结果精确灵敏,是胆固醇测定的良好选择。近年来金属纳米颗粒、酶标CdSe/ZnS量子点(QDs)[5-6]等常被用作荧光检测的探针材料。但是,大多数探针存在荧光产率低、粒径分布广、稳定性差等不足[7-8]。因此,开发一种检测CHO的新型荧光探针材料极为必要。
区别于经典的Cd系量子点或碳量子点等,近几年发展起来的全无机卤化物钙钛矿量子点(CsPbX3QDs,X=Cl、Br、I)具备合成工艺简单、发射波长及带隙可调、荧光强度高、电荷转移快等优异特性,在太阳能电池、发光二极管、激光等光电领域得到了广泛应用[9-11]。然而,利用其荧光特性进行分析的文献报道较少,这是由于CsPbX3QDs在水或氧气存在下不稳定,缺乏选择性[12]。SiO2具有良好的光透明度,将CsPbX3QDs包覆于SiO2基质中已被证明是在保持CsPbX3QDs荧光性质的前提下,改善其稳定性的有效策略之一[13]。
选择性是制备荧光传感器时需要考虑的关键因素之一。虽然胆固醇氧化酶可被用来提高荧光探针的选择性,但是基于酶构建的传感器成本过高且容易失活[14]。分子印迹聚合物(MIPs)作为一种典型的仿生元件,具备较高的选择性,同时还具有成本低、制备简单、稳定性好等较多优点,已被广泛应用于多种样品的分析检测[15-16],将MIPs与包括荧光在内的传感技术相结合也逐渐成为当前的研究热点。
本工作将具有高选择性的MIPs和具备优异荧光性质的CsPbBr3QDs结合,以CsPbBr3QDs作为信号单元,四甲氧基硅烷(MTMOS)为交联剂,3-氨丙基三乙氧基硅烷(APTES)为功能单体,通过范德华力和氢键与模板分子CHO相互作用,在溶胶-凝胶过程将CHO引入到SiO2网络结构中,去除模板分子后形成能对CHO进行选择性识别的位点;同时将CsPbBr3QDs包封在形成的硅层网络结构中,提高了CsPbBr3QDs的稳定性,获得对模板分子CHO具有特异性识别能力的荧光传感平台(MIPs/CsPbBr3@SiO2QDs)。研究了合成的MIPs/CsPbBr3@SiO2QDs荧光传感器的结构组成、荧光性能和识别性能,并将其成功应用于脱脂奶粉中CHO浓度的测定。
1 实验部分
1.1 仪器与试剂
JEM-2100透射电子显微镜(日本日立公司);Tensor-27傅里叶变换红外光谱(美国布鲁克科技有限公司);FS-5荧光光谱仪(英国爱丁堡公司)。碳酸铯、乙酸乙酯、正己烷、甲苯(国药集团化学试剂有限公司);溴化铅(PbBr2)、辛胺(OAm)、3-氨丙基三乙氧基硅烷(APTES)、四甲氧基硅烷(MTMOS)、十八烯(ODE)、油酸(OA)、正硅酸乙酯(TEOS)(上海阿拉丁试剂有限公司);胆固醇、甘油三酯、尿酸、脂肪酸、人血清蛋白、葡萄糖(上海麦克林生化有限公司)。若无特殊说明,所用试剂均为分析纯,且未经进一步纯化;实验用水均为超纯水。
1.2 实验方法
1.2.1 CsPbBr3QDs及SiO2包封的CsPbBr3QDs(CsPbBr3@SiO2QDs)的合成 根据文献[17],通过典型的热注射法合成CsPbBr3QDs。SiO2包裹的CsPbBr3QDs颗粒合成步骤如下:将0.188 mmol PbBr2和5mL的ODE添加到三颈烧瓶中,在真空下通入N2除氧,温度控制在120℃搅拌1h,然后在N2保护下快速添加100µL的OAm、500µL的TEOS和100µL的OA。0.5 h后,反应温度由120℃升至170℃,快速加入700µL碳酸铯溶液(预热到100℃),并立即冰水浴制备QDs。随后,将反应暴露在空气中,搅拌30min生成对CsPbBr3QDs进行包裹的SiO2壳层。再用正己烷洗涤两次去除多余的溶剂,以9000r/min离心8min后烘干底物,得到CsPbBr3@SiO2QDs。最后,将CsPbBr3@SiO2QDs颗粒分散在10mL正己烷溶剂中保存。
1.2.2 MIPs/CsPbBr3@SiO2QDs的合成 将0.389 g CHO(1mmol)、0.90 mL(5mmol)APTES和10mL ODE在25℃下搅拌2h直至CHO与APTES混合均匀。然后加入100µL浓度为0.02 mol·L-1的CsPbBr3@SiO2QDs作为荧光载体,搅拌30min,加入100µL交联剂MTMOS,反应密封,室温下搅拌12h后停止反应,以9000r/min离心5min去除上清液并将反应物60℃烘干。称取20mg烘干后的固体颗粒分散至10mL由乙酸乙酯和正己烷组成的混合溶剂(体积比1∶3)中,超声洗涤以去除印迹聚合物中残留的CHO分子,直至荧光强度不再变化。将去除模板分子后的固体再次分散到洗脱液中,超声,用HPLC对洗脱液进行测定,未检测到CHO信号,表明CHO分子已被完全洗脱。将洗脱后的固体颗粒60℃烘干,即得到MIPs/CsPbBr3@SiO2QDs。在不添加CHO的情况下,用相同的方法和步骤合成了NIPs/CsPbBr3@SiO2QDs。
1.2.3 CHO检测称取20mg MIPs/CsPbBr3@SiO2QDs加入含有不同浓度CHO的乙酸乙酯溶液中,定容至10mL,识别30min后,取适量上述溶液加入石英比色皿(0.35 mL)中,设定激发波长450nm,发射波长515nm,狭缝半宽均为1.00 nm,用荧光分光光度计测量其荧光信号强度。
2 结果与讨论
2.1 材料的表征
利用透射电镜(TEM)表征了CsPbBr3QDs、CsPbBr3@SiO2QDs和MIPs/CsPbBr3@SiO2QDs的微观结构。图1A为合成的CsPbBr3QDs的透射电镜图,其平均直径约为7.9 nm,具有良好的分散性,颗粒表面光滑平整,大小基本一致。图1B是CsPbBr3@SiO2QDs的透射电镜图,以TEOS为前驱体并水解后,可在CsPbBr3QDs表面产生一层SiO2包裹层,将CsPbBr3QDs成功封装到TEOS水解生成的硅基质中,有效保护荧光量子点(CsPbBr3QDs)。图1C是MIPs/CsPbBr3@SiO2QDs的透射电镜图,可以看出,APTES中的氨基与CHO中的羟基通过氢键相互作用,在CHO的周围通过脱水与MTMOS以Si—O—Si键交联在一起并包围模板,呈现比较紧密的球形结构。
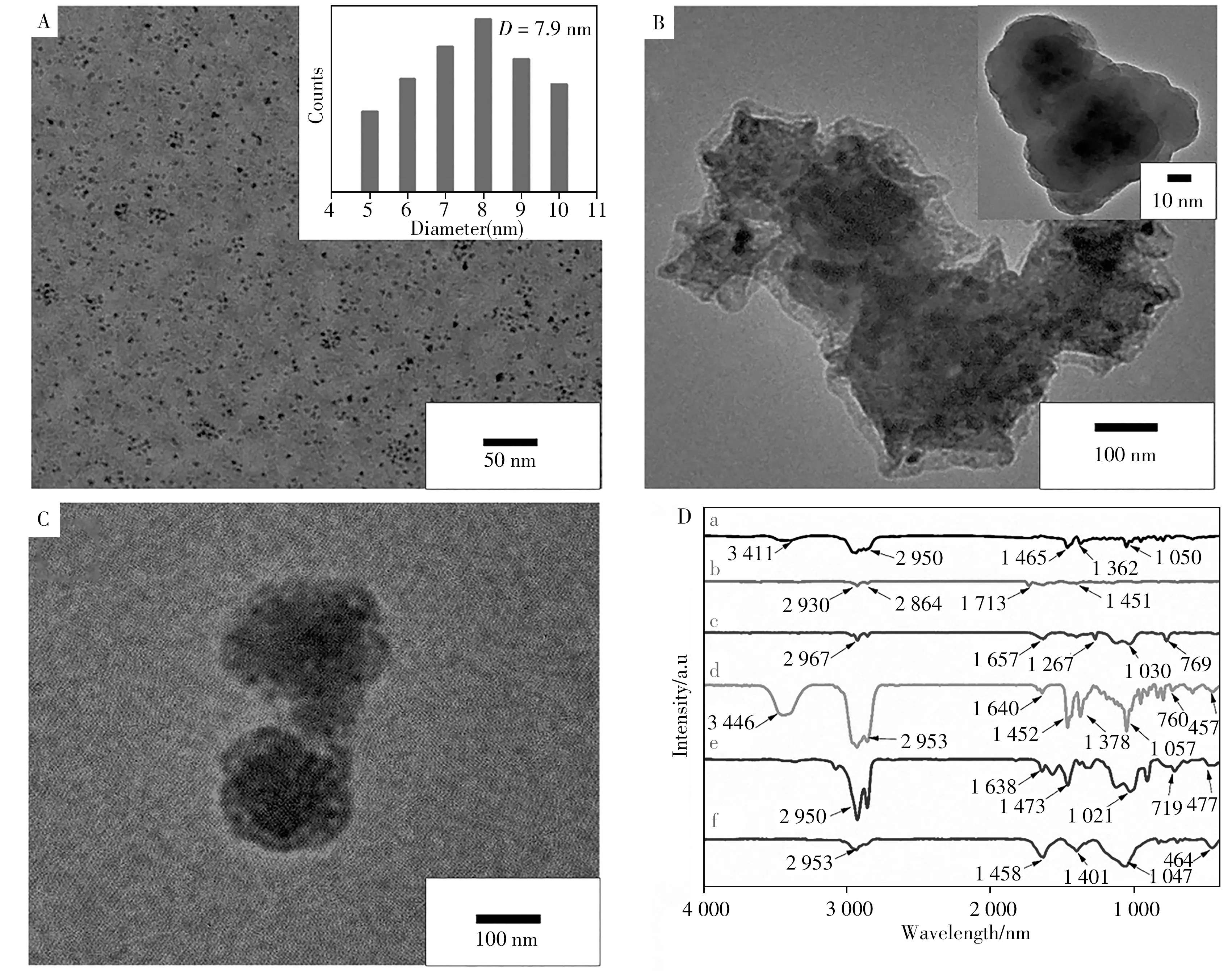
图1 CsPbBr3QDs(A)、CsPbBr3@SiO2QDs(B)和MIPs/CsPbBr3@SiO2QDs(C)的透射电镜图,以及CHO(a)、CsPbBr3QDs(b)、CsPbBr3@SiO2QDs(c)、MIPs/CsPbBr3@SiO2QDs洗脱前(d)后(e)、NIPs/CsPbBr3@SiO2QDs(f)的红外光谱(D)Fig.1 TEM images of CsPbBr3QDs(A),CsPbBr3@SiO2QDs(B)and MIPs/CsPbBr3@SiO2QDs(C),and FT-IR spectra(D)of CHO(a),CsPbBr3QDs(b),CsPbBr3@SiO2QDs(c),MIPs/CsPbBr3@SiO2QDs before(d)and after(e)elution,and NIPs/CsPbBr3@SiO2QDs(f)
图1D为CHO、CsPbBr3QDs、CsPbBr3@SiO2QDs、MIPs/CsPbBr3@SiO2QDs洗 脱 前 后 及NIPs/CsPbBr3@SiO2QDs的FT-IR光谱。CHO的FT-IR光谱(曲线a)图中,3411cm-1和2950cm-1分别对应CHO中—OH和C—H键的伸缩振动峰,1465cm-1和1362cm-1处为—CH2和—CH3的不对称变形振动峰,1050cm-1处为C—OH的伸缩振动峰[18]。CsPbBr3QDs(曲线b)在2930cm-1和2864cm-1处表现出长烷基链(—CH2—)的伸缩振动峰,1713cm−1和1451cm−1处分别为封端在CsPbBr3QDs表面的油酸和油胺的振动峰。CsPbBr3QDs@SiO2(曲线c)在1267cm-1和1030cm-1处的峰对应Si—O—Si键,769cm-1处对应Si—O键,这表明在TEOS水解缩合后形成了包裹在CsPbBr3QDs表面的硅层[19]。MIPs/CsPbBr3@SiO2QDs洗脱前(曲线d)在3446cm−1和2953cm−1处表现出CHO的—OH和C—H键特征峰,表明模板分子CHO成功印迹,1640cm-1和1452cm-1处对应功能单体APTES的—NH2键,1378cm-1和1057cm-1处对应Si—O—Si键的伸缩振动,760cm-1处为Si—O—Si键的面外变形振动,457cm-1处为Si—O—Si键的弯曲振动。通过比较曲线c和曲线d,可以发现Si—O—Si键的振动峰发生红移,这可能是由于CHO成功印迹后形成了氢键。曲线e表明MIPs/CsPbBr3@SiO2QDs洗脱后,3446cm-1处—OH的伸缩振动峰消失,其红外光谱类似于NIPs/CsPbBr3@SiO2QDs(曲线f),此外,2953cm-1处C—H键伸缩振动峰的信号也略有减弱,这些都表明模板分子CHO被有效去除。
2.2 MIPs/CsPbBr3@SiO2QDs用于CHO荧光检测的可行性
图2为不同条件下CsPbBr3@SiO2QDs的荧光光谱图。MIPs/CsPbBr3@SiO2QDs洗脱模板分子CHO前(曲线a)荧光强度最低,去除模板分子CHO后MIPs/CsPbBr3@SiO2QDs(曲线c)的荧光强度恢复,与NIPs/CsPbBr3@SiO2QDs(曲线d)的荧光强度相当,说明该模板分子从印迹薄膜中基本洗脱完全并形成对CHO具有特异识别能力的位点。当MIPs/CsPbBr3@SiO2QDs识别CHO后,CsPbBr3@SiO2QDs的荧光强度再次下降(曲线b),说明CHO对MIPs/CsPbBr3@SiO2QDs的荧光发射具有明显的猝灭作用,表明CHO占据了结合位点,形成空间位阻,影响了量子点的荧光效率。综上表明MIPs/CsPbBr3@SiO2QDs对CHO具有良好的特异性识别能力,能用于CHO的识别测定。
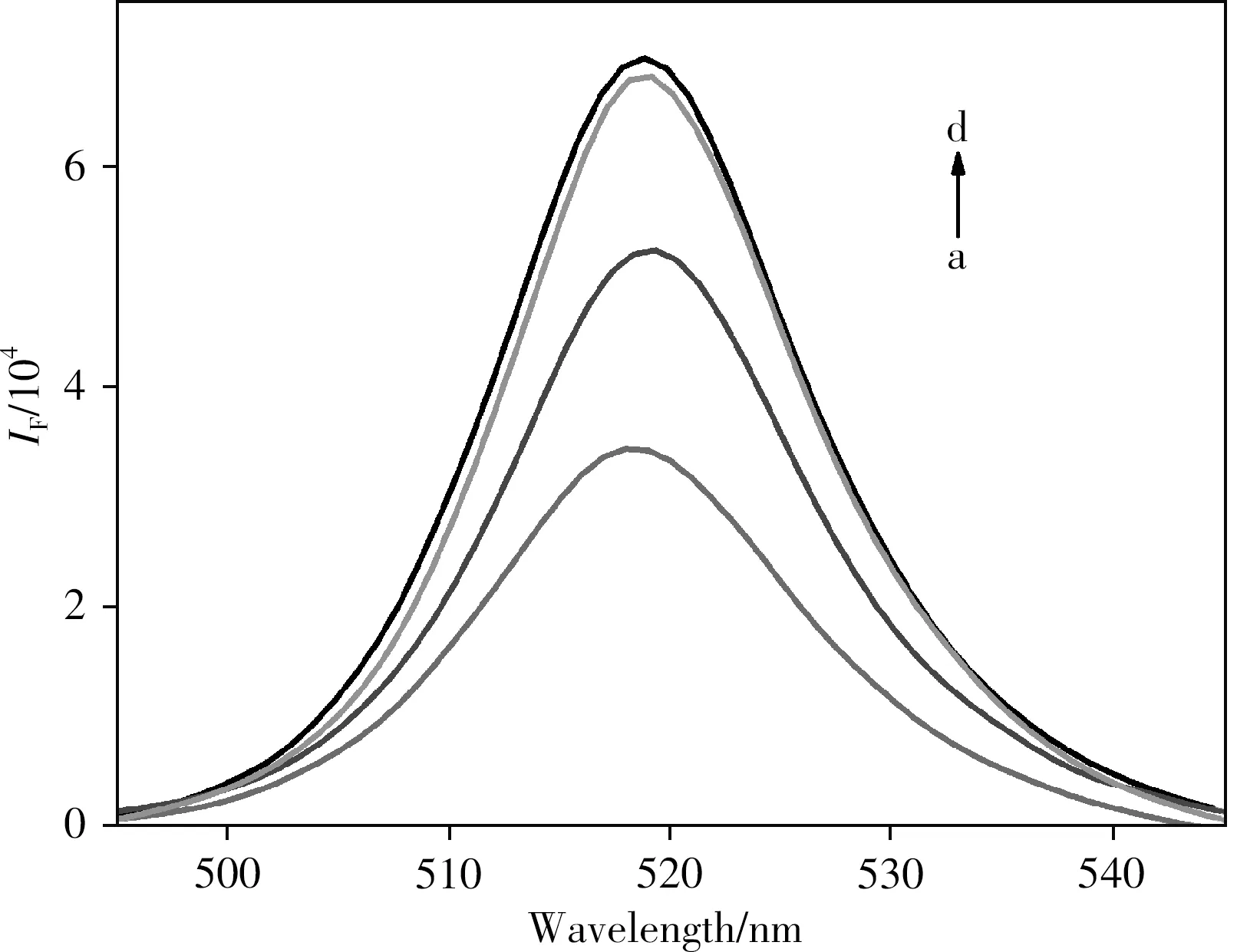
图2 MIPs/CsPbBr3@SiO2QDs洗脱前(a)、在含有1.00 ×10-10mol·L-1CHO的乙酸乙酯溶液中识别30min后的MIPs/CsPbBr3@SiO2QDs(b)、去除模板分子CHO后的MIPs/CsPbBr3@SiO2QDs(c)和NIPs/CsPbBr3@SiO2QDs(d)的荧光光谱图Fig.2 Fluorescence spectra of MIPs/CsPbBr3@SiO2QDs before removing the template(a),MIPs/CsPbBr3@SiO2QDs incubated in ethyl acetate solution containing1.00 ×10-10mol·L-1CHO for30min(b),MIPs/CsPbBr3@SiO2QDs after removing the template(c)and NIPs/CsPbBr3@SiO2QDs(d)
2.3 MIPs/CsPbBr3@SiO2QDs荧光传感器对CHO的检测性能
利用所制备的MIPs/CsPbBr3@SiO2QDs荧光传感器检测不同浓度的CHO。图3A显示随着CHO浓度的增加,MIPs/CsPbBr3@SiO2QDs的荧光强度逐渐降低。图3B曲线a表明:在1.00 ×10-11~5.00 ×10-8mol·L-1CHO浓度范围内,MIPs/CsPbBr3@SiO2QDs的荧光猝灭效率((IF0-IF)/IF)随CHO浓度对数(lgc)的增加呈线性减小,其线性方程为:(IF0-IF)/IF=-0.0371 +0.2352 lgc(mol/L),r2=0.9937 ,检出限(LOD,由3σ/k计算所得,其中σ为空白样品5次测定的标准偏差,k为分析标准曲线的斜率)为2.48 ×10-12mol·L-1。表1对比了用于CHO检测的不同分子印迹传感器的线性范围和检出限,表明MIPs/CsPbBr3@SiO2QDs荧光传感器具有检测线性范围宽、检出限低等特点。印迹效率是衡量分子印迹传感器的一个重要指标,印迹因子(Imprinting factor,IF=KSV,MIP/KSV,NIP)被用于评价印迹效率(KSV,MIP和KSV,NIP分别代表MIP和NIP传感器标准曲线的斜率[20])。一般IF>1,IF越大,选择性越好,印迹效果越好。图3B曲线b表明,NIPs/CsPbBr3@SiO2QDs的线性方程为:(IF0-IF)/IF=0.0113 +0.0198 lgc(mol/L),r2=0.9912 。对于所制备的MIPs/CsPbBr3@SiO2QDs荧光传感器,其印迹因子约为11.88,这可能与MIPs/CsPbBr3@SiO2QDs具有特异性识别位点,对CHO的亲和力高于NIPs/CsPbBr3@SiO2QDs有关。
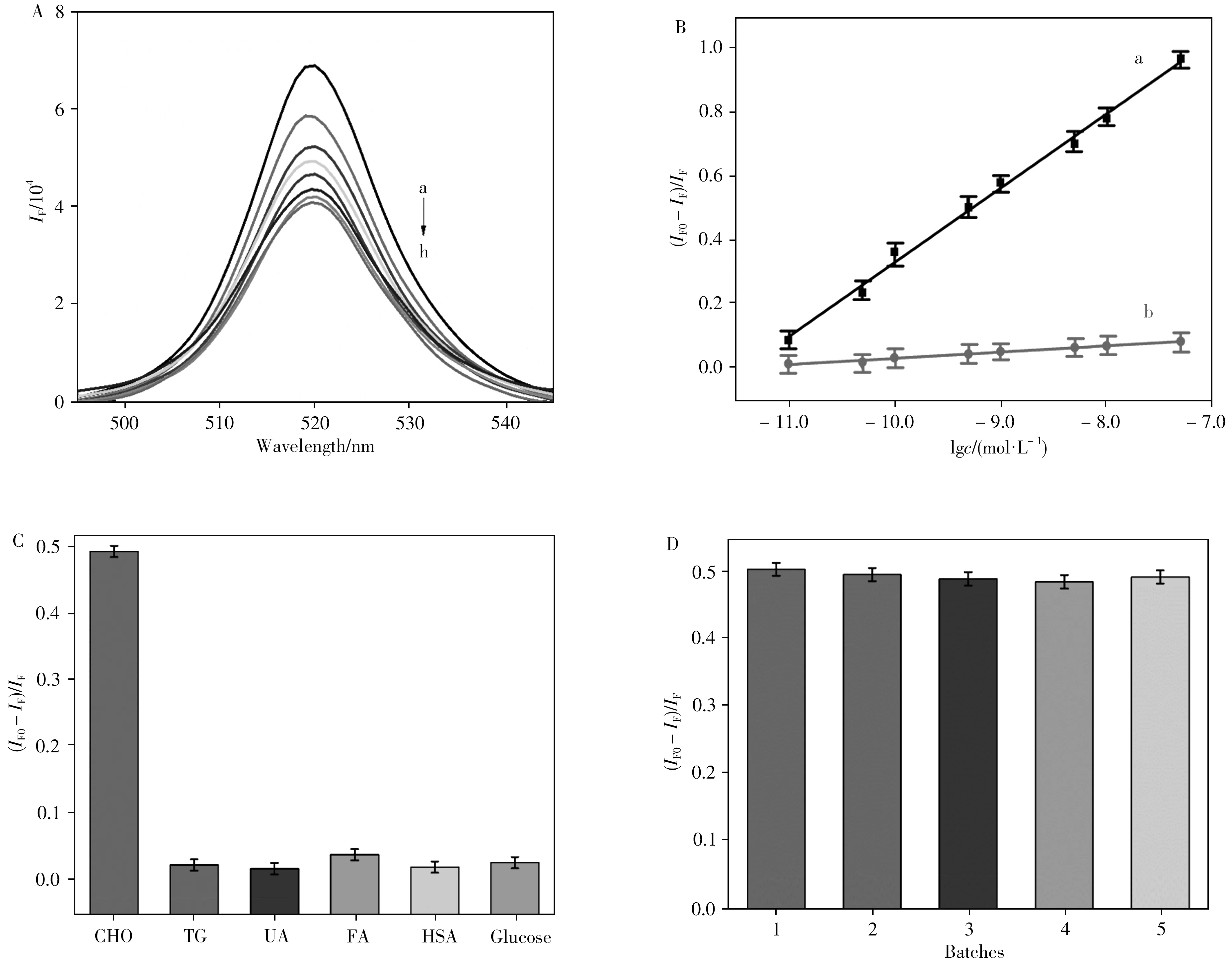
图3 CHO浓度对MIPs/CsPbBr3@SiO2QDs荧光光谱的影响(A),MIPs/CsPbBr3@SiO2QDs(曲线a)与NIPs/CsPbBr3@SiO2 QDs(曲线b)的线性校准曲线(B),MIPs/CsPbBr3@SiO2QDs荧光传感器对CHO的选择性及干扰(C),MIPs/CsPbBr3@SiO2 QDs荧光传感器的重现性(D)Fig.3 Effect of CHO concentration on the fluorescence spectra of MIPs/CsPbBr3@SiO2QDs(A),linear calibration curves for MIPs/CsPbBr3@SiO2QDs(curve a)and NIPs/CsPbBr3@SiO2QDs(curve b)(B),selectivity of MIPs/CsPbBr3@SiO2QDs fluorescence sensor to CHO and the interferences(C),reproducibility of MIPs/CsPbBr3@SiO2QDs fluorescence sensor(D)a-h:1.00 ×10-11-5.00 ×10-8mol·L-1

表1 MIPs/CsPbBr3@SiO2QDs荧光传感器与文献报道分子印迹传感器性能的比较Table1 Comparison of the performance of MIPs/CsPbBr3@SiO2QDs fluorescence sensor and the molecule-imprinted sensor reported in the literature
通过检测MIPs/CsPbBr3@SiO2QDs荧光传感器在甘油三酯(TG)、尿酸(UA)、脂肪酸(FA)、人血清白蛋白(HSA)和葡萄糖(Glucose)等物质存在下的荧光猝灭效率,研究了MIPs/CsPbBr3@SiO2QDs荧光传感器对CHO的选择性。图3C表明10倍浓度干扰物对1.00 ×10-10mol·L-1CHO的测定基本不产生影响,这主要是因为MIPs上特定形状的印迹空腔和分布的官能团可以选择性地识别CHO,从而降低了其他物质的干扰。
在相同实验条件下,通过检测5个独立研制的传感器在不同时间对CHO的荧光响应结果,研究了荧光传感器的重现性,并对每个批次进行3次重复测试。如图3D所示,结果表明荧光传感器具有良好的重现性,相对标准偏差(RSD)小于3.3%。
2.4 荧光传感器的检测机理
在检测过程中,模板分子CHO通过氢键与功能单体APTES提供的官能团氨基(—NH2)作用后,被MIPs/CsPbBr3@SiO2QDs的SiO2壳层上的印迹位点所捕获,形成空间位阻,影响荧光信号单元(CsPbBr3QDs)的发射和电子转移,导致荧光猝灭[22]。在450nm激发波长下,IF0/IF与CHO浓度的线性关系符合Stern-Volmer方程:IF0/IF=1+KSV[Q][23],其中[Q]为CHO的浓度。根据该方程计算出Stern-Volmer的猝灭常数(KSV)为7.12 ×108L/mol,较高的猝灭常数进一步证明非荧光物质CHO在疏水性CsPbBr3@SiO2QDs上的强吸附导致了荧光猝灭。
2.5 实际样品测定
进一步研究了MIPs/CsPbBr3@SiO2QDs荧光传感器用于实际样品分析的可行性和准确性。以市售脱脂奶粉为实际样品,称取0.50 g市售脱脂奶粉,加入10mL乙酸乙酯,以3000r/min的转速离心15min后,将上清液以0.45 µm滤膜过滤,取10µL滤液加入10mL乙酸乙酯中用于CHO含量测定,并将测定结果与国标GB5009.128-2016[24]的测定结果进行对比。对脱脂奶粉样品进行3个浓度的加标回收实验,其回收率为88.0 %~97.4 %(表2),证明所制备的MIPs/CsPbBr3@SiO2QDs荧光传感器具有良好的可行性。
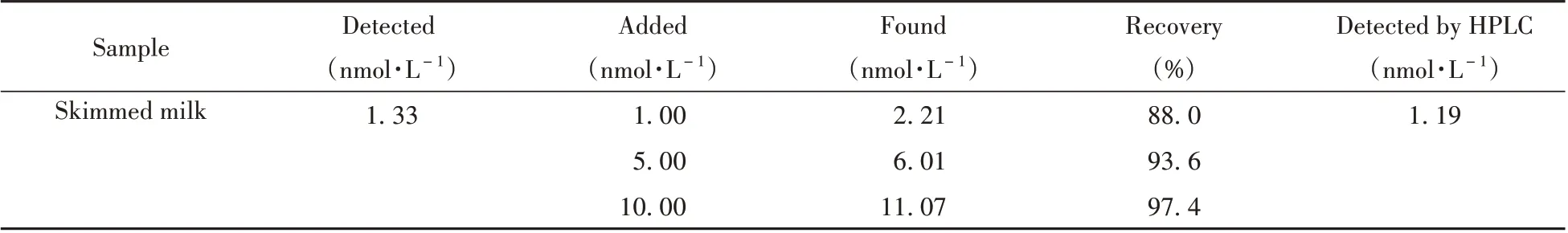
表2 MIPs/CsPbBr3@SiO2QDs荧光传感器对脱脂奶粉中CHO的检测(n=5)Table2 Detection of CHO in skimmed milk samples by MIPs/CsPbBr3@SiO2QDs fluorescence sensor(n=5)
3 结 论
本研究以CsPbBr3QDs为荧光探针,并基于溶胶-凝胶分子印迹技术将其包裹在SiO2基质中提高稳定性及赋予其识别性能,构建了MIPs/CsPbBr3@SiO2QDs荧光传感器。研究了该传感器对CHO测定的可行性。实验结果表明该传感器对CHO具有良好的选择性,并成功应用于脱脂奶粉中CHO含量的测定。该荧光传感平台还可扩展用于其他物质的分析检测,相关研究结果拓宽了全无机钙钛矿量子点材料在生物传感领域的应用。

