一种香豆素pH荧光染料的开发及应用
姜雪琴,刘 礼,李 昊,何阳森,吕沐瀚,吴建明,梁思成,詹会智,齐晓怡
(1.西南医科大学 药学院,四川 泸州 646000;2.西南医科大学附属医院 消化内科,四川 泸州 646000;3.西南医科大学附属医院 皮肤科,四川 泸州 646000;4.西南医科大学附属医院 胸外科,四川 泸州 646000)
荧光染料具有良好的发光特性,被广泛运用于生物学研究以及疾病诊疗,例如,蛋白标记、核酸检测、免疫分析以及水质污染物的监测等。细胞内pH值的变化与肿瘤、神经系统疾病的发生密切相关[1]。近年来,基于不同荧光团的pH荧光探针(如姜黄素、半花菁、萘等)已有报道[2-4]。但这些探针存在选择性较差、Stokes位移小等缺点,导致实际样品检测困难[5-7]。
香豆素类化合物是一种以苯并吡喃酮结构为骨架,具有光学特性突出、生物相容性好等优点的化合物,在荧光增白剂[8]、荧光染料[9]和非线性光学材料中应用广泛[10]。据报道,在香豆素3位引入苯并咪唑杂环,能增加分子内共轭体系的稳定性,使发射波长红移、荧光强度增强[11]。而对于细胞内pH值的检测,7-羟基香豆素(pKa=7.50 )可能为优选结构[12]。结合羟基香豆素和苯并咪唑结构特点,本研究组前期设计合成的一种新型pH探针(3-苯并咪唑-7-羟基香豆素)在pH6.50 ~8.30 范围内具有良好的线性(pKa=7.20 ),可作为一种优良的荧光探针,选择性地感知线粒体pH值的变化[13]。但需要指出的是,线粒体偏弱碱性,其pH值与细胞功能密切相关,线粒体自噬和细胞凋亡通常与线粒体酸化有关。例如,与野生型胶质细胞相比,帕金森病的胶质细胞中线粒体的pH值偏酸性[14]。基于此,本小组对3-苯并咪唑-7-羟基香豆素进一步改造:根据分子内电荷转移(ICT)原理在苯并咪唑基团上引入甲氧基基团,增加电子云密度,降低吸电子能力;同时通过改变体系中分子电荷的转移能力,使探针激发态比基态更具极性。ICT感应探头羟基对pH值具有高敏感性,可观察到荧光探针发生红移现象[15-16]。本研究合成了一种对pH值敏感的香豆素荧光染料3-(6-甲氧基-1H-苯并咪唑)-7-羟基香豆素(BC),通过荧光和紫外−可见吸收光谱、pKa、探针稳定性和选择性以及荧光成像实验,明确了探针的荧光属性,并利用密度泛函理论计算研究了探针的香豆素羰基和苯并咪唑基是否存在激发态分子内质子转移(ESIPT)过程,为生物医学研究和应用奠定了坚实的实验基础。
1 实验部分
1.1 仪器与试剂
质谱测定采用X500R QTOF-SCIEX高分辨质谱仪(美国SCIEX公司),在Bruker AMX-400(德国BRUKER公司)上获得1H NMR(400MHz)和13C NMR(100MHz)光谱;18.2 MΩ·cm超纯水采用Milli-Q超纯水仪(美国MILLIPORE公司)制备;pH值测定使用PHS-3E型精密pH计(中国上海INESA公司);荧光和紫外-可见吸收光谱测定采用Cytation3细胞成像多功能微孔板检测仪(美国BIOTEK公司);细胞成像实验所用仪器为尼康Ts2R-LS显微镜(北京SUNJOY公司)。
2,4-二羟基苯甲醛、氰乙酸乙酯、4-甲苯-1,2-二胺、苯甲酸以及各种金属离子硝酸盐购于中国成都科隆化学品有限公司,氨基酸购于成都润泽本土化工有限公司;丁醇购于广州文度科学仪器有限公司;乙醇购于上海吉至生化科技有限公司。以上所用试剂均为分析纯,如无特殊说明未进一步纯化。
1.2 探针BC的合成与表征
将2,4-二羟基苯甲醛(0.56 g,4.0 mmol)、氰乙酸乙酯(0.56 g,5.0 mmol),4-甲苯-1,2-二胺(0.16 g,1.3 mmol)和苯甲酸(0.05 g,0.44 mmol)的混合物分别溶于10mL丁醇中,回流约12h,所得混合物室温下冷却,过滤并收集沉淀。沉淀经乙醇再结晶,得到深黄色到浅棕色的固体化合物(BC),真空干燥,得到BC0.37 g,得率98.4 %。BC的1H NMR数据为:1H NMR(400MHz,DMSO):δ12.35(s,1H),8.98 (s,1H),8.36 (s,1H),7.83 ~7.81 (d,J=8Hz,1H),7.55 ~7.53 (d,J=8Hz,1H),7.17 ~7.16 (d,J=4Hz,1H),6.92 ~6.85 (m,3H),3.80 (s,1H);BC的13C NMR数据(ppm):163.2 、161.8 、160.3 、156.2 、146.7 、143.4 、143.2 、135.1 、131.5 、118.6 、115.2 、113.7 、112.2 、112.1 、108.2 、102.3 、55.8 。HR-MS(ESI)正离子模式下测定化合物(C17H13N2O4+)分子量为309.0805 ,接近理论值309.0813 。荧光探针BC的合成路线如图1所示。
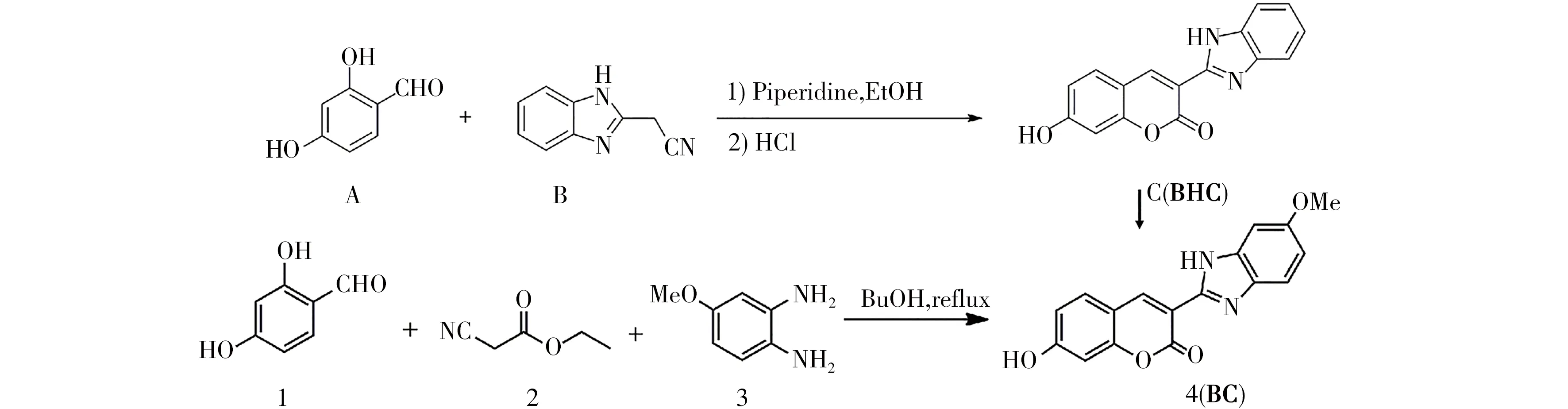
图1 3-苯并咪唑-7-羟基香豆素(BHC)和3-(6-甲氧基-1H-苯并咪唑)-7-羟基香豆素(BC)的合成Fig.1 Synthesis of3-benzimidazole-7-hydroxycoumarin(BHC)and3-(6-methoxy-1H-benzimidazole)-7-hydroxycoumarin(BC)
1.3 BC溶液的制备与检测
将化合物BC溶解于二甲基亚砜(DMSO),超声处理5min后,配制成探针储液(20mmol/L),临用前稀释成工作溶液。pH值滴定实验中,采用Britton-Robinson(B-R)缓冲液(由40mmol/L的磷酸、硼酸和醋酸混合而成,实际pH值通过加入一定量的0.2 mol/L氢氧化钠或盐酸进行调节)将BC储液稀释至10µmol/L。此外,所有实验均在含1% DMSO溶液的条件下进行,测定前将稀释的BC储液平衡5min。吸收光谱和荧光光谱在室温下进行测定,且激发波长(λex)为420nm,发射波长(λem)为490nm,狭缝宽度设置为5nm。
1.4 HeLa细胞的培养与成像研究
以HeLa细胞(细胞株由西南医科大学药剂实验室赠送)为模型,将细胞培养于含10%胎牛血清(FBS)和1%青霉素/链霉素(100U/mL)的改良培养基(DMEM)中,在含5% CO2的37℃培养箱中培养。
细胞毒性实验:将细胞接种于96孔板中,24h后加入不同浓度的BC,继续培养24h后弃去培养基,加入CCK-8检测试剂孵育1h。待指定时间和温度时,使用酶标仪在450nm波长处测定其吸收值,计算得到BC在不同浓度下的细胞活性值。
细胞成像实验:将细胞以1.5 ×105个细胞/孔的密度接种在直径为20mm的圆形玻璃培养皿中,置于含5%CO2的37℃培养箱中培养过夜,弃去培养液后加入含BC的新鲜培养液培养,继续培养一定时间后弃去培养基并用PBS(pH7.4)清洗细胞3次,采用荧光成像显微镜观察拍照。
1.5 密度泛函理论计算
为了研究化合物BC的香豆素羰基和苯并咪唑基是否存在ESIPT过程,基于已有报道[17],借助Gaussian09软件,使用6-31G的B3LYP交换泛函,对其进行密度泛函理论(DFT)计算。优化后的结构满足局部能量最小。
2 结果与讨论
2.1 BC的荧光性质
2.1.1 荧光光谱及紫外-可见吸收光谱香豆素本身无荧光,通过在香豆素环上引入基团可构建推-拉电子体系,如在母核上引入甲氧基-苯并咪唑杂环会改变咪唑环电子云密度,导致其发射波长红移,荧光强度增强。从BC随pH值变化的紫外−可见吸收光谱(图2A)和荧光光谱(图2B)可以看出,BC的最大紫外吸收峰和发射峰分别在420nm和490nm处最明显;在pH10.0 的碱性条件下,BC的最大吸收波长(λabs)位于420nm,发射波长位于490nm;随着pH值的降低,420nm处的吸收峰和490nm处的发射峰明显降低,且在pH5.5 时达到最低,几乎观察不到吸收峰和荧光发射峰。值得注意的是,在pH值由5.5 升至10.0 的过程中,荧光强度增强了15倍。此外,在偏碱性条件下,Stokes位移明显增加。说明BC对pH值的变化敏感,有望进一步应用于生物体内pH值的变化监测。
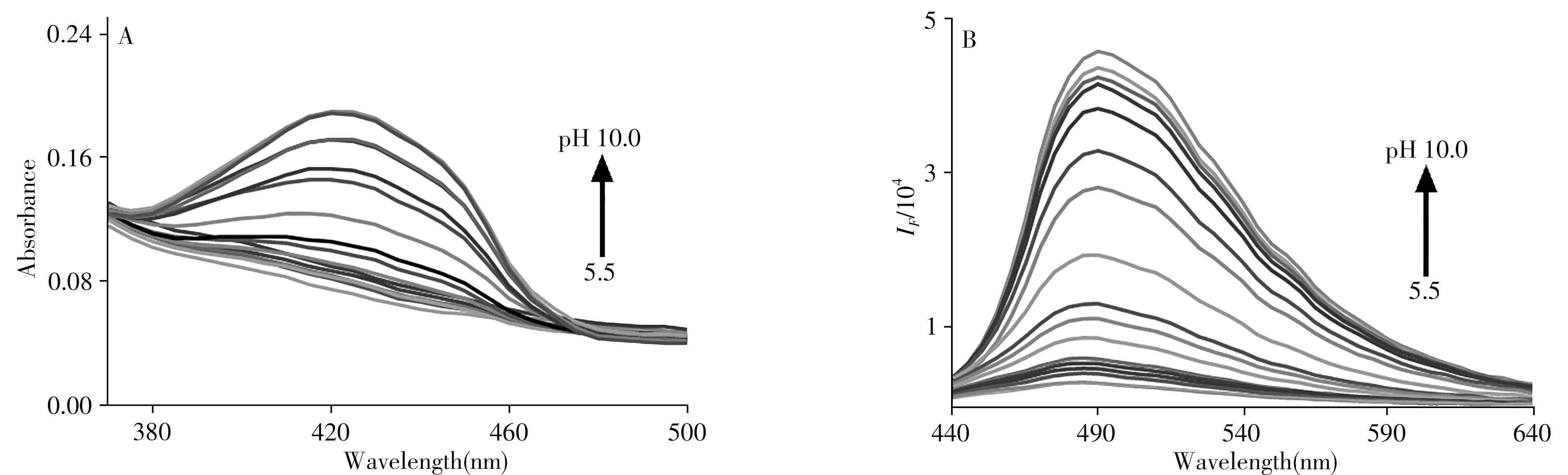
图2 BC(10µmol/L)在B-R缓冲溶液中的紫外-可见吸收光谱(A)和荧光光谱(B)Fig.2 UV-Vis absorption spectra(A)and fluorescence spectra(B)of BC(10µmol/L)in B-R buffer solution
2.1.2 pKa的测定线粒体基质的pH值呈现碱性(~8.0 ),其pH值的轻微改变将严重影响生理机能,关键官能团pKa的测定是研究探针pH值依赖行为的关键。目前已开发出一些pKa呈弱碱性的荧光探针[18-19]用于线粒体pH值的监测。
本研究测定了探针在pH5.5 ~10.0 ,激发波长为420nm,发射波长为490nm处的荧光强度。如图3A所示,对探针在λem=490nm处的荧光强度进行Sigmoidal曲线拟合,并绘制校正曲线。结果显示,该探针的pKa值为8.36 ,相关系数(r2)为0.9815 。这一良好的线性关系表明荧光探针的pKa与pH值范围能很好地匹配,且该探针在pKa附近有可用的、良好的pH值响应范围(pH7.8 ~9.0 )。
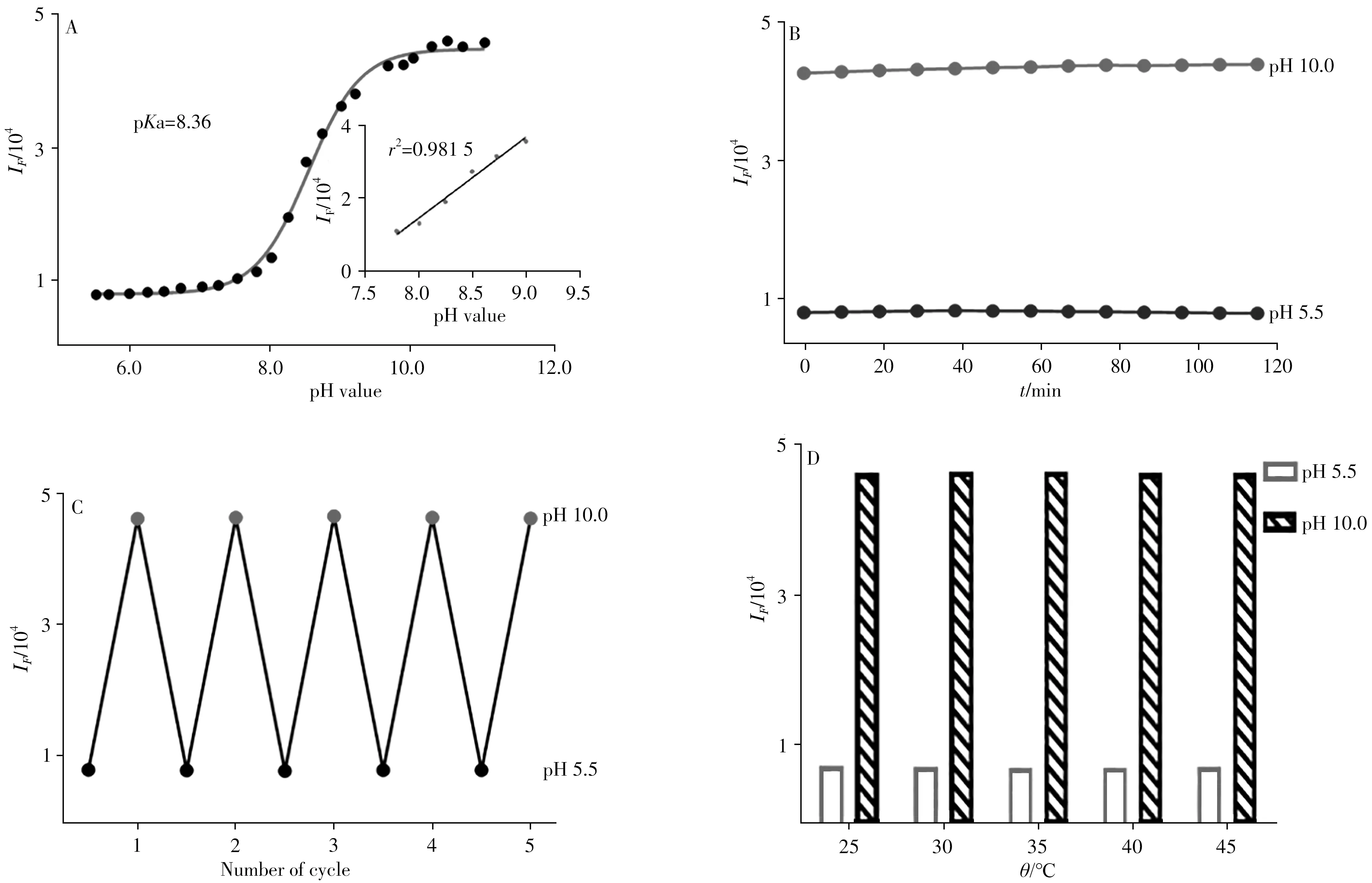
图3 BC(10µmol/L)荧光强度随pH值变化的Sigmoidal拟合曲线(A),BC在pH5.5 和pH10.0 B-R缓冲液中的稳定性(B)、可逆荧光变化(C)以及温度的影响(D)Fig.3 Sigmoidal fitting of the fluorescence intensity for10µmol/L BC(A),as well as stability(B),reversible fluorescence changes(C)of BC in B-R buffer solutions at pH5.5 and pH10.0 ,and effect of temperature(D)
2.1.3 光学稳定性与可逆性研究本研究通过监测探针2h内荧光强度随时间的变化测定了BC的光学稳定性。由图3B可知,随着反应时间的增加,检测体系的荧光信号在pH5.5 和pH10.0 时基本稳定,表明该探针的荧光强度不易受外界溶液的干扰。探针的可逆性也是实际应用中的另一个重要因素,进一步监测了pH5.5 和pH10.0 时荧光强度的动态变化。图3C显示,在5个循环中,探针BC在490nm发射波长处的荧光强度无明显变化。因此,BC的荧光强度随时间和pH值波动的变化可以忽略不计,进一步说明该探针是应用于生物样品荧光强度监测的良好选择。
2.1.4 温度的影响在实际的样本检测中,环境温度可能会影响探针荧光强度。为了进一步研究不同温度对荧光强度稳定性的影响,测定了BC在25~45℃范围内的荧光强度。如图3D所示,荧光强度在pH5.5 和pH10.0 时趋于稳定,表明该探针在上述温度范围内不受影响,且反应可在环境温度下进行。
2.1.5 选择性研究荧光探针可能受到实际生物样品中存在的各种金属离子或氨基酸的干扰,而良好的选择性是荧光探针的一个极其重要的特性[20]。本研究通过检测探针在最大发射波长(490nm)处的荧光强度评估其选择性。从图4可以看出,pH5.5 和pH10.0 时,金属离子(K+、Na+、Ca2+、Fe3+等)、硫醇(GSH、Cys、Hcy)、氨基酸(Tyr、Lys、Glu等)在生理浓度时对BC的荧光强度几乎无影响,表明该探针对金属离子和氨基酸具有较好的抗干扰能力。
2.2 细胞活性及荧光成像
为了进一步确定探针在生物体内的应用潜质,首先采用CCK-8法检测了BC在HeLa细胞中的体外细胞毒性。研究表明,随着探针浓度的增加,细胞的活性趋于降低,但BC浓度低于60µmol/L时,细胞的存活率能达到80%以上。因此,根据细胞毒性实验结果,选择20µmol/L和40µmol/L的BC浓度用于HeLa细胞荧光成像。从图5中可以清晰看到蓝色荧光发射分散在细胞质上,随着BC浓度和时间的增加,荧光发射明显增强,且40µmol/L BC在孵育细胞80min时荧光强度达到最强,较20µmol/L BC在孵育细胞80min时的荧光强度提升了近3倍。结果表明该探针可成功运用于HeLa细胞标记,且培养浓度和时间会影响BC的荧光强度。因此,该香豆素有望成为表征生物体内pH值变化的荧光染料。
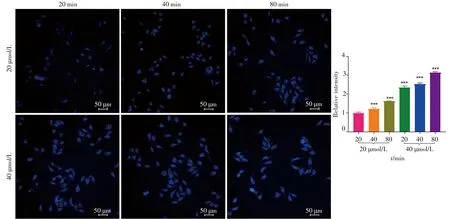
图5 BC在不同时间和浓度下的荧光成像Fig.5 Fluorescence imagings of BC at different times and concentrations
2.3 BC对pH值敏感的机制
为确定化合物BC的香豆素羰基和苯并咪唑基是否存在ESIPT过程,使用密度泛函理论考察香豆素羰基和苯并咪唑基间氢键的影响。图6结果显示,氢键的形成对电子云密度无影响。此外,根据文献报道,在香豆素上引入苯并咪唑基团可以驱动分子内电荷转移(ICT)[21-24]。基于此,认为化合物BC对pH值敏感以ICT为主。

图6 BC的HOMO-LUMO带隙Fig.6 HOMO-LUMO band gap of BC
3 结 论
本研究合成了一种以香豆素为母核的pH荧光染料,荧光光谱证明该探针在弱酸性到弱碱性范围内有明显的荧光强度增强趋势,具有良好的光稳定性和可逆性、抗干扰能力以及较低的细胞毒性。更重要的是,该探针可以成功地应用于标记HeLa细胞,为生物医学研究和应用奠定了实验基础,有望用于生物成像领域的研究。

