葡萄糖-6-磷酸功能化亲水磁探针:有效分离富集糖肽/磷酸肽的双用途亲和材料
王柏纯,袁雨欣,闫迎华,丁传凡,唐科奇
(浙江省先进质谱技术与分子检测重点实验室,宁波大学材料科学与化学工程学院质谱技术与应用研究院,宁波315211)
蛋白质翻译后修饰(PTMs),特别是糖基化和磷酸化[1,2],在许多重要的生物学过程中发挥着关键作用,而一个特定的生物过程通常由不同类型的PTMs共同调控[3],即PTM交互作用.糖基化和磷酸化之间的相互作用就是这种PTM交互作用的典型例子.例如,糖蛋白糖链的末端经常会发生唾液酸化修饰[4],而越来越多证据表明在肿瘤细胞表面这种唾液酸化糖蛋白的表达增加.唾液酸化修饰水平的变化与磷酸化存在着相互作用[5,6],因此,糖基化和磷酸化的高效分离分析研究将有助于阐明相关疾病的发病机理[7].质谱(MS)是目前应用最广泛的准确识别和定位糖基化/磷酸化位点的平台[8].然而,由于大量未修饰肽的共存,直接利用MS进行这2种PTMs的研究存在极大的限制,需要在MS分析前对生物样品中的糖肽/磷酸肽进行有效富集[9,10].
金属氧化物亲和层析(MOAC)[11]和固定化金属亲和层析(IMAC)是目前最主要的捕捉磷酸肽的策略[12,13].其中,基于MOAC技术的二氧化钛(TiO2)由于比其它金属氧化物具有更强的磷酸肽富集能力而被广泛使用[14,15].亲水作用液相色谱法(HILIC)具有无偏富集糖肽的性能且易于与MS联用,因此也成为糖肽富集最常用的方法之一[16,17].迄今,已开发出诸多亲水探针用于糖肽的浓缩研究[18].碳水化合物是自然界中最丰富的物质,也是人体主要营养物质中最廉价的一种[19],具有优良的生物相容性和亲水性[20].壳聚糖[21]、葡萄糖和葡萄糖-6-磷酸(G6P)等碳水化合物[22,23]已被成功用于制备亲水探针.作为一种容易获得的生命代谢物,具有优异亲水性的G6P可以通过其磷酸基团和金属阳离子之间的亲和原理与金属氧化物(如TiO2)结合,以构建能够同时高效富集糖肽/磷酸肽的功能化探针[24].
多巴胺可以沉积在各种有机或无机基底表面,从而形成具有独特亲水性的天然胶黏剂聚多巴胺(PDA)[25,26].此外,在水热反应中,PDA中的质子化氮原子可以与金属离子结合并介导其水解过程,充当有机或无机基底与纳米氧化物颗粒之间的偶联连接剂[27].因此,这种具有独特亲水性的天然胶黏剂因其多功能的表面改性和加工性能而被用于开发新型功能化材料[28,29].
本文在Fe3O4磁芯上利用逐层修饰法构建了新型G6P功能化亲水磁探针Fe3O4@PDA@TiO2@G6P.易修饰的Fe3O4对外磁场具有较强的响应性,能够简化固液分离过程;PDA可以作为偶联连接剂在探针表面修饰金属氧化物TiO2;引入的TiO2不仅可以作为后续官能化G6P的锚定位点,而且能够通过MOAC技术有效富集磷酸肽;G6P的官能化赋予了纳米球高亲水性的表面,从而可实现糖肽的捕捉.这种结合MOAC和HILIC技术所构建的双用途功能化亲水磁探针能够实现糖肽/磷酸肽的同时分离富集,将在多种PTMs的蛋白质组学分析中显示出巨大的应用前景.
1 实验部分
1.1 试剂与仪器
六水合氯化铁(FeCl3·6H2O,纯度97%)、无水乙酸钠(纯度99%)、多巴胺盐酸盐(纯度98%)、碳酸氢铵(NH4HCO3,纯度>99%)和氨水(35%)均购自J&K Scientific百灵威科技公司;三羟甲基氨基甲烷(纯度≥99.9%)、乙醇(A.R.级,纯度95%)、异丙醇(Isopropanol,纯度≥99.5%)、三氟乙酸(TFA,纯度99%)、磷酸(H3PO4,A.R.级,纯度≥85%)和乙二醇(A.R.级,纯度98%)均购自Macklin公司;钛酸四丁酯(TBOT,纯度97%)、β-酪蛋白(β-casein)、乙腈(ACN,纯度≥99.9%)、牛血清白蛋白(BSA,纯度>98%)、碘乙酰胺(IAA,纯度98%)、辣根过氧化物酶(HRP)、胰蛋白酶(Trypsin)、葡萄糖-6-磷酸(G6P,纯度≥98%)、二硫苏糖醇(DTT,纯度≥95%)和2,5-二羟基苯甲酸(DHB,纯度≥99%)均购自美国Sigma Aldrich公司.所有溶液均采用Milli-Q超纯水配制.
XL-30型扫描电子显微镜(荷兰Philips公司);JEOL 2011型透射电子显微镜(日本电子株式会社);D/MAX2500型X射线衍射仪(日本Rigaku公司);Nicolet 6700型傅里叶变换红外光谱仪(美国尼高力公司);Autoflex maX MALDI-TOF MS质谱仪(德国Bruker公司).
1.2 Fe3O4@PDA@TiO2@G6P的合成
1.2.1 Fe3O4磁芯的合成将FeCl3·6H2O(2.7 g)加入乙二醇(150 mL)中,经超声获得黄色透明液体;加入无水乙酸钠(7.2 g)并搅拌30 min;将混合物转移至带有聚四氟乙烯内衬的不锈钢高压水热反应釜中,于200℃加热16 h;将溶液冷却至室温,通过磁分离技术收集获得的Fe3O4磁芯,用去离子水和乙醇各洗涤3次,于50℃下真空干燥过夜.
1.2.2 Fe3O4@PDA的合成将多巴胺盐酸盐(400 mg)加入去离子水(25 mL)中得到溶液A;将三羟甲基氨基甲烷(30.25 mg)和Fe3O4(100 mg)加入离子水(25 mL)/乙醇(25 mL)混合溶液中得到溶液B.将溶液A和B混合,常温下搅拌16 h;通过磁分离技术收集获得的Fe3O4@PDA,用去离子水和乙醇各洗涤3次,于70℃下真空干燥过夜.
1.2.3 Fe3O4@PDA@TiO2的合成在超声作用下将Fe3O4@PDA(100 mg)分散于异丙醇(80 mL)中;加入三乙胺(0.06 mL)并搅拌2 min;加入TBOT(3.6 mL)后,将混合物转移至带有聚四氟乙烯内衬的不锈钢高压水热反应釜中,于200℃加热24 h;通过磁分离技术收集获得的Fe3O4@PDA@TiO2,用乙醇洗涤,于50℃下真空干燥过夜.
1.2.4 Fe3O4@PDA@TiO2@G6P的合成将Fe3O4@PDA@TiO2(80 mg)分散于含ACN(25 mL)、去离子水(25 mL)和TFA(50 μL)的混合溶液中;加入G6P(50 mg)并于25℃反应6 h;通过磁分离技术收集获得的Fe3O4@PDA@TiO2@G6P,用去离子水和乙醇各洗涤3次,于50℃下真空干燥过夜.
1.3 标准蛋白的酶解和实际样品的预处理
1.3.1 HRP及β-casein的酶解将HRP或β-casein(各1 mg)加入到去离子水(100 μL)中,于100℃变性10 min;待混合物冷却到室温,加入NH4HCO3缓冲溶液(50 mmol/L,100 μL)和Trypsin(1 μg/μL,25 μL),将混合溶液在37℃下酶解16 h;将蛋白酶解物于−20℃储存待用.
1.3.2 BSA的酶解将BSA(2 mg)和NH4HCO3缓冲溶液(50 mmol/L,385 μL)的混合物于100℃变性5 min;加入DTT(200 mmol/L,5 μL)并于60°C放置30 min;将IAA(400 mmol/L,10 μL)加入混合物中,并于37℃黑暗条件下反应60 min;加入Trypsin(1 μg/μL,50 μL),将混合溶液于37℃酶解16 h;将蛋白酶解物于−20℃储存待用.
1.3.3 唾液样品的前处理在低温环境下将人唾液(2 mL)加入到含TFA(0.2%)的水溶液(2 mL)中;在5438g转速下离心10 min并收集上层清液;将上层清液于−20℃保存待用.
1.4 Fe3O4@PDA@TiO2@G6P对糖肽/磷酸肽的富集实验
将500 μg Fe3O4@PDA@TiO2@G6P分散于200 μL含有HRP酶解物(1.25 pmol/μL)的上样缓冲液[V(ACN)∶V(H2O)∶V(TFA)=90∶9∶1],在恒温混匀仪上于37 °C振动30 min.随后,用洗涤缓冲液[V(ACN)∶V(H2O)∶V(H3PO4)=85∶14.5∶0.5]冲洗材料3次后,加入10 μL脱附缓冲液[V(ACN)∶V(H2O)∶V(TFA)=30∶69.9∶0.1]并于37°C振动30 min,将捕捉到糖肽的洗脱.然后,取上层清液待检测.
磷酸肽的富集过程与糖肽类似.将500 μg Fe3O4@PDA@TiO2@G6P分散于200 μL含有β-casein酶解物(1 pmol/μL)的上样缓冲液[V(ACN)∶V(H2O)∶V(TFA)=50∶49.9∶0.1]中,在恒温混匀仪上于37°C振动30 min;用洗涤缓冲液[V(ACN)∶V(H2O)∶V(TFA)=50∶49.9∶0.1]冲洗材料3次后,加入10 μL脱附缓冲液(0.4 mol/L氨水溶液)并于37°C振动15 min,将捕捉到的糖肽洗脱.然后,取上层清液待检测.
1.5 基质辅助激光解吸⁃飞行时间质谱(MALDI⁃TOF MS)分析
将DHB(1 mg)溶解于含ACN(20 μL)、去离子水(79.9 μL)和TFA(0.1 μL)的混合溶液中制得糖肽的基质;将DHB(2 mg)溶于含ACN(50 μL)、去离子水(49 μL)和H3PO4(1 μL)的混合溶液中制得磷酸肽的基质.将洗脱液(1 μL)和基质(1 μL)混合,进行MALDI-TOF MS分析[Nd:YAG激光(383 nm),正离子模式,加速电压20 kV,重复频率1000 Hz].
2 结果与讨论
2.1 探针的合成及表征
Fe3O4@PDA@TiO2@G6P探针的合成路线如Scheme 1所示.通过水热反应合成Fe3O4磁芯;随后,在室温碱性条件下,在Fe3O4表面包裹PDA层;然后,以修饰的PDA层为偶联连接剂接枝TiO2;最后,以接枝的TiO2为锚定位点官能化G6P,成功构建了新型功能化亲水磁探针Fe3O4@PDA@TiO2@G6P.

Scheme 1 Synthetic path of Fe3O4@PDA@TiO2@G6P
Fe3O4@PDA@TiO2@G6P探针的扫描电子显微镜(SEM)、透射电子显微镜(TEM)、能量色散X射线谱(EDX)和X射线粉末衍射(XRD)分析结果如图1所示.由图1(A)可见,获得的Fe3O4@PDA@TiO2@G6P粒径均匀,约为350 nm,且纳米球表面粗糙,证明PDA和TiO2已成功修饰.从图1(B)中可以观察到纳米球的核壳结构,Fe3O4磁芯的粒径约为220 nm,PDA层厚度约为35 nm,TiO2层厚度约为30 nm,且PDA和TiO2层均匀涂附在Fe3O4表面,表明纳米球已成功构建.在纳米球的EDX谱图[图1(C)]中可以观察到碳(C)、氮(N)、氧(O)、磷(P)、钛(Ti)和铁(Fe)元素,其中Fe,N,Ti和P的存在分别说明了Fe3O4,PDA,TiO2和G6P的存在.在Fe3O4@PDA@TiO2@G6P的XRD谱图[图1(D)]中,30.1°(220),35.5°(311),57.0°(511)和62.4°(440)处的峰表明存在Fe3O4;25.2°(101),47.6°(200),54.0°(105)和75.4°(215)处的峰表明存在TiO2.

Fig.1 SEM image(A),TEM image(B),EDX spectrum(C)and powder XRD pattern(D)of Fe3O4@PDA@TiO2@G6P
Fe3O4@PDA@TiO2@G6P探针的傅里叶变换红外光谱(FTIR)如图2所示.586和1630 cm−1处的峰分别归属于Fe—O—Fe和C=N的振动,证明Fe3O4和PDA的成功制备;在接枝TiO2后,500~700 cm−1之间增强的宽带是由Ti—O—Ti的伸缩振动引起的,证明TiO2的成功引入;进一步官能化G6P后,在1085 cm−1处出现了1个新的归属于P—O的伸缩振动峰,证明G6P的成功修饰.FTIR结果进一步说明了Fe3O4@PDA@TiO2@G6P探针的成功构建.
2.2 Fe3O4@PDA@TiO2@G6P探针富集糖肽的性能
利用HRP评估了该探针富集糖肽的能力,具体富集流程如Scheme 2所示.可见,该材料通过G6P与糖肽之间的亲水相互作用实现对糖肽的捕捉,通过TiO2与磷酸根之间强的作用实现磷酸肽的选择性富集.在未经富集便直接检测的情况下,从1.25 pmol/μL的HRP酶解物中仅检测到5个糖肽的信号[图3(A)],且非糖肽信号占据主导谱,极大地抑制了糖肽的信号.而在使用该探针特异性富集糖肽后,出现了23个属于糖肽的信号[图3(B)],且糖肽信号占据主导谱,富集的糖肽的详细信息示于表S1(见本文支持信息)中.质谱图中几乎不存在非糖肽的信号,表明Fe3O4@PDA@TiO2@G6P探针具有优异的富集糖肽的能力.

Scheme 2 Workflow of the enrichment of glycopeptides/phosphopeptides by Fe3O4@PDA@TiO2@G6P
通过从不同含量的HRP酶解物中富集糖肽研究了该探针的检出限.当将HRP酶解物的含量稀释至10 fmol/μL时[图S1(A),见本文支持信息],可检测到12个属于糖肽的信号且占据主导谱;进一步将含量稀释至1 fmol/μL时[图S1(B),见本文支持信息],质谱图中仍出现7个糖肽信号且几乎不存在非糖肽信号;即使含量低至0.1 fmol/μL[图S1(C),见本文支持信息],探针依旧能捕捉到5个糖肽,表明Fe3O4@PDA@TiO2@G6P对糖肽具有较低的检出限.

Fig.2 FTIR spectra of Fe3O4@PDA(a),Fe3O4@PDA@TiO2(b)and Fe3O4@PDA@TiO2@G6P(c)
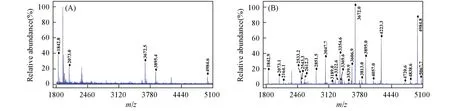
Fig.3 MALDI⁃TOF mass spectra of HRP digests
通过改变HRP酶解物和BSA的质量比研究了探针的选择性.当HRP酶解物与BSA的质量比为1∶100时[图S2(A),见本文支持信息],质谱图显示了13个属于糖肽的信号,且非糖肽信号极低;当二者质量比增加到1∶250和1∶500后[图S2(B)和(C),见本文支持信息],虽然非糖肽信号的干扰增强了,但仍分别检测到了6个和5个糖肽的信号且占据主导谱;在质量比增加到1∶1000时[图S2(D),见本文支持信息],纳米球依旧富集到了3个糖肽,表明该探针对糖肽具有良好的选择性,并且可以从半复杂样品中捕获糖肽.
通过从1.25 pmol/μL的HRP酶解物中富集糖肽研究了探针的可重复利用性,该实验共重复10次.在每个循环之前,使用脱附缓冲液和上样缓冲液洗涤纳米球.由图S3(A)~(D)(见本文支持信息)可知,尽管探针已经重复使用10次,但其富集能力几乎与最初时相同,表明该纳米材料具有良好的可重复利用性.在控制合成纳米球的条件完全相同的情况下,重新制备了2份不同批次的材料用于从1.25 pmol/μL的HRP酶解物中富集糖肽,考察了材料的制备重现性.由图S3(A),(E)和(F)(见本文支持信息)可知,新合成的2批纳米球的富集能力与第一批纳米球的富集能力几乎相同,表明Fe3O4@PDA@TiO2@G6P具有较强的可重复制备性.
通过使用不同量的纳米材料(25~150 μg)从相同量的HRP酶解物(30 μg)溶液中富集糖肽研究了探针的负载量.随着Fe3O4@PDA@TiO2@G6P纳米材料用量的增加(图S4,见本文支持信息),5种纳米球捕获糖肽的强度缓慢增至稳定值,即当纳米材料的用量为100 μg时达到饱和.通过计算得到此时纳米球对糖肽的负载量约为300 mg/g,表明该探针具有较大的负载量.
2.3 Fe3O4@PDA@TiO2@G6P探针富集磷酸肽的性能
利用β-casein评估了Fe3O4@PDA@TiO2@G6P探针富集磷酸肽的能力.未经纳米球富集时,从1 pmol/μL的β-casein酶解物中仅能检测到1个强度极低的磷酸肽的信号[图4(A)],而非磷酸肽的信号占据主导谱.在使用纳米球特异性富集磷酸肽后,质谱图由磷酸肽的信号占据主导谱且出现了8条磷酸肽的信号[图4(B)],说明该探针具有优异的富集磷酸肽的能力,富集到的磷酸肽的详细信息示于表S2(见本文支持信息).

Fig.4 MALDI⁃TOF mass spectra of β⁃casein digests
采用与糖肽类似的方法研究了该探针对磷酸肽的检出限和选择性.当将β-casein酶解物的含量稀释至2 fmol/μL时,虽然质谱图的信号强度有所下降,但几乎不存在非磷酸肽的信号,且显示了7条磷酸肽的信号[图S5(A),见本文支持信息];进一步将含量稀释至0.2 fmol/μL时,依旧出现了6个属于磷酸肽的信号且几乎不存在非磷酸肽信号[图S5(B),见本文支持信息];即使β-casein酶解物的含量低至0.02 fmol/μL,纳米球依然捕捉到了4个磷酸肽[图S5(C),见本文支持信息],表明Fe3O4@PDA@TiO2@G6P对磷酸肽具有较低的检出限.当β-casein酶解物与BSA的摩尔比为1∶100时,检测到8条属于磷酸肽的信号,质谱图几乎不存在非磷酸肽的信号[图S5(D),见本文支持信息];当两者的摩尔比增加到1∶500时,质谱图中磷酸肽信号减少到5条,但谱图几乎不存在非磷酸肽的信号[图S5(E),见本文支持信息];在将摩尔比增加到1∶1000后,虽然存在较强的非磷酸肽的干扰,但纳米球仍捕捉到了4个磷酸肽[图S5(F),见本文支持信息],表明Fe3O4@PDA@TiO2@G6P探针对磷酸肽具有良好的选择性.
通过从1 pmol/μL的β-casein酶解物中富集磷酸肽研究了探针的可重复利用性.在每次循环前均使用磷酸肽富集过程中使用的脱附缓冲液和上样缓冲液洗涤纳米球,共进行了10次循环.由图S6(A)~(C)(见本文支持信息)可知,在经过10次重复使用后,探针对磷酸肽的富集能力几乎与第一次循环的结果相同,表明探针具有良好的可重复利用性.随后,将进行过10次磷酸肽富集循环的纳米球再次用于选择性捕捉糖肽[图S6(D),见本文支持信息],结果与未进行磷酸肽富集而直接选择性捕捉糖肽的结果类似[图4(B)],表明探针表面的G6P在磷酸肽富集的洗脱过程中并未被洗掉.同时,利用重新制备的2份不同批次的材料从1 pmol/μL的β-casein酶解物中富集磷酸肽研究了探针的制备重现性.新合成的2批纳米球的富集能力[图S6(E)和(F),见本文支持信息]与第一批纳米球的富集能力[图S6(A)]几乎相同,表明探针具有较强的可重复制备性.
2.4 Fe3O4@PDA@TiO2@G6P探针用于同时富集糖肽/磷酸肽
通过从含有HRP酶解物和β-casein酶解物混合物中捕捉糖肽/磷酸肽研究了探针同时富集糖肽/磷酸肽的能力.参考文献[11,25,30]报道,选择可能利用HILIC和MOAC机制同时富集糖肽/磷酸肽的最佳条件,即在吸附过程中采用上样缓冲液[V(ACN)∶V(H2O)∶V(TFA)=90∶7∶3],在洗涤过程中采用洗涤缓冲液[V(ACN)∶V(H2O)∶V(H3PO4)=85∶14.5∶0.5],在分步脱附过程中先后采用体积比为30∶70的ACN/H2O组成的洗涤缓冲液和0.4 mol/L氨水溶液进行洗脱,在同时脱附过程中采用0.4 mol/L氨水溶液进行洗脱.在直接检测含有HRP酶解物和β-casein酶解物混合物的情况下,质谱图中仅出现了1个磷酸肽和2个糖肽的峰且丰度极低[图5(A)].在经过探针同时富集并分步脱附后,出现23个糖肽和8个磷酸肽的信号并占据主导谱[图5(B)和(C)],与上述单独富集糖肽/磷酸肽时的结果吻合.在研究该探针同时富集及脱附的能力时,共捕捉到21个糖肽和6个磷酸肽[图5(D)]的信号,说明探针具有良好的同时富集糖肽和磷酸肽的能力.
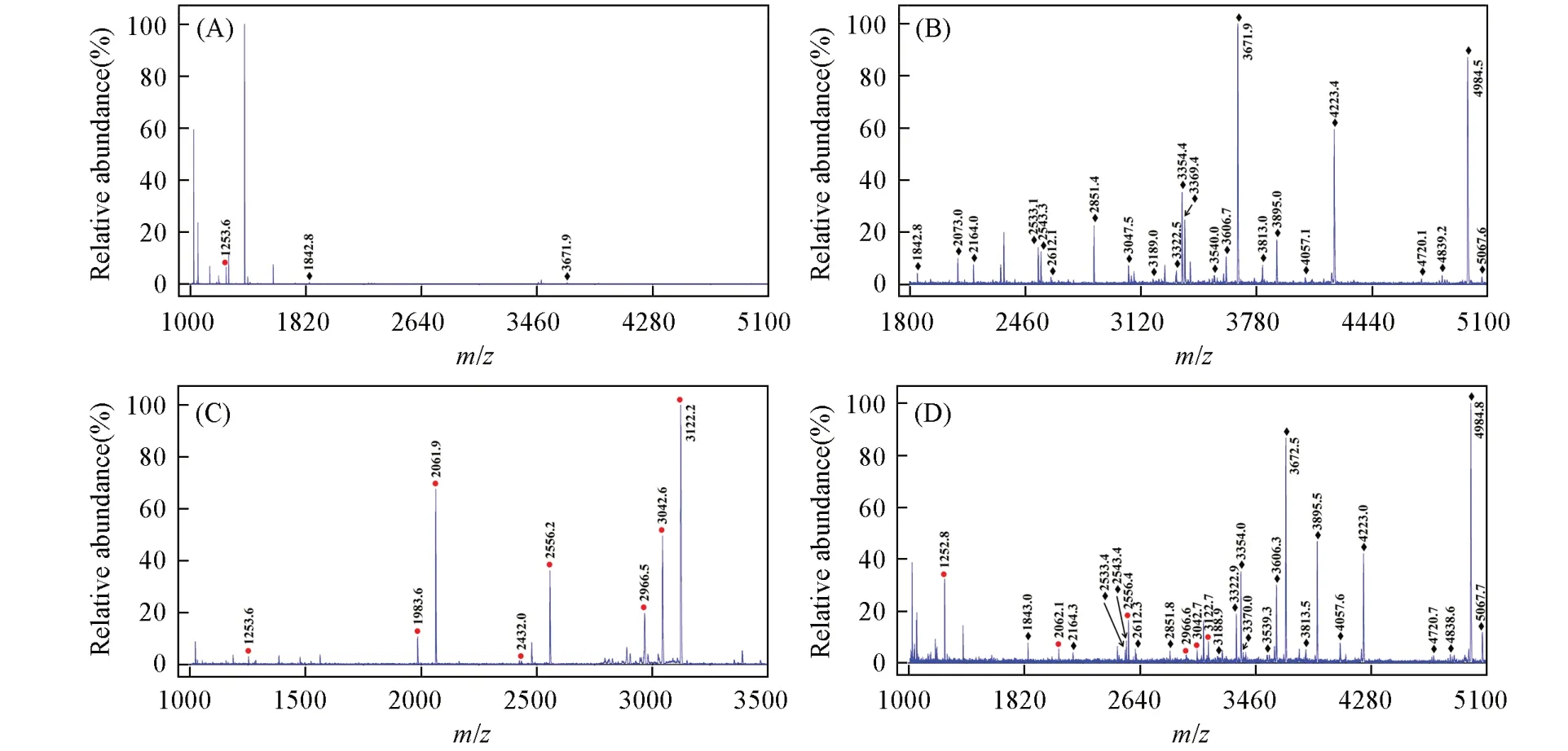
Fig.5 MALDI⁃TOF mass spectra of the mixture of HRP and β⁃casein digests
2.5 Fe3O4@PDA@TiO2@G6P对唾液中糖肽/磷酸肽的富集和检测
唾液是一种便于采集和无创的良好生物样本,其中含有大量内源性糖肽和磷酸肽.使用该探针捕获唾液样品中的糖肽和磷酸肽,以探究其实际应用潜力.在对唾液样品中内源性的糖肽进行富集之前,质谱图中非糖肽的信号占主导地位[图6(A)].利用探针处理后,共鉴定出34个糖肽[图6(B)和(C)],富集到的糖肽的详细信息列于表S3(见本文支持信息).此外,磷酸肽的富集结果与糖肽类似,即对唾液样品中内源性的磷酸肽进行富集前,谱图中非磷酸肽的信号占主导地位[图6(D)];在使用纳米球进行富集后,质谱图显示出36个属于磷酸肽的信号[图6(E)和(F)],富集到的磷酸肽的详细信息列于表S4(见本文支持信息).上述结果表明,该探针在实际生物样品的应用中具有广阔的前景.
综上所述,本文构建了一种结合HILIC和MOAC技术的葡萄糖-6-磷酸功能化双用途亲水磁探针Fe3O4@PDA@TiO2@G6P,并通过SEM,TEM,EDX,XRD和FTIR对其进行了表征.所制备的探针平均粒径约为350 nm,修饰的PDA和TiO2层均匀涂附在Fe3O4表面形成良好的核壳结构,具有强磁感应及高亲水性等优点.基于HILIC技术官能化的G6P适用于高选择性捕获糖肽,显示出低的检出限(0.1 fmol/μL)、高的选择性[m(HRP)∶m(BSA)=1∶1000]、良好的重复性(10次循环)和高的负载量(300 mg/g);基于MOAC技术接枝的TiO2不仅可以作为G6P的锚定位点,而且可以高效捕捉磷酸肽,显示出低的检出限(0.02 fmol/μL)和高的选择性[n(β-casein)∶n(BSA)=1∶1000].研究结果还表明,该探针具有同时富集糖肽和磷酸肽的能力.使用Fe3O4@PDA@TiO2@G6P探针选择性地从复杂的生物样品(唾液)中富集糖肽/磷酸肽时,共鉴定出34个糖肽和36个磷酸肽,表明该双用途纳米材料具有适用于实际样品分析的能力,将在多种PTMs的蛋白质组学分析中显示出巨大的应用前景.
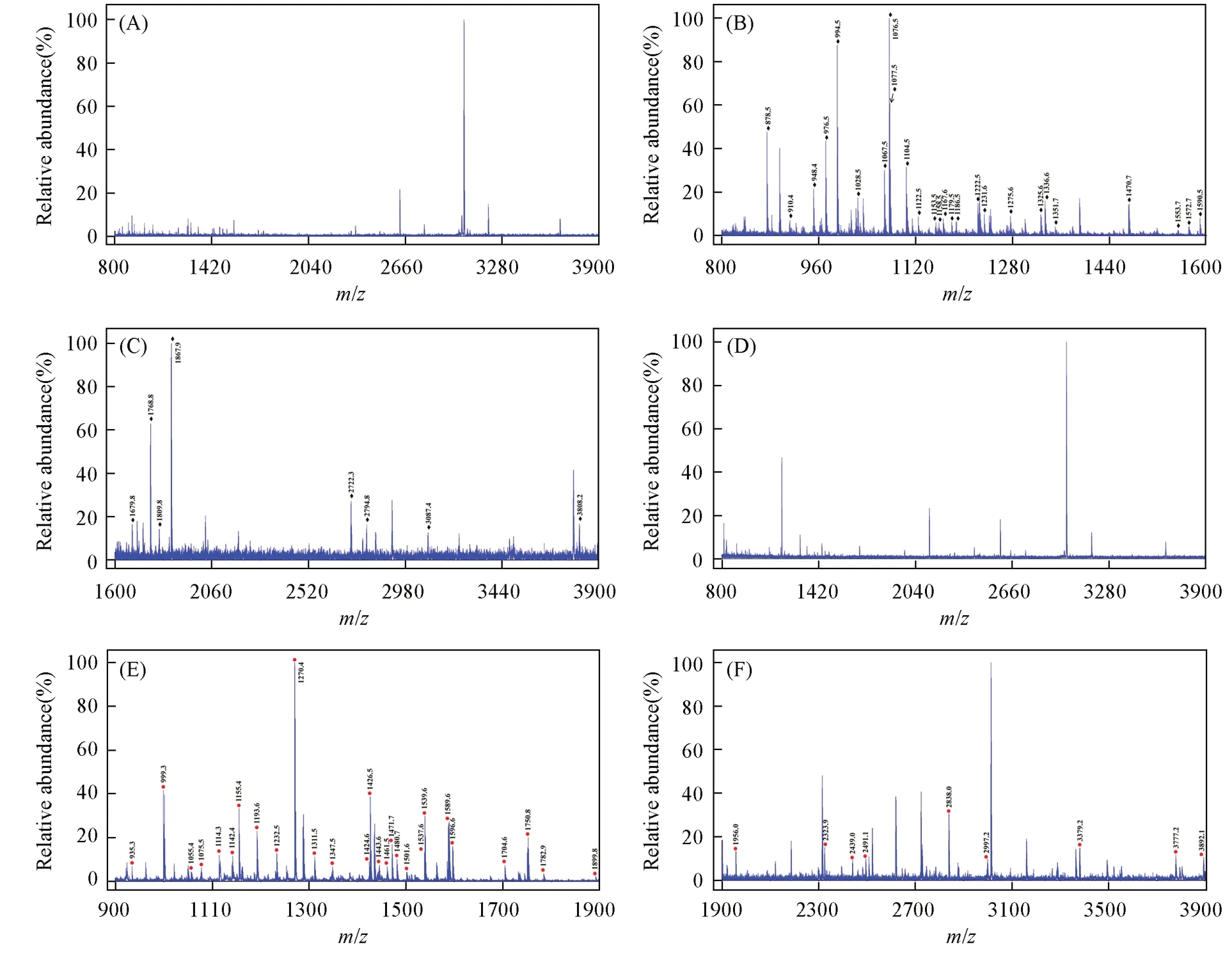
Fig.6 MALDI⁃TOF mass spectra of glycopeptides(A―C)and phosphopeptides(D―F)captured from human saliva
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20210256.