MOFs材料储氢量影响因素研究进展*
李 莹
(中石化安全工程研究院有限公司化学品安全控制国家重点实验室,山东青岛 266104)
0 前言
储氢是限制氢燃料电池汽车广泛应用的主要瓶颈之一。为了确保与传统机动车辆具有相似的行驶距离,车载存储系统应具有最小的体积和重量。这就要求开发能够在实际可行和经济可行的条件下可逆储存大量氢气(重量/体积)的材料。氢气可以通过液化、高压压缩和固体吸附等方式储存。然而,液体储氢需要在-253 ℃低温条件下,使用大型、昂贵、绝缘良好的系统来维持低温,液化成本较高;高压储氢(35~70 MPa)需要重型、昂贵的储罐压缩存储氢气。这两种存储技术能量消耗高,也存在严重的安全风险。从经济性和安全性角度来看,固体材料吸附储氢比液态储氢和压缩储氢更具优势。
固体吸附储氢方面,化学储氢主要是利用碱金属(Li、Na、K等)或碱土金属(Mg、Ca等)与氢气形成配位氢化物进行储氢。虽然这些氢化物在接近室温的情况下具有大量的重量和体积储氢容量,但它们存在可逆性差、动力学慢和操作温度高(通常超过373 K)的问题。物理储氢主要是利用活性炭、分子筛、金属有机骨架(MOFs)等多孔材料通过较弱的范德华力吸附氢气,具有高度可逆性、动力学快的特点,在低温(77 K)和几兆帕的压力下可以实现显著的储存容量,但在接近环境条件下,重量和体积储氢量较低。2020年,美国能源部(DOE)车载储氢系统的目标是在-40~60 ℃、<10 MPa的条件下,重量和体积储氢量分别为5.5%(质量分数,下同)和40 g/L。目前现有的储氢材料均不能满足车载应用所需的所有指标。
1 MOFs储氢材料及影响因素
与传统多孔材料相比,MOFs储氢材料具有极高的比表面积(实验值高达7 140 m/g,理论极限为14 600 m/g)、超高孔隙率(高达90%的自由体积)、可调节的孔径和可修饰的内表面,在氢气储存方面有着广泛的应用前景。
MOFs材料的比表面积和孔径、金属位点、配体官能团等均可影响其对氢气的吸附容量(图1)。可以采用设计高表面积、增加不饱和金属位点、有机配体功能化等策略来改善MOFs材料结构性能,进一步提高MOFs材料的氢气存储量。
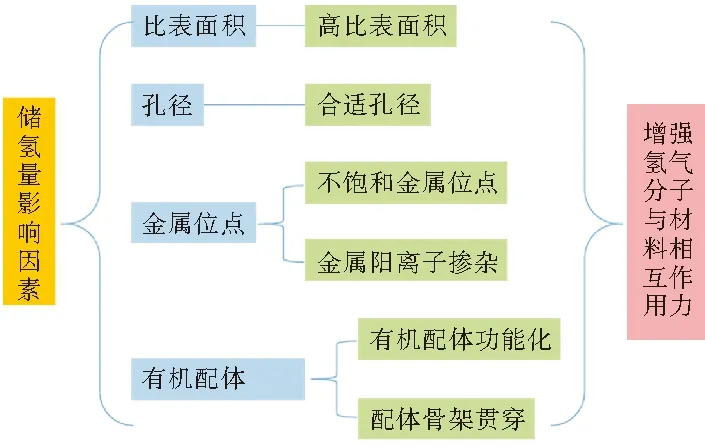
图1 改善MOFs材料储氢量的策略
以下将对MOFs储氢材料的研究现状进行总结,重点分析MOFs材料储氢量影响因素。
2 比表面积和孔径的影响
MOFs材料在低温、高压下的储氢量与材料的比表面积成正比。在77 K、高压下,随着MOFs材料比表面积的增加,氢气吸附位点数量增加,质量储氢量(质量分数)也随之增加。根据Chahine规则,MOFs材料每增加500 m/g的比表面积就相应提高1%的氢气吸附量。另外,由于氢气与吸附剂表面的相互作用能很低,但是小孔径可以使得来自对壁的电势场重叠,进而增强相互作用势。理想的孔径可以使氢分子在相反的孔壁上形成单层,使作用在氢分子上的范德华力最大化,从而产生最佳的氢骨架相互作用。H分子动力学直径为2.89 Å,因此理想孔径应约为氢分子动力学直径的2倍,即约6 Å。
延长配体或使用混合配体是提高材料比表面积和孔体积的常用策略。Frost等对比了一系列等结构、不同比表面积MOFs材料的储氢性能。MOF-177 [ZnO(BTC)(BTC=1,3,5-苯三甲酸)]比表面积为4 500 m/g,在77 K、7 MPa压力下氢气存储量为9.9%。通过使用有机配体4,4’,4’’-[苯-1,3,5-三烷基-三(苯-4,1-二基)]三苯甲酸(BBC)替换MOF-177中的BTC配体,生成MOF-200 [(ZnO)(BBC)]。MOF-200比表面积为4 530 m/g,在77 K、8 MPa下氢气存储量为14.0%。将ZnO(CO)与HBTB (BTB=4,4,4-苯-1,3,5-三酰基三苯甲酸酯)、HNDC (NDC=2,6-萘二甲酸酯)、HBTE [BTE=4,4,4-[苯-1,3,5-三烷基三(乙炔-2,1-二基)]和HBPDC(BPDC=联苯-4,4-二甲酸酯)混合配体组装形成了MOF-205。MOF-205的比表面积为4 460 m/g,在77 K、8 MPa压力下的氢气存储量为123 mg/g(11%)。MOF-210 [(ZnO)(BTE)(BPDC)] (BTE=4,4’,4’’-[苯-1,3,5-三烷基-三(乙炔-2,1-二基)]三苯甲酸,BPDC=联苯-4,4-二甲酸酯)也是通过混合配体合成的,其BET比表面积为6 580 m/g,在77 K、8 MPa压力下的氢气存储量为176 mg/g(15%)。以上数据可以看出,MOF-200、MOF-205、MOF-210与MOF-177虽然具有相同的骨架拓扑结构,但比表面积和孔体积有所增大,对应低温高压下的氢气吸附量提高。
NbO型MOFs(如NOTT-101、PCN-46和NOTT-102)低温高压下的储氢量也具有相同的趋势。在这3种MOFs中,NOTT-101的配体最短(5.77 Å)、比表面积(2 316 m/g)和孔体积(0.886 cm/g)最小,在77 K、6 MPa下储氢量最低(66 mg/g或6.2%),而NOTT-102的配体最长(10.098 Å),比表面积(2 942 m/g)和孔体积(1.138 cm/g)最高,在77 K、6 MPa下储氢量最高(72.0 mg/g或6.7%)。因此,组建MOFs材料的配体越长,对应材料的比表面积、孔体积和低温高压下的储氢量越高。
Wang等利用高度共轭的平面三苯并-2,6,10-三羧酸配体构建了具有扭曲硼砂网状拓扑结构的MOFs材料。PCN-20的Langmuir比表面积为4 237 m/g,远高于Cu-BTC(BTC=苯-1,3,5-三羧酸盐)和PCN-6’,在77 K、5 MPa下,PCN-20、Cu-BTC和PCN-6’的储氢能力分别为6.2%、3.4%和4.0%。说明高度共轭的熔融芳环可以提高多孔MOFs的比表面积,进而提高储氢能力。以上例子均可说明,通过增加MOFs的比表面积和孔体积,可以设计在低温高压下具有优良储氢量的MOFs材料。
Lin等采用联苯、三苯基和四苯基四羧酸构建了3种具有相同NbO型拓扑结构的铜基MOFs [Cu(L)(HO)](MOF-505)、[Cu(L)(HO)]和[Cu(L)(HO)],(L=联苯-3,3,5,5-四羧酸,L=三苯基-3,3,5,5,5-四羧酸,L=四萜-3,3,5,5-四羧酸),研究了孔径对氢气吸附性能的影响。3种MOFs材料的比表面积和孔径的顺序为 [Cu(L)(HO)]<[Cu(L)(HO)]<[Cu(L)(HO)],说明配体越长,MOFs的多孔性越强。在0.1 MPa时,储氢量趋势为[Cu(L)(HO)]>[Cu(L)(HO)]>[Cu(L)(HO)],在2 MPa较高压力下,储氢量随比表面积的增大而增大,即[Cu(L)(HO)]<[Cu(L)(HO)]<[Cu(L)(HO)]。该研究进一步证明了低压下,储氢量受孔径的影响,而高压下吸氢量取决于材料的孔体积和比表面积。
Yan等研究了具有不同有机配体、相同拓扑结构的NOTT-112和NOTT-116的储氢能力。介孔NOTT-116在77 K、5.0 MPa下表现出很高的BET比表面积4 664 m/g,总氢气吸附量为9.2%;在77 K、2.7 MPa下,NOTT-116的最大过剩氢气容量为6.4%。而NOTT-112的BET表面积较低,为3 800 m/g,但具有最大过剩氢气容量(7.07%)。该研究证明,比表面积和孔体积的增加并不总是意味着储存能力的提高,孔径大小在储氢量中也起着重要作用。
通过设计小孔径尺寸MOFs材料,增强氢分子与骨架之间的相互作用,可以提高室温下MOFs材料的储氢量。Li等设计合成了Ni(HBTC)(4,4’-bipy)·3DMF(HBTC=1,3,5-苯三甲酸酯,bipy=联吡啶,DMF=N,N-二甲基甲酰胺)和Co(HBTC)(4,4’-bipy)·3DMF,其在室温、7.2 MPa条件下的氢吸附量分别为1.20%和0.96%(图2),远高于一些IRMOFs的储氢能力。这两种MOFs材料相对较高的吸氢能力归因于其特定的骨架通道尺寸。与通常由矩形通道组成的IRMOFs相比,M(HBTC)(4,4-bipy)·3DMF(M=Co或Ni)的框架由非线性蜂窝状通道组成,最窄处只有5 Å而最宽间距为8 Å以及尺寸为7×6 Å的矩形通道组成,其通道尺寸有利于室温下的氢气吸附。

图2 M(HBTC)(4,4’-bipy)·3DMF(M=Co或Ni)的氢气吸附等温线
Chun等利用二羧酸和二胺的混合配体制备了2种相同的二级建筑单元,但网络拓扑结构不同的MOFs。[Co(bdc)(dabco)](bdc=1,4-苯二甲酸酯;dabco=1,4-二氮杂二环[2.2.2]辛烷)由柱撑层组成,而[Co(ndc)(dabco)](ndc=2,6-萘二甲酸酯)由原始立方网络和三维连通孔组成。[Co(ndc)(dabco)]具有高比表面积(BET=1 502 m/g),且孔径在4~6 Å的范围内,在298 K、1.72 MPa下的储氢量为0.89%,明显高于[Co(bdc)(dabco)]。该研究表明,MOFs材料的高表面积和小孔径的有效组合有利于储氢。
3 不饱和金属位点的影响
MOFs材料中的不饱和金属位点可以为氢气分子提供有利的结合位点,氢分子可以直接与开放金属中心结合,从而提高氢吸附的等位热,使材料在低压下具有较高的储氢容量。M[(MCl)(BTT)][M-BTT;BTT3-=1,3,5-苯并三唑盐;M=Mn,Fe,Co,Cu,Cd]族骨架是最早研究的具有配位不饱和位的储氢金属氧化物。在这些MOFs中,Mn-BTT在室温下表现出最好的储氢能力,在室温、9 MPa下的储氢量为0.94%和7.9 g/L,中子粉末衍射结果也证明了氢气分子与Mn开放金属中心的强相互作用。
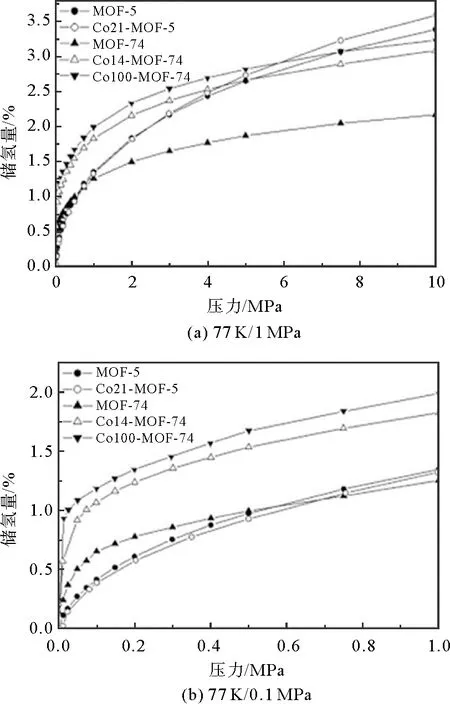
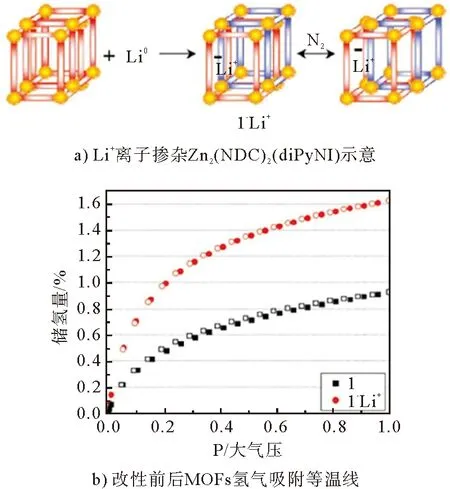
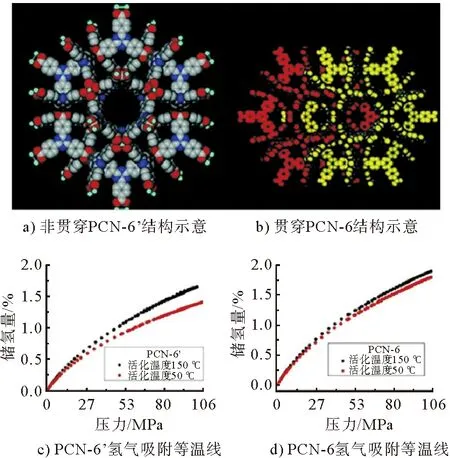
M(dobdc) [M-MOF-74;dobdc=1,4-二恶英-1,3-苯二甲酸;M=Mn,Fe,Co,Ni,Cu,Zn,Cd]也是一类具有开放金属中心的MOFs材料。这类MOFs具有较高的热稳定性和水解稳定性。M-MOF-74中的高密度开放金属中心利于氢气分子接近,使吸附的H分子产生强极化。M-H距离的趋势为Ni Gedrich等研究了由btb配体(btb=苯-1,3,5-三苯甲酸盐)和[Ni(O)(OC)]团簇形成的含镍MOF(DUT-9),去溶剂化的DUT-9具有高浓度的不饱和金属中心和很高的孔隙率。当DUT-9被超临界CO干燥活化时,其过量H吸收率分别达到1.33%(77 K和0.1 MPa)和4.99%(77 K和4.5 MPa)。由于存在开放的金属中心,进一步的热活化导致DUT-9具有更高的储氢量1.66%(在77 K和0.1 MPa下)和5.85%(在77 K和4 MPa下)。 Gedrich等还由[Mn-OH-Mn]n链和btac(btac=苯并三唑-5-羧酸盐)配体制备了多孔Mn-MOF,在0.05 MPa低压下储氢量约为1%,在0.5 MPa时储氢量达到最大值1.03%。这种低压下H吸附量的迅速增加部分归因于H与暴露的Mn中心之间的相互作用。Lee等比较了3种以铜或锌为金属的等结构NbO型MOFs的储氢能力,即SNU-5’(有开放金属位Cu(abtc)),SNU-5(无开放金属位[Cu(abtc)(dmf)])和SNU-4(无开放金属位[Zn(abtc)(dmf)])。在77 K、0.1 MPa下,SNU-5’、SNU-5和SNU-4的储氢量分别为2.87%、1.83%和2.07%。SNU-5’的最大吸氢能力也归因于氢分子与MOFs开放金属中心的较强相互作用。 在MOFs材料中引入“客体”金属离子也可以提供不饱和金属位点,氢气分子与掺杂的阳离子之间结合强度的增加,可以提高MOFs材料的储氢性能。 Botas等用Co部分取代MOF-5中的Zn,制备了两种共掺杂样品Co8-MOF-5(ZnCoO(BDC)(DEF))和Co21-MOF-5(ZnCoO(BDC)(DEF))。在低压下(<0.1 MPa),MOF-5和Co-MOF-5材料之间的氢气吸附差异很小。但在较高的压力下,Co-MOF-5材料的H吸附容量超过了母体MOF-5(图3)。Co21-MOF-5在77 K、1.0 MPa下的吸氢量最高,比原始MOF-5吸氢量高7.4%。Botas等还研究了MOF-74(Zn(CHO)(DMF)(HO)中Zn/Co比对H吸附行为的影响。MOFs的金属含量跨越了整个Zn/Co浓度范围(0~100%Co),储氢量随Co含量的增加而增加,Co61-MOF-74、Co14-MOF-74和Co100-MOF-74的储氢量分别比MOF-74高26%、43%和50%。Co14-MOF-74由于比Co61-MOF-74具有更好的孔结构特性,其对H的吸附量更高。另外,尽管Co100-MOF-74的孔体积略低于Co14-MOF-74的孔体积,但H吸附容量更高,这说明Co对H的更强亲和力可以补偿较低的多孔性。 图3 MOF-74和MOF-5氢气吸附等温线 图4 Li+离子掺杂Zn2(NDC)2(diPyNI)及改性前后MOFs氢气吸附等温线 虽然金属中心是氢分子在MOFs中的优先吸附位点,但有机配体也是氢吸附的有利场所。配体的类型会影响MOFs的比表面积,也会改变与氢气相互作用的电子环境。研究表明,MOF-5中有2个不同的氢结合位点:一个与Zn金属中心有关,另一个与有机配体有关。Rowsell等研究了一系列含有不同羧基化键的等网状MOFs(IRMOF-1、IRMOF-8、IRMOF-11、IRMOF-18)和MOF-177对氢气的吸附性能。每个配方单位的H分子数与每个配方单位的有机单元数(和芳香环)之间存在直接相关性,在77 K、0.1 MPa下,每个配方单位的H分子数量从IRMOF-18的最小值4.2到IRMOF-11中的最大值9.3。说明通过增加有机配体的芳香性,可以增强MOFs框架内氢分子的相互作用,进而提高储氢量。 Wang等对IRMOF-3、UMCM-1-NH、DMOF-1-NH一系列MOFs进行后合成改性,得到的改性MOFs分别为IRMOF-3-AMPh、IRMOF-3-URPh、UMCM-1-AMPh和DMOF-1-AMPh。在77 K、0.1 MPa下,IRMOF-3-AMPh和IRMOF-3-URPh的H吸收量分别比未改性的IRMOF-3高1.73%和1.54%,后者的储氢量为1.51%。该研究也证明了通过向MOFs中加入芳香族基团可以增强与H的结合能力,因为H分子可以与添加的苯基发生特异性的相互作用。 Yang等研究了MOF-5及其单取代衍生物。在77 K、0.1 MPa条件下,储氢量的变化趋势为MOF-5>CH-MOF-5>Br-MOF-5>Cl-MOF-5,分别为1.44%、1.47%、1.08%和0.99%。官能团-CH、-Br和-Cl对MOF-5的等位吸附热影响不大。考虑到H吸附热的相似性,CH-MOF-5的储氢量略高于MOF-5,这是由CH基团过大或存在互穿结构而导致的孔隙缩小引起的。Br-MOF-5和Cl-MOF-5的相对较低的吸附容量是由于这些MOFs的孔结构较差以及官能团的吸电子作用导致的。 由于MOFs材料孔中心附近的H分子不可能与孔表面相互作用,所以大孔MOFs不利于储氢,而孔尺寸接近H动力学直径的MOFs有利于低压储氢。MOFs材料的有机配体骨架相互贯穿可以创造更小的空隙,在单位体积上产生更多的吸附位点,从而增加对氢气的吸附能力。 Ma等研究了骨架连接对铜基MOF Cu(TATB)(TATB=4,4’4’’-s-三嗪-2,4,6-三酰三苯甲酸盐)异构体PCN-6和PCN-6’储氢量的影响(图5)。在PCN-6中,由于贯穿作用,有更多的有效结合位点,而在PCN-6’中,由于相对孔壁之间的距离很长(21.4 Å),导致有效结合位点的数量很少。在77 K、0.101 MPa下,具有贯穿结构的PCN-6的储氢量为1.90%,比未贯穿的PCN-6’储氢量(1.35%)多40%。在高压下,氢分子主要吸附在有机连接物周围,其中具有贯穿结构的PCN-6比未贯穿PCN-6’与氢气之间具有更强的相互作用。因此,在77 K、5.0 MPa下,PCN-6(6.7%)的储氢量大大超过PCN-6’(4.0%)。 图5 骨架连接对铜基MOF Cu3(TATB)2异构体PCN-6和PCN-6’储氢量的影响 vs 尽管MOFs材料在储氢方面取得了很多进展,尤其在低温下表现出很高的储氢能力,但在室温下的储氢能力较低(通常小于1%),仍不能满足当前的DOE储氢指标。MOFs作为一种实用的储氢材料还需要克服许多挑战。为了提高MOFs室温下的储氢量,需要增加氢气分子与材料骨架之间的相互作用。目前,人们采用多种策略如提高材料比表面积、减小孔径、掺杂客体金属离子、有机配体官能团修饰、配体骨架贯穿等来增加氢气与MOFs骨架的相互作用。另外,MOF复合材料也是一种很有潜力的提高MOFs储氢量的方法。例如,将化学吸附的高温储氢材料(氢化物等)纳米限制在物理吸附的MOFs材料的孔道内,使之产生协同效应,不仅降低氢化物的脱氢温度、改善氢释放动力学,还提高了MOFs材料室温下的储氢量。 总之,未来的研究应继续着眼于提高氢分子与材料骨架之间的相互作用力,以改善室温下的储氢性能。理想的MOFs材料应具有大的比表面积和孔体积以及适当的孔径,与之对应具有体积和重量储存量大、动力学快、热力学良好、解吸温度低、可逆性好等特性。此外,MOFs材料还应具有低成本、高湿/热稳定性,才能真正应用于车载储氢。科学家在这一领域的不断探索与努力将加快MOFs材料用于车载储氢应用的步伐。4 金属阳离子掺杂影响
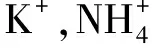

5 有机配体影响
6 配体骨架影响
7 结论与展望

