膳食多酚改善炎症性肠病的作用机制研究进展
林鹏程 曹峻菡 解万翠,2,3,4
(1. 青岛科技大学海洋科学与生物工程学院,山东 青岛 266042;2. 山东省生物化学工程重点实验室,山东 青岛 266042;3. 山东省宏福慧科技有限公司,山东 临沂 276000;4. 尚好科技有限公司,山东 青岛 266002)
炎症性肠病(IBD)是以肠道炎症和上皮损伤为病理特征的慢性复发性疾病,包括克罗恩病(CD)和溃疡性结肠炎(UC)两种[1-2],严重影响人体健康。目前IBD的发病机制尚不明确,研究[2]认为发病机制与遗传、环境、微生物、肠屏障损伤、机体免疫异常以及饮食营养有关。目前临床所用的类固醇激素类、5-氨基水杨酸类和免疫抑制剂等IBD治疗药物无法根治且毒副作用大,因此通过营养干预缓解肠炎已经成为研究热点。
膳食多酚是存在于食物中的酚类化合物的总称,是具有多元酚结构的次生代谢物,广泛分布在蔬菜、水果、谷物、红酒等植物性食品中,对炎症、氧化应激、微生物、肿瘤、糖尿病等具有预防和调控作用[3]。大部分的多酚(占总多酚摄入量的90%~95%)并未被小肠吸收,而是到达大肠,在其中作为发酵底物,由肠道微生物群分解、代谢为生物活性更高的小分子化合物[3-4],因此,多酚被认为是干预肠道疾病的潜在营养物质[5]。
膳食多酚在IBD的预防和改善方面具有良好的应用前景,但是其机制尚不明确。文章拟在查阅文献的基础上,从氧化应激、炎症信号通路、肠黏膜屏障、肠道菌群及代谢物4个方面,就膳食多酚对IBD的干预作用及机制进行阐述,旨在为利用膳食多酚开发天然营养补充剂提供理论依据。
1 膳食多酚通过调节氧化应激改善IBD
活性氧和活性氮(ROS/RNS)在IBD中起着关键作用。肠道组织中过多的ROS、RNS会引起脂质过氧化、DNA损伤和细胞凋亡,还会导致超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)和丙二醛(MDA)等酶和非酶抗氧化机制的损害,最终引起结肠损伤[6-7]。激活的炎症细胞可刺激NADPH氧化酶系统和诱导型一氧化氮合酶(iNOS)分别产生大量的超氧化物和一氧化氮,并释放出大量的髓过氧化物酶(MPO),诱导结肠炎症和病理变化。多项研究[8-15]表明,膳食多酚能够通过减少结肠脂质过氧化、促进抗氧化物产生、提高抗氧化酶活性、抑制iNOS的表达缓解结肠炎试验模型中发生的氧化应激。
在由2,4,6-三硝基苯磺酸(TNBS)、葡聚糖硫酸钠(DSS)诱导的试验性结肠炎模型中,MPO、MDA活性普遍增加,SOD、GSH活性减弱。Oz等[8]将茶多酚应用于DSS诱导的结肠炎模型小鼠中,发现其可抑制ROS生成;Bruckner等[9]研究发现EGGE可通过减少ROS、MDA和MPO的生成,减轻结肠炎小鼠的肠道损伤;Ogawa等[10]将鞣花酸与鞣花酸微球分别作用于结肠炎大鼠中,发现两者均可通过抑制MPO、ROS和MDA的产生缓解溃疡、减少结肠缩短长度、降低体重减轻幅度;Sanchez等[11]认为槲皮素对TNBS诱导的大鼠结肠炎的保护作用是通过抑制MDA、MPO等氧化相关酶酶活,从而抑制结肠组织中iNOS的表达实现的。此外,染料木黄酮[12]、甘草黄酮[13]、柚皮素[14]、小豆蔻素[15]等膳食多酚在试验性结肠炎中也表现出相似的作用,因此,膳食多酚可以通过调节氧化反应缓解ROS和RNS对肠道的氧化损伤。
2 膳食多酚通过调节炎症信号通路改善IBD
在正常机体中,促炎因子和抑炎因子处于平衡状态,但在IBD机体中,促炎因子的过量产生使该平衡遭到破坏,就此引发的炎症反应会推动组织损伤和病情发展。促炎因子过量产生等异常炎症反应与炎症信号通路的持续激活、传导有关,因此以信号通路为中心调控炎症因子在IBD中发挥着重要作用。既往研究[16-29]表明,膳食多酚可通过调节TLR/NF-κB、JAK/STAT、MAPK炎症信号通路改善IBD。
2.1 膳食多酚调节TLR/NF-κB信号通路
NF-κB是一种在肠道炎症中发挥重要作用的转录因子,Toll样受体(TLRs)是人体抵御外来侵袭的第一道屏障,可通过MyD88依赖途径激活NF-κB信号通路。正常状态下,NF-κB蛋白复合物(p65-p50)与其抑制剂IκB结合成以非活性形式存在的二聚体,受到刺激后,IκB蛋白激酶IKK复合物活化,IκB蛋白会发生磷酸化并释放NF-κB,使其进入细胞核调控基因转录,参与大量的炎性因子的表达。多种膳食多酚可以通过抑制NF-κB途径缓解IBD(图1)。Rahman等[16]发现儿茶素能够调控TLR4的表达来阻断NF-κB的活化以及调控其上游IKK复合物,从而抑制炎症因子表达;Romier等[17]研究发现鞣花酸在人肠道Caco-2细胞中可通过抑制NF-κB转录活性,减少IL-8分泌改善肠炎;Nunes等[18]研究发现富含儿茶素的红酒提取物可抑制NF-κB的激活和COX-2、iNOS的产生;Dou等[19]发现柚皮苷的摄入抑制了TLR-4的表达,降低了TNF-α等促炎细胞因子的产生,此外,磷酸-NF-κB p65蛋白和磷酸IκBα蛋白浓度也出现显著降低,表明靶向抑制TLR4/NF-κB信号通路可能是柚皮素抑制试验性结肠炎中的重要机制;Antonia等[20]在用LPS处理的Caco-2细胞中观察到白藜芦醇通过减少TLR-4和诱导型NO合酶的表达,降低IκBα的磷酸化和降解速率来抑制NF-κB的活化。以上研究表明,NF-κB是膳食多酚对IBD发挥保护作用的途径之一。
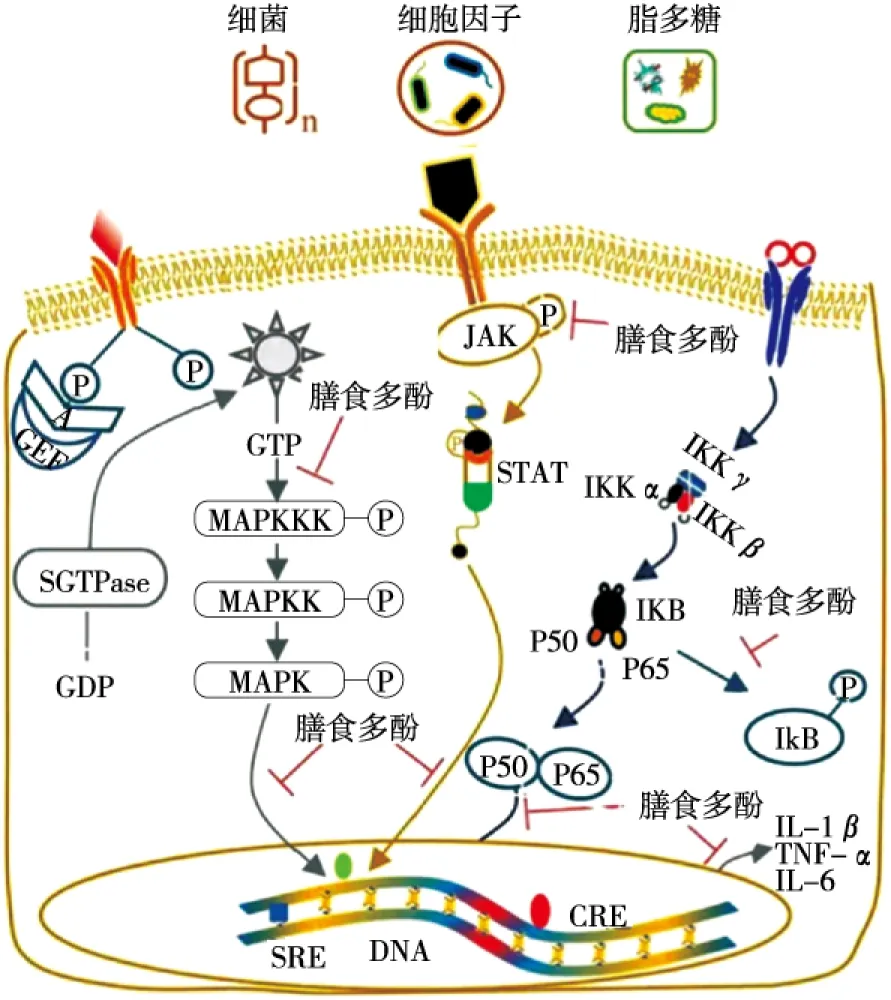
图1 膳食多酚可通过不同信号途径改善IBD[30]Figure 1 IBD improving by dietany polyphends throughdifferent signaling pathways
2.2 膳食多酚调节JAK/STAT信号通路
Janus激酶/信号转导子和转录激活子(JAK/STAT)是UC发病机制中介导细胞凋亡及炎症信号转导的重要通路,是细胞因子将细胞外信号传递到细胞核内的重要途径,其传递过程为:细胞因子与其受体结合后引起相关受体分子二聚化,使受体偶联的JAK以选择性磷酸化的方式活化STAT,随后STAT形成二聚体并发生核易位,与特异DNA序列结合,调控基因转录与表达。膳食多酚可通过抑制JAK/STAT途径改善IBD(图1)。Zhang等[21]发现姜黄素可通过JAK/STAT通路有效抑制TNBS诱导的细胞凋亡和促炎细胞因子的分泌,增强抗炎细胞因子的表达,减轻肠炎症状;Nunes等[22]研究发现木犀草素可通过抑制JAK/STAT途径调节HT-29结肠上皮细胞内炎症信号级联反应;Serra等[23]研究发现白藜芦醇在HT-29结肠细胞中有效降低了磷酸化STAT1的表达,表明JAK-STAT信号通路是白藜芦醇发挥抗炎活性的关键途径;Andújar等[24]研究发现富含多酚的可可提取物可通过抑制STAT1、STAT3磷酸化缓解UC,Saadatdoust等[25]也得出了类似的结论,发现可可多酚可以通过IL-6/STAT3途径抑制肠炎相关的癌症;此外,水飞蓟素[26]、甘草黄酮[27]等膳食多酚也可通过JAK/STAT在IBD中发挥作用。
2.3 膳食多酚调节MAPK信号通路
促分裂原活化蛋白激酶(MAPK)信号通路与IBD的免疫调节、炎症反应密切相关,可被炎症因子、生长因子、细胞应激等多种刺激激活,通过磷酸化级联反应激活下游的转录因子分泌大量炎症介质,进而参与炎症反应。Sanchez-Fidalgo等[28]研究表明膳食中富含多酚的初级特榨橄榄油可通过抑制MAPK通路缓解DSS诱导的慢性肠炎;Dou等[29]研究表明芒果苷可通过降低MAPK和NF-κB的活化水平发挥肠炎保护作用。这些研究均表明,膳食多酚可以通过调节MAPK信号通路改善IBD(图1)。
以上研究表明多酚类物质可以通过调节多种信号通路抑制促炎细胞因子表达,对试验性结肠炎起到预防、缓解作用。
3 膳食多酚通过保护肠黏膜屏障改善IBD
肠黏膜屏障是肠道与外界环境接触的第一道屏障,它是一个复杂的多层系统,包括机械、化学、生物和免疫四大屏障。这些屏障的交互作用使得肠道能够保持渗透性平衡,这种功能状态被称为肠道通透性(IP)。肠黏膜屏障功能受损、肠道通透性增加被认为是IBD发病机制中的关键因素。研究[31-44]发现,膳食多酚类化合物在肠黏膜屏障具有重要作用。
3.1 机械屏障
IBD患者肠黏膜机械屏障损伤主要与肠上皮细胞紧密连接(TJ)的结构、功能异常有关。紧密连接主要由闭锁蛋白(Claudin)、咬合蛋白(Occludin)、带状闭合蛋白(ZO)、连接黏附分子(JAM)等紧密连接蛋白所构成。多酚可通过调节紧密连接蛋白的表达,改善肠黏膜屏障功能损伤[31]。研究表明,可可多酚可改善Caco-2单层细胞损伤模型中ZO-1的蛋白分布情况和单层细胞旁转运能力[32];从植物黄杞叶中分离得到的多酚类化合物落新妇苷可提高Caco-2单层细胞模型Claudin-1、ZO-2 mRNA表达水平及Occludin、ZO-2的蛋白表达水平[33];Shigeshiro等[34]用姜黄素、槲皮素、柚皮素和橙皮素饲喂DSS诱导的结肠炎小鼠,发现4种多酚的摄入均恢复了TJ蛋白的表达,其中槲皮素通过恢复Occludin的表达对肠屏障产生保护作用;橙皮素和姜黄素通过恢复JAM-A和Claudin 3的表达抑制了DSS诱导的屏障破坏;柚皮素通过恢复Occludin和JAM-A的表达保护肠屏障。
以上研究证实,植物多酚类化合物可通过调节紧密连接蛋白的表达保护机械屏障。
3.2 化学屏障
由肠黏膜分泌的、附着在肠壁的黏液使丰富多样的肠腔微生物得以存活,同时保护黏膜上皮和免疫系统免受细菌的接触和错误激活。以黏液缺乏为代表的化学屏障的损伤,是IBD的发生发展中非常关键的一环。
Martin等[35]和Rosillo等[36]报道白藜芦醇和鞣花酸可增加CD大鼠模型结肠黏膜杯状细胞的黏液分泌;Georgiades等[37]发现天然来源的纯多酚和绿茶、红茶多酚提取物可以作为胃、十二指肠分泌的胃肠黏液的交联剂,增强黏液层的黏弹性。因此,膳食多酚对肠黏液构成的化学屏障具有保护作用。
3.3 免疫屏障
研究[38-39]指出,促炎细胞因子可通过激活多种细胞内信号通路导致肠黏膜屏障功能的损伤。Chen等[40]在TNBS诱导的UC模型小鼠中发现紫山药多酚提取物可通过抑制TNF-α等促炎因子的生成,促进Occludin、Claudin-1等TJ蛋白的表达,保护肠黏膜屏障,发挥对肠炎的改善作用。席进等[41]研究发现,绿茶多酚可降低CD模型小鼠肠黏膜JAK/STAT的表达水平和IL-6、TNF-α的生成量,从而缓解肠炎。上述各项研究表明,植物多酚类化合物可通过调节肠道上皮细胞信号通路和炎症因子的表达保护肠屏障。
3.4 生物屏障
双歧杆菌、乳酸杆菌等肠道微生物可以通过影响紧密连接蛋白直接影响肠道通透性,也可以通过调节炎症因子间接影响肠道通透性,膳食多酚则可以调节上述微生物在菌群中的组成。此外,膳食多酚的菌群代谢物也对屏障有保护作用,如短链脂肪酸(SCFAs)可诱导肠上皮细胞分泌IL-18、抗菌肽和黏蛋白,加强肠上皮紧密连接,维持肠道黏膜屏障的完整性[42];SCFAs家族中的丁酸盐可以抑制巨噬细胞的活化和促炎细胞因子的产生,还可以增加Claudin-1的表达,逆转ZO-1的异常表达,从而保护肠屏障[43-44]。因此膳食多酚及其肠道菌群代谢物对生物屏障具有保护作用。
4 膳食多酚对肠道菌群及短链脂肪酸(SCFAs)的调节作用
IBD患者的肠道菌群失调表现为共生菌与病原菌比例失调、肠道菌群多样性下降。失调的肠道菌群及其代谢产物通过与宿主相互作用,可引起肠道免疫耐受损伤,致使肠道炎症发生。膳食多酚通过提高有益菌相对丰度、减少致病菌、增加SCFAs产生菌对肠道菌群及代谢产物SCFAs进行调节;此外,多酚在结肠中作为底物,可被微生物分解为活性更高的代谢产物,发挥更好的保护作用。
肠道微生物群的种类和数量是影响IBD发展的重要因素之一。在IBD肠道菌群失调中,最常观察到的是厚壁菌门、拟杆菌的减少以及变形杆菌的增加,此外,乳酸杆菌等有益细菌有时也会减少[45]。Neyrinck等[46]研究表明,石榴提取物及其活性代谢物尿石素A,可提高双歧杆菌、乳酸杆菌等益生菌的丰度,降低大肠杆菌的丰度并抑制其在肠道内的侵袭活动,同时,双歧杆菌提高了石榴多酚的吸收和生物利用度,改善了慢性炎症。Larrosa等[47]发现白藜芦醇处理会使IBD模型鼠肠道中双歧杆菌和乳酸杆菌增加;Dolara等[48]发现大鼠服用红酒多酚后,肠道内梭菌属水平显著降低,类杆菌、双歧杆菌和乳酸杆菌的水平显著升高。因此,多酚可通过调节肠道菌群结构组成改善IBD。
研究[49]发现,IBD患者体内的SCFAs产量和Roseburiahominis、Faecalibacteriumprausnitzii等SCFAs产生菌含量均呈下降现象,推测SCFAs与IBD发病存在某种关联。其中,丁酸及丁酸制剂能通过抑制促炎因子表达、促进紧密连接蛋白表达缓解溃疡性结肠炎[43]。红酒多酚、葡萄籽多酚、奇异果多酚可以提高产SCFA的菌丰度,增加肠道内丁酸盐产量[50];Li等[51]研究发现麝香葡萄和脱醇的麝香葡萄酒能够通过增加Coprococcus的丰度,促进丁酸和乙酸的产生,缓解IBD。
肠道微生物可将多酚分解为多种具有不同结构的代谢物,多酚也会增加肠道菌群的多样性和微生物代谢产物的水平,多酚对IBD缓解的益处来自前体化合物、微生物代谢产物和肠道微生物组的综合活性。但目前研究尚不充分,未来需要进一步研究发现未知的多酚微生物代谢物,并将特定的肠道微生物与微生物代谢产物相关联。
5 展望
膳食多酚因其具有的抗氧化、抗炎等多种生物活性日益成为疾病营养干预及保健食品研发的焦点,将其作为IBD的营养补充剂具有广阔前景。膳食多酚主要通过调节氧化应激、炎症通路、保护肠道屏障、调节肠道菌群及代谢物实现对IBD的营养保护作用,但以上各机制之间存在的复杂相互作用仍待阐明。目前,膳食多酚对IBD的改善作用研究多集中于游离态多酚,结合态多酚的生物活性、构效关系亟待开发;同时也应关注多酚单体、多酚混合物和整个食物在同一种模型中的营养差别,对食物中不同活性物质的协同生物活性进行探究。同时,多酚生物活性会因食品加工方式、胃肠的消化吸收、肠道微生物的分解代谢等发生结构变化,因此在多酚代谢、生物利用度方面需进行更多研究。此外,膳食多酚对IBD的改善作用研究多局限于短期动物或细胞试验,需进行更深入、完善的人类临床试验,以获得膳食多酚在IBD改善中的确切营养途径。

