乳腺放射状瘢痕与乳腺癌的临床及超声影像对比研究
赵紫薇,陆苏,吴楠,张世超,赵晶,刘俊田
乳腺放射状瘢痕(RS)是一种少见的良性病变,可伴随各种病理类型,属乳腺异常增生性疾病。其无特异性临床表现,较小病灶常于诊断其他良恶性病变时在光学显微镜下意外发现,较大病变可由影像学检查发现。乳腺RS因其中心硬化性病变使周围导管和小叶结构扭曲,影像学表现与乳腺癌存在相似之处[1],易导致误诊;但两者的治疗方式完全不同。因乳腺RS发病率低,对其影像学特征描述多为小样本报道,且年代相对久远。随着乳腺影像学检查技术的进步,尤其是彩色多普勒血流检测、超声弹性成像检查在临床的广泛应用,目前对乳腺可疑病灶的检出及术前鉴别诊断已经取得较大进步。本研究通过对乳腺RS和浸润性导管癌(IDC)患者的临床及超声影像学资料进行回顾性对比分析,并结合病理诊断结果阐释两者超声图像异同的机制,进一步评估二维超声乳腺影像报告和数据系统(BI-RADS)分类、彩色多普勒血流信号、弹性评分对两种病变的预测效能,加深对乳腺RS的认识,降低误诊率。
1 对象与方法
1.1 研究对象 选取2015年2月—2017年12月在天津医科大学肿瘤医院经病理检查确诊的乳腺RS患者。纳入标准:(1)经术后病理检查证实为单发RS。(2)术前于我院行乳腺超声检查,且超声图像及诊断报告资料完整。排除标准:(1)经回顾术后病理与术前超声图像,RS为非目标病变。即在手术切除乳腺其他可疑病灶时,术后病理检查无意中发现的RS。(2)临床及病理资料记载不全。最终纳入40例乳腺RS患者,其中<30岁2例(5.0%),30~39岁4例(10.0%),40~60岁34例(85.0%)。另选取同期经病理确诊的40例IDC患者作为对照组。纳入标准:(1)经术后病理证实为单发IDC,病理分期为pT1~2N0Mx。(2)临床及病理资料齐全,包括于我院术前所行乳腺超声检查资料完整。排除标准:我院超声检查考虑乳腺非肿块型病灶。其中30~39岁11例(27.5%),40~60岁26例(65.0%),>60岁3例(7.5%)。
1.2 指标收集 记录患者年龄、月经状态、哺乳史、流产史、病灶侧别、既往同侧乳腺手术史、临床症状、乳腺超声图像及诊断报告和病理结果。
1.3 术前乳腺超声检查 采用GE LogiqE9彩色多普勒超声诊断仪,配备实时彩色超声弹性成像技术,高频探头频率7~14 MHz。以二维灰阶超声观察并记录病灶的部位、大小、形态、边缘、内部回声、后方回声、周围高回声晕、钙化灶,检查结果采用2013版BI-RADS分类标准[2]对乳腺病灶进行分类。本研究中将BI-RADS 1~3、4a类归为良性病变,4b、4c及5类归为恶性病变。彩色多普勒血流成像观察乳腺肿块内部及周边的血供丰富程度。随后行超声弹性成像检查获取肿块硬度特征,弹性评分采用改良5分法[3],1~3分为良性,4~5分为恶性。所有检查均由2名具有10年以上乳腺超声检查经验且能熟练运用弹性成像检查的超声科医师完成。
1.4 术后病理检查 乳腺病灶均经手术完整切除,常规行苏木精-伊红染色,经光镜检查,若诊断困难者,加做免疫组织化学明确诊断,所有患者病理切片均由我院病理科2位病理医师联合确诊。
1.5 统计学方法 采用SPSS 25.0软件进行数据分析。计数资料以例表示,组间比较采用χ2检验或Fisher确切概率法。以病理结果为金标准,采用受试者工作特征(ROC)曲线评估彩色多普勒超声联合弹性成像技术对RS和IDC的诊断效能。以P<0.05为差异有统计学意义。
2 结果
2.1 2组患者基线资料比较 2组病灶侧别、同侧乳腺手术史、月经状态、哺乳史、流产史、临床症状等比较差异均无统计学意义(P>0.05),见表1。
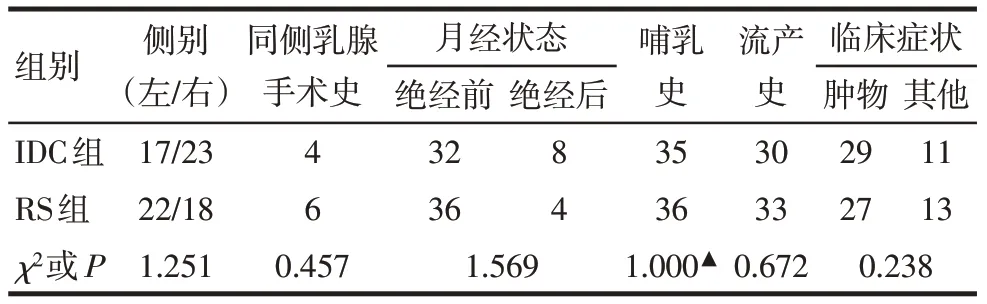
Tab.1 Comparison of baseline information between the two groups of patients表1 2组患者基线资料比较 (n=40,例)
2.2 2组患者超声图像特征比较 40例乳腺RS病灶均被超声检出。RS组中23例行实时弹性成像检查,二维超声BI-RADS分类3类、4a类27例,4b、4c及5类13例;IDC组中24例行实时弹性成像检查,二维超声BI-RADS分类4a类10例,4b、4c及5类30例。2组超声图像均表现为低回声团块或结节。与IDC组比较,RS组超声图像多表现为形态尚规则、边缘清晰、周围无高回声晕、内部回声均匀、不伴钙化、无血流信号、后方回声无改变或增强、弹性评分良性(P<0.05),见表2。
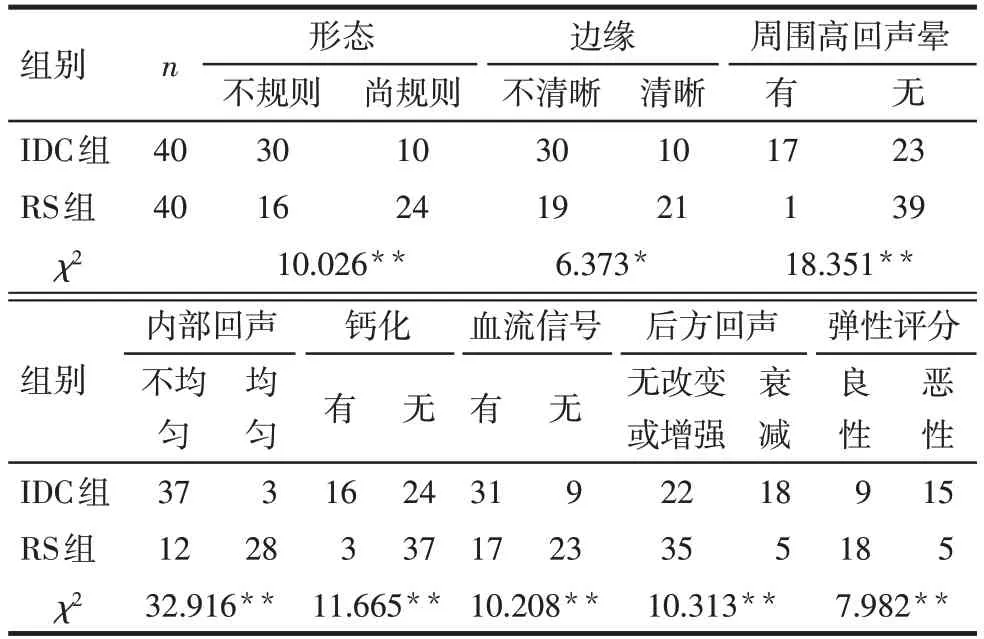
Tab.2 Comparison of ultrasound features between RS group and IDC group表2 2组超声特征比较 (例)
2.3 ROC曲线及诊断效能分析 ROC曲线结果显示,二维超声BI-RADS分类、彩色血流信号和弹性评分三者联合对RS和IDC的诊断效能较好,见表3、图1。
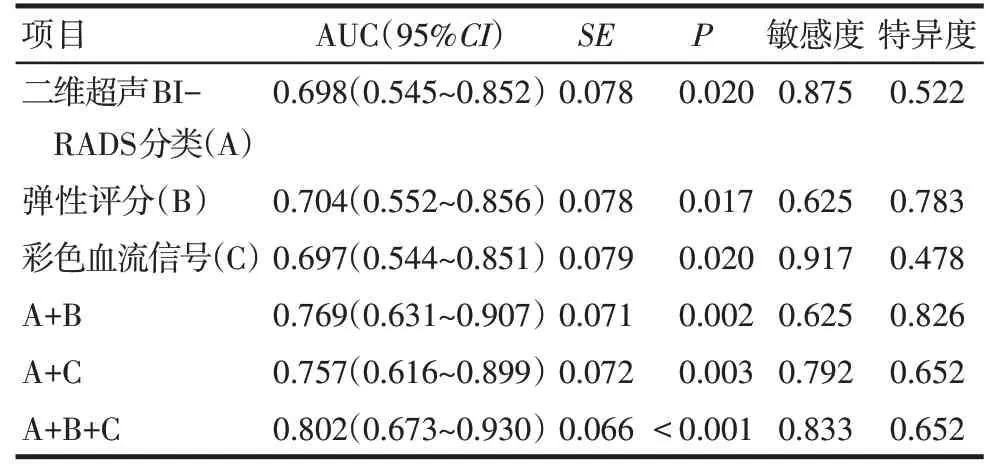
Tab.3 The predictive value of five variables for RS and IDC表3 5种变量对RS和IDC的预测价值

Fig.1 ROC curve analysis of two-dimensional ultrasonic BI-RADS classification,color doppler flow signal and elasticity score for the diagnose of RS and IDC图1 二维超声BI-RADS分类、彩色血流信号与弹性评分诊断RS与IDC的ROC曲线分析
3 讨论
3.1 RS及IDC的临床特征 乳腺RS常见于40~60岁女性,其临床表现各异,是一种独立的病理类型[4],肉眼和镜下改变易与乳腺癌混淆。乳腺RS与手术、脓肿或外伤后形成的瘢痕不同。目前对其形成原因主要有以下几种观点:(1)不明原因损伤导致纤维化和周围乳腺组织回缩。(2)与导管扩张和闭塞相关。(3)慢性炎症反应[5]。而Cawson等[6]认为RS是正常间质结构和上皮组织的重新排列。本研究中乳腺RS组40~60岁的患者34例(85.0%),提示RS常见于中青年女性。RS组和IDC组的临床表现均多为乳腺肿物,2组间基线特征差异无统计学意义,仅依靠临床特征很难鉴别。
3.2 RS组和IDC组超声特征对比研究 RS的影像表现缺乏特异性,目前其主要影像检查包括超声、全数字化乳腺X线摄影、乳腺磁共振成像。有研究表明,超声检查对RS的检出率较乳腺X线更高[7]。本研究中40例乳腺RS病灶均被超声检出。相关研究报道RS超声多表现为低回声、边缘不清晰的不规则团块,可伴或不伴后方回声减低[8]。本研究显示,与IDC组比较,RS组超声图像更多表现为形态尚规则、边缘清晰的低回声结节或团块,但两者的超声图像亦存在一定重叠。本文中RS组40.0%(16/40)形态不规则,47.5%(19/40)边缘不清晰,笔者认为可能与RS是一种假浸润性病变,中央区纤维瘢痕组织呈不规则形伸入病变周围乳腺实质,使增生的腺管放射状排列的病理特征有关。而IDC呈恶性侵袭性生长,因此其超声多表现为毛刺或蟹足样边缘的不规则肿物。
本研究中RS组的超声图像较IDC组更多表现为肿物周围无高回声晕、内部回声均匀、不伴钙化。42.5%(17/40)的IDC患者超声征象可见周围高回声晕,可能与IDC为恶性病变,其向周围组织浸润时引起不同程度的间质反应有关[9]。RS为良性病变,周围无反应性增生,故少见高回声晕。本文中RS组2.5%(1/40)有周边高回声晕,笔者认为可能与超声为主观检查,对于一些特征的描述存在误差有关。IDC因肿瘤组织液化坏死及浸润性生长破坏周围组织结构,较RS组更易出现回声不均征象。RS组病灶内的钙化检出率明显低于IDC组,与胡岚雅等[10]的报道一致,其研究亦显示RS组多为粗大强回声钙化点,分布稀疏,IDC组多为粗细不等、密集分布的强回声钙化点。
本研究中所有患者均常规行彩色多普勒血流检查,RS组血流信号检出率较IDC组低,与肿瘤组织生长活跃血供丰富有关。目前临床上常用Adler半定量法判定乳腺病灶血流信号丰富程度,相关研究认为乳腺肿物内部血流信号不仅与恶性肿瘤相关,而且也受肿物大小、组织分化程度、患者年龄等因素的影响[11],因此不能依靠单一指标鉴别RS和IDC。本研究中47例(47/80)行超声弹性成像检查,IDC组中弹性评分≥4分的病灶较RS组更多,笔者认为与恶性肿瘤分泌生长因子促进间质增生引起组织硬度增大有关。乳腺内不同组织的硬度从大到小依次为浸润性导管癌、非浸润性导管癌、纤维组织、腺体组织、脂肪组织,弹性成像技术可反映病灶组织的硬度,是目前临床鉴别病变性质的重要参数[12-13]。王怡等[14]研究称弹性成像可鉴别部分形态不规则、边缘不清病灶的良恶性。但也有部分研究认为单独凭借弹性成像检查尚不能可靠鉴别RS与IDC,其认为IDC内部液化坏死导致病灶硬度降低,RS间质硬化区较大导致病灶硬度增加,均可引起误诊[15-17]。本文样本量较小,且此技术受到操作者经验影响,以及目前所采用弹性评分方法仍需完善,因此有待进一步研究证实。
3.3 ROC曲线及诊断效能分析 本文分析了RS与IDC超声特征的异同,因2种病变在形态学、血流信号、弹性评分等方面存在重叠,笔者认为此重叠性与RS的临床和病理特点相关,单独依靠某个征象易误诊。ROC曲线分析结果显示二维超声BI-RADS分类、血流信号及弹性评分三者联合对2种病变的诊断效能更好,可在一定程度上提高RS与IDC的术前超声鉴别诊断率。
综上所述,本研究显示,RS组和IDC组临床症状均多表现为乳腺肿物,RS常见于40~60岁中青年女性。2种病变的超声特征存在差异,但其超声图像间亦存在一定重叠。结合二维超声BI-RADS分类、彩色多普勒血流、弹性成像进行综合诊断,有助于提高对RS和IDC的鉴别诊断水平。

