黄斑裂孔研究进展
孙天洋,格日勒图
•KEYWORDS:macular hole; pathogenesis; diagnosis; parting; treatment
0引言
黄斑裂孔(macular hole, MH)是指视网膜黄斑中心凹区的解剖开口,从内界膜(internal limiting membrane, ILM)到光感受器外段的全层缺损[1]。根据病因分为特发性黄斑裂孔(idiopathic macular hole, IMH)和继发性黄斑裂孔,IMH是指原因尚未明确的黄斑中心凹全层神经视网膜缺损,继发性黄斑裂孔多由眼外伤、高度近视、黄斑毛细血管扩张症和葡萄膜炎等所致[2]。临床表现为视力下降、由感光细胞离心位移引起的视力变形和中心凹裂孔所致的中心暗点等视力损害[1,3-4]。有关该病发病率的报道不一,TheBlueMountains报道为0.02%,TheBaltimoreEyeStudy报道为0.33%[4]。根据以往的流行病学调查和临床报告,女性发病率高于男性,男女比例为1∶6,这可能与女性发生玻璃体完全后脱离(posterior vitreous detachment, PVD)的时间比男性晚有关。Van Deemter等[5]证实50岁以上女性的玻璃体戊二胺积聚较快,这与PVD不完全有关。MH极大地降低与视力健康相关的生活质量[6]。
1 MH的发病机制
MH早期被认为是不可治疗的疾病,在1991年Kelly和Windel首次描述玻璃体切除治疗MH[2,7]。根据对MH形成过程的研究,MH的发生与玻璃体黄斑界面的紊乱有关,早期由于异常的玻璃体黄斑黏连(vitreomacular adhesion, VMA)产生动态牵引力,在纵向上胶原纤维的收缩将产生向玻璃体中心的牵引力,最终使得Müller帽撕脱,使其失去对Müller细胞保护视网膜的功能。黄斑中心凹组织学缺损视网膜内层结构,使其更容易受到渐进性向玻璃体中心方向牵引力的影响。A-P牵引力(anterior-posterior traction)大小与周边部玻璃体后脱离面积呈负相关,这种对A-P的前后方向的牵拉,导致黄斑中心凹囊肿的形成,在牵引力持续不变时,引起视网膜中心凹的解剖缺损。在MH形成后,玻璃体后皮质表面切向牵拉和ILM上增殖的胶质细胞收缩将进一步导致裂孔扩张[1,4]。
2 MH的诊断及分型
1991年由Huang等[8]应用光学相干断层分析成像(optical coherence tomography, OCT)技术首次描述黄斑结构以来,OCT技术已成为眼科后极部可视化检查的重要诊断依据。随着OCT技术改进与发展,高分辨率成像技术使得对视网膜结构进行逐层扫描。目前OCT已经成为诊断IMH的金标准[9],一方面通过对后部玻璃体与视网膜关系的细节可视化来评估MH形成的病理生理学,另一方面对MH的大小实现准确的测量[2]。通过术前OCT参数预测裂孔的可能闭合情况和术后视功能,有报道认为最佳预测因子为裂孔最小直径和基底径[10]。这对指导MH患者的手术治疗方案的选择具有重要意义。对于MH高度是否可以预测手术效果,以前的报告给出了不同的结论[6]。对于修复后的MH闭合情况,OCT也能反映其预后效果。Imai等[11]将修复后的MH闭合情况分成3类:中心凹为U型的表示轮廓正常,中心凹为V型的表示轮廓陡峭,中心凹为W型的表示中心凹神经感觉层视网膜缺损。U型预后最好,W型预后最差。此外,光谱域光学相干断层扫描(spectral domain-OCT, SD-OCT)可以提高图像采集速度和轴向分辨率,从而提高检测玻璃体-视网膜界面细节的灵敏度[9]。光学相干断层扫描血管成像(optical coherence tomography angiography, OCTA)是建立在OCT上的提供视网膜和脉络膜内血流的高分辨图像[12]。国际玻璃体黄斑牵引研究(the international vitreomacular traction study, IVTS)认为孔的最小直径是MH闭合最具预测性的参数,2013年,IVTS提出了根据OCT的解剖学分类系统,在MH最大直径处测量孔两侧最窄处两点之间的距离作为黄斑孔的大小[2,13],分为小型(≤250μm)、中型(>250μm和≤400μm)和大型(>400μm)。此外,GASS根据MH的发展提出了相应的分期,详见表1[14-15]。Freeman等[16]发现,直径较小的MH与较好的功能结果相关,而Houly等[17]认为SD-OCT中外界膜缺损的大小是预测MH术后视力的最强指标。
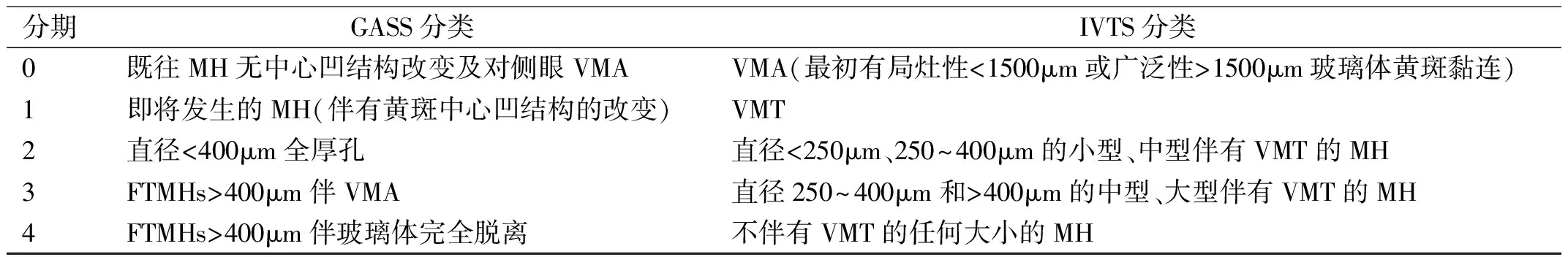
表1 IMH的GASS分期与IVTS分类对比表
3 MH的愈合过程和闭合模式及预后
MH愈合是指视网膜组织向中心凹的向心运动[18],组织学上促进孔洞愈合的关键因素是胶质细胞[10]。Rossi等[19]提出的分别来自外核层和神经纤维层的胶质细胞是最有可能沿玻璃体和视网膜边界迁移和增殖的细胞系。同样Michalewska等[20]发现神经胶质细胞的增殖,并进一步发现了由胶质细胞增殖产生的环境,可以将光线从视网膜表面传递到感光细胞层。感光细胞层是信号转导通路初始阶段的起源,在MH中感光细胞的损伤可导致视觉失真,可显著降低了阅读和辨别能力[1]。这些文献证实了胶质细胞在孔洞闭合中的关键性作用。Zhu等[10]将MH全程愈合分为三个阶段,第一阶段:ILM对神经视网膜的牵引解除,视网膜内囊肿消失;第二阶段:视网膜的内部生长到黄斑中心,两边缘形成组织桥连接,视网膜下液(subretinal fluid, SRF)仍存在;第三阶段:SRF被溶解,光感受器开始重塑,可能会有一个完整的椭圆形区域。发现MH在术后3~5d内裂孔周围的神经视网膜层向中心长入并相互连接,达到解剖闭合,若术后2wk左右仍未闭合,裂孔可能进一步扩大[10]。而在Cheng等[13]的报道中最早可在术后24h闭合。MH由于组织解剖中存在不同程度的破坏,特别是对外界膜(external limiting membrane, ELM)、椭圆体带(ellipsoid zone, EZ)和光感受器外节(outer segment, OS)的破坏,是视力致残的解剖学因素。视功能的改善依赖术后黄斑区视网膜结构的完整恢复[21]。解剖结构和功能的恢复为渐进性修复,ELM的恢复早于EZ和OS的恢复,ELM需要1~3mo完全恢复,EZ的完全恢复需要12mo[22],EZ是影响术后最佳矫正视力的结构特征[23]。MH的预后通过OCT对EZ、ELM和OS扫描可发现,规则、连续的高反射代表预后良好,缺失、不连续的低反射则预后差[23]。视功能预后依靠视力检查、视野检查、多焦视网膜电图(multifocal electroretinogram, mfERG)评估黄斑区手术前后的功能敏感度,检测和量化中心视锥功能[24-25]。随着MH的愈合,可表现不同的闭合模式,Kang等[26]在2003年将其分为两种模式:1型闭合是指完全闭合且无神经感觉性视网膜缺损;2型闭合是指位于MH边缘的神经感觉视网膜边缘附着在视网膜色素上皮(retina pigment epithelium, RPE)上,但伴有神经感觉视网膜的中心凹缺损,即解剖学上开放的MH[2]。由于其他类型佐剂塞子的引入,Rossi等[20]提出了第三种闭合模式,作为分层佐剂诱导的新型瘢痕形成的结果,因此提出要在Kang的[26]分类基础上,需要由外到内具体细分哪一层已恢复。
4 MH的治疗
4.1药物治疗对于早期微小的IMH,给予改善微循环、营养神经等药物保守治疗后可能自愈。同样Smiddy等[27]也发现早期MH可以通过视网膜组织连接自我修复。自我修复失败的裂孔,视网膜胶质细胞会移动到孔洞边缘,使孔洞逐渐缩小[10]。
4.2基本手术方式玻璃体切除术(pars plana vitrectomy, PPV)治疗MH的技术在1991年由Kelly和Windel等描述,其闭合率为50%。随着器械与手术方式不断改良,MH闭合的成功率有了显著的提高,去除ILM是一项重要的进步[28]。目前平坦部PPV联合ILM剥离、眼内填塞和术后保持俯卧位仍然是治疗MH的基本手术方式,也是首选方法[29]和黄金标准[30],初次手术后闭合率高达90%[18,31-32]。剥离ILM是为了减轻作用于中心凹的牵引力,还可以增强视网膜和Müller细胞胶质增生的延展性。这与通过移除玻璃体残余皮质和内界膜上的纤维细胞有关,并促进胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)表达,GFAP是胶质细胞增殖和迁移的前体,再通过剥离损伤视网膜来促进胶质细胞的增殖和迁移[19]。而填塞和定位的类型应根据MH的大小、晶状体的状况和患者的整体情况进行选择[3]。剥离ILM去除Müller细胞基板,会出现部分Müller细胞功能障碍,不良事件如偏心性黄斑旁裂孔、黄斑小暗点和视网膜凹陷。
4.3难治性MH手术方式难治性MH包括初次手术未能关闭或者成功关闭后重新开放的MH,其危险因素包括:大型的全层黄斑裂孔(full thickness macular hole, FTMH),MH持续时间长,多次手术效果差,外伤性MH,高度近视,术中视网膜裂孔,黄斑囊样水肿和葡萄膜炎或玻璃膜疣的FTMH[24]。采用基本手术方式治疗仍存在裂孔未愈合,视力未得到改善。对于MH初次手术未能闭合的发生率为0~39%[30],在这些复杂病例中失败可能是由于神经视网膜长期脱离于RPE层、以及包括视网膜神经节细胞和光感受器等细胞成分的损害所致[33]。使其自我修复能力变差,进而不能得到有效的视力康复。难治性MH手术成功率低,解剖闭合率为46.7%~68.9%,影响因素包括玻璃体黄斑牵引残留、填塞不足、保持俯卧位时顺应性差等[24]。近几年,国内外已经提出了多种治疗策略,难治性MH的二次尝试可选择术式包括:应用自体浓缩血小板、ILM倒置皮瓣技术、硅油填充术、或者自体神经感觉神经视网膜游离皮瓣移植技术等[34]。目前,以上手术方法能够解决慢性、大面积和持续性的MH的解剖复位[24],然而功能的恢复仍不是非常乐观,有待研究,探讨和改进。
4.3.1ILM倒置皮瓣技术ILM倒置皮瓣技术是治疗大型MH和近视性MH的一种有效方法,将MH闭合率提高到98%[2]。由于ILM的边缘附着在孔的边缘,作为胶质增生的支架,有助于肌成纤维细胞、纤维细胞的增殖,并为增生的胶质细胞提供基底膜,增殖的胶质细胞填充MH[2,35]。理论上随着时间的推移胶质细胞充满大的MH,以维持中心凹的解剖结构完整性[2]。一项单臂Meta分析中,使用内界膜瓣技术治疗大型MH(>400μm),闭合率为95%,视敏度(visual acuity, VA)改善率75%,证实内翻式ILM皮瓣技术是治疗大型MH的有效方法[36]。ILM倒置皮瓣技术有两种变体:当ILM皮瓣在单层MH间隙上外翻时为覆盖,当ILM折叠成MH内多层时为填充,两种的闭合情况同样有效。覆盖不仅可以为重建的胶质细胞滑动和生长因子汇聚的利基环境提供“屋顶”作用而更好地闭合裂孔[37],而且不会干扰视网膜外层的愈合过程,封闭的隔室,使RPE能够泵出液体并保持孔干燥,从而有较好的视觉效果[7]。Park等[38]发现与ILM植入技术相比,倒置皮瓣技术能够更好地恢复感光层,并获得更好的功能结果。对于较大MHS(>700μm),填充既可以重建封闭环境,又能帮助裂孔的恢复[37]。将ILM瓣塞进孔洞,可能会损害MH底部的RPE,影响视觉效果。Schubert等[39]证明台阶、斜坡及缝隙等因素是神经胶质细胞迁移的障碍,因此ILM瓣会起到滑动和堵塞填充的桥梁或支架的作用。Rossi等[40]在不同的ILM瓣手术中发现ILM层填充MH,较大的MHS更容易闭合,De Novelli等[41]同样证实ILM瓣移植治疗大、慢性、难治性MH是一种有效的治疗方法,有研究中的Meta分析表明,对于大型MH,玻璃体切除加ILM瓣倒置技术比ILM剥离有更好的解剖学愈合效果[7]。
4.3.2视网膜细胞移植术视网膜细胞移植用于治疗视网膜退行性疾病,有助于晚期MH闭合。其原理为通过干细胞、前体细胞和成熟的神经视网膜细胞来替代丢失的视网膜细胞。骨髓间充质干细胞(mesenchymal stem cells,MSC)可以促进黏附因子的表达和细胞外基质的发育[36],其悬液和外泌体的神经保护特性,促进MH与RPE的黏连,促进闭合[36]。Hara等[42]和Yamana等[43]首次将人类脂肪来源的MSC用于兔视网膜裂孔模型,恢复了兔视网膜裂孔解剖结构的完整性。在Zhang等[44]的研究发现MSC和MSC来源外切体(mesenchymal stem cells-exosomes,MSC-Exos)可能有助于孔洞闭合和视功能恢复。有研究通过MSC注射在兔视网膜裂孔模型的实验,提出MH愈合过程是由MSC表达的具有抗凋亡功能的细胞因子促进的,并与细胞外基质的发展有关,如细胞间黏附因子等[33, 45]。自体MSC应用的禁忌证为先前存在的肿瘤,会因为MSC的免疫抑制促进其生长[33]。
4.3.3硅油或重质硅油填充术MH术后患者需要保持俯卧位,大多数患者在长时间保持俯卧位时会感到不适和不顺从,甚至不能保持俯卧位。硅油填充术适合于不能严格遵循术后俯卧位的患者,在初次MH的手术中,使用硅油临时填塞MH可使MH闭合率达到86%~92%,而在MH持续性闭合方面,重质硅油填充术优于传统硅油。据报道,永久性MH重质硅油填充术的闭合率在46%(16/35),82%(9/11),87%(20/23),和92%(11/12)[29]。
4.3.4自体血液或血浆填充术自体血液或血浆的适用于治疗失败的MH,特别是对于无法保持俯卧位的患者,机制尚不完全清楚,可能与血小板在Müller细胞二次迁移或增殖过程中释放的生长因子有关[46]。Chakrabarti等[47]描述了由自体葡萄糖化血塞(autologous gluconated blood plug, AGBL)组成的黄斑塞子,在26例较大MH的患者中,利用内翻型ILM瓣和AGBL形成黄斑栓塞术中百分百闭合了孔洞。Lai等[48]对27例高度近视性MH伴视网膜脱离(high myopic macular hole-induced retinal detachment, HMMH-RD)的患者,通过使用自体血液治疗,一次手术后最终闭合率为96%。Schaub等[31]报道了35例持续性MH患者使用自体浓缩血小板(autologous platelet concentrate, APC)加气体填充或六氟化硫填充的疗效,闭合率分别为57%和45%。
4.3.5气体填充气体是初次MH手术的首选填充物[29]。在大型MHS玻璃体手术操作结束时使用,包括消毒空气和长效气体如C3F8或SF6。长效气体存在高眼压和继发性白内障的风险。空气填充目前认为是治疗中、大型MH的一种安全有效的方法[13]。2017年,Hejsek等[49]在17例MH患者中,除1例MH外,均在一次空气填塞后完全愈合。2020年,Yu等[50]在MH合并空气填塞的3期和4期患者中,89.63%的患者在一次空气填塞术后裂孔关闭,并发现与最初未关闭的病例相比,关闭的病例的症状持续时间明显缩短。
4.3.6人羊膜覆盖术目前,人羊膜(human amniotic membrane, HAM)可以诱导视网膜外层的ELM和EZ的恢复用于治疗难治性MH,且不会出现免疫应等术后并发症[30]。Rizzo等[51]通过HAM技术治疗了8例手术后失败的MH,获得了100%的闭合率。2019年,Caporossi等[52]用HAM治疗10例HMMH-RD患者,MH闭合率和视网膜复位率均为100%。
4.3.7自体晶状体囊膜术自体晶状体囊膜术的优点是更薄的囊膜瓣在处理和插入孔洞方面相对容易[53],Chen等[54]在20例接受晶状体囊膜碎片移植治疗的患者中6例复发的HMMH,闭合率为100%。Peng等[55]在晶状体囊膜瓣移植加自体全血移植治疗10例HMMH-RD患者,1例(10%)患者治疗失败。
4.3.8自体游离神经感觉视网膜移植术目前,自体游离神经感觉视网膜移植术(autologous neurosensory retinal-free flap transplantation, ANRFFT)作为一种新技术,被用作治疗大型MH或持续性MH的一种选择[13]。通过使用自体神经感觉性视网膜游离皮瓣,并将其放置在MH上,同样是提供支架作用,其缺点是需要视网膜切除术,在排除视网膜下液体的同时提供视网膜瓣组织。Grewal等[56]在2015年描述包括使用自体神经感觉性视网膜游离瓣闭合难治性近视MH,闭合率为88%(36/41)。Chen等[53]在全氟碳液的辅助下初步得出结论:ANRFFT可能是治疗伴有复杂视网膜脱离(retinal detachment, RD)的MH的一种较好的选择。
综上所述,MH是造成视力损伤、视功能缺损,严重影响生活质量的疾患,对于MH的认识从不可治疗到能手术治疗,并且手术方法不断改进,使手术方式的选择性更加多样化,随着MH愈合率的提高,视力恢复率也不断提高。
5展望
随着人们对MH的发病机制、愈合过程等的认识逐渐深入,大大提高裂孔闭合率。然而,目前国内外由于研究规模小,病理变化多样,很难从各个研究中比较治疗MH的最佳手术方法。对于中小型、单纯MH,通过基本手术方式,成功率可达90%[15],而改良的手术方式显著提高慢性、大面积和持续性MH的闭合率。术前MH直径是影响裂孔愈合的重要因素[10]。目前尚存在的手术失败的原因有:裂孔直径过大、症状持续时间长、危险因素存在、气体填充不足、残留的ILM或后玻璃体未完全切除、保持俯卧位依从性差和无意的机械损伤等均可导致手术失败以及并发症的发生[57]。对于定量评估MH手术后EZ完整性等参数,目前针对其研究少,未来发展趋势需要进行更加详细的视网膜外层前瞻性研究,以更全面了解影响术后的视觉效果因素[58,更好地为眼底病手术医生提供有效的个体化诊疗策略,进而为MH患者视功能的恢复提供有利的保障。

