海洋球石藻(Emiliania huxleyi)活性物质分离鉴定及其抗菌抗氧化性能研究*
刘静雯 吴书燕 马亚瑞 张恩权 李桂玲 李 健
(集美大学海洋食品与生物工程学院 厦门 361021)
微藻在生长过程中合成蛋白、多糖等大分子活性化合物的同时, 也合成一些高活性的有机小分子, 特别是微藻中的小分子次级代谢产物, 在功能性食品和药物开发领域具有重要应用潜力。研究表明, 很多微藻提取物和胞外产物具有抗菌、抗原生动物和疟原虫等抗生性(李小姣等, 2021)。微藻中已发现的具有抑菌性的物质主要包括多糖、萜烯类、酚类、肽类及脂肪酸类等(Smithet al, 2010; Guzmánet al, 2019)。海洋球石藻(Coccolithophores)类群隶属于定鞭藻纲(Prymnesiophyceae), 是一类单细胞海洋微型浮游植物。其中, 球石藻Emiliania huxleyi因其具有形成“球石粒”和高产二甲基硫化物(DMSP)的能力, 几乎每年都在大洋中形成大面积“白潮(white tides)”, 而特异性病毒的感染和裂解被确认是终止球石藻“白潮”的一个重要因素。因此海洋球石藻及其病毒的相互作用在海洋碳、硫生物地球化学循环及全球气候变化中具有重要作用(Tonget al, 2018)。新近研究发现, 病毒感染能够显著影响球石藻宿主细胞中鞘脂、脂肪酸、萜类以及固醇类等物质的代谢(Rosenwasseret al, 2014;Zenget al, 2019), 表明病毒可能通过改变宿主的代谢途径积累或降解某些活性化合物的水平以利于病毒的感染、复制和组装。球石藻除了在海洋生态研究领域备受关注外, 还能够产生丰富的次级代谢产物(Thøgersenet al, 2018), 如二十二碳六烯酸(DHA)、萜类(Onoet al, 2009; Sayanovaet al, 2011; Kotajimaet al, 2014)、聚酮类(Nakamuraet al, 2016; Zhenget al,2016)及长链基中性脂(Eltgrothet al, 2005)等化合物。这些化合物具有良好的抗炎、抗菌、抗肿瘤、抗病虫害及改善免疫力等生物学活性, 在生物医药、食品营养及农业病虫害防治等领域有广阔的应用前景。此外,该藻胞外覆盖数层以 CaCO3为主要成分的球石粒(Coccolith), 其具有独特的纳米级超微结构及光学特性, 有望作为光电通讯和人工骨骼技术研究领域的新型材料。上述有关海洋球石藻活性物质的研究主要集中于不同培养条件下活性组分含量的测定, 较少报道相关活性物质的分离、结构鉴定及生理功效。本文首次对一株分离自挪威海域的低温海洋球石藻E.huxleyiBOF92 进行了活性成分的研究, 从其具有较好抗菌活性的乙酸乙酯提取物中分离获得了3 个单体化合物, 通过波谱学技术对其结构进行解析和鉴定, 并对其体外抗菌、抗氧化生物学活性进行初步分析。
1 材料与方法
1.1 仪器与试剂
核磁共振仪(瑞士Bruker, Av400)、高分辨质谱(美国Thermo, MAT95XP)、红外光谱(中国, FTIR-1500),旋转蒸发仪(德国IKA, RV8)和高效液相色谱HPLC(日本岛津, LC-10AT)。薄层硅胶GF254 和柱层析硅胶购自青岛海洋化工有限公司, Sephadex LH-20 为美国GE Healthcare 产品, 高效液相色谱使用色谱纯甲醇, 其他试剂均为国产分析纯。
1.2 测试菌株及细胞株
枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichis coli)及副溶血性弧菌(Vibrio parahemolyticus)菌种均由集美大学微生物实验室提供。人肝癌细胞Hep G2 和正常肝细胞LO2 购自中国科学院细胞库。
1.3 海洋球石藻及其培养
海洋球石藻E. huxleyiBOF92 分离自挪威Raunefjord 海域。藻株培养采用f/2-Si 培养基培养(http://ccmp.bigelow.org/CI/f2_family.htm), 海水经0.22 μm 滤膜过滤后于115 °C 高压灭菌30 min, 光照采用白色LED 光源, 光强度为~60 μE/(m2·s), 光周期14 L:10 D, 培养温度(16±2) °C。培养至稳定生长期进行样品采集, 使用圆盘过滤器收集过滤于2.0 μm 滤膜上的藻细胞, 经冷冻干燥制成藻粉。
1.4 活性化合物的分离纯化
称取200 mg 冻干的藻粉, 室温下用75%的乙醇浸泡提取获得乙醇浸膏, 浸膏分别用乙酸乙酯、石油醚及正丁醇进行萃取, 萃取液抗菌活性检测结果显示, 乙酸乙酯相具有较好的抗菌活性。因此, 用乙酸乙酯萃取后收集上层粗提物4.26 g, 浸膏用适当体积甲醇溶解后, 进行反向硅胶柱层析(100—200 目), 以甲醇梯度洗脱, 根据薄层色谱(TLC)结合合并组分,获得6 个一级部位(A—F)。经过反复Sephadex LH-20凝胶柱层析, 正、反相硅胶柱层析以及制备薄层层析(PTLC)分离纯化, 从C 段得到化合物1 (3.5mg)和化合物2 (2.3 mg), 从E 段获得化合物3 (3.4 mg)。
1.5 化合物的结构解析
运用红外光谱、核磁共振及高分辨质谱等波谱技术, 参考文献报道对分离获得的3 种单体化合物进行结构分析和鉴定(郑晓珂等, 2005; 邓思娟等, 2008;石妍等, 2008; Sarpeet al, 2011; 赵明等, 2014)。核磁共振样品中加入氘代试剂进行溶解, 核磁测定碳谱和氢谱, 包括13C-NMR、DEPT、HMBC、NOSEY、HSQC、1H-NMR 及1H-1HCOSY。用于高分辨质谱分析的样品, 采用甲醇溶解, 浓度 10—100 pg/μL(50 μL), 红外光谱分析采用KBr 压片法。
1.6 体外抑菌及抗氧化活性分析
1.6.1 体外抑菌实验 牛津杯法: 吸取50 μL 受试菌悬液加入灭菌的平板中涂布均匀, 每个板放置3 个牛津杯, 加入0.2 mL 浓度为50 mg/mL 的单体化合物待测样品, 于37 °C 培养过夜, 测量抑菌圈大小。
最低抑菌浓度(MIC)测定: 采用试管二倍稀释法制备不同浓度的药液, 接种供试菌。以培养基中不加待测化合物样品为受试菌对照、不加受试菌液的样品为对照。以不显示浑浊、完全无菌生长的待测样品浓度为药物对该菌株的最低抑菌浓度。
1.6.2 体外抗氧化活性 DPPH (1,1-二苯基-2-三硝基苯肼)自由基清除实验: 将上述分离获得的3 种化合物样品稀释成质量浓度分别为5、10、20、50、75、100、150、200 μg/mL 的待测溶液, 维生素C 稀释成浓度为2、5、10、20、40、80、160 μg/mL 作为对照组。根据DPPH 法(彭长连等, 2000), 在96 孔板上加入待测样品, 黑暗条件下反应30 min, 在酶标仪上测定517 nm 波长下的吸光值A0(空白对照的吸光度)、Ai(DPPH 溶液与样品溶液的吸光度)、Aj(甲醇与样品溶液的吸光度) 。 根据公式: 清除率=[1-(Ai-Aj)/A0]×100%, 计算样品对DPPH 自由基的清除率, 以样品浓度为横坐标, DPPH 自由基清除率为纵坐标, 绘制曲线图计算IC50值。
ABTS+(2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸)自由基清除实验: 根据ABTS 法(朱玉昌等, 2005)制备ABTS 工作液, 在96 孔板上分别加入10 μL 待测样品和200 μL ABTS 工作液, 室温孵育2—6 min, 以80%乙醇和ABTS (1︰20)工作液的吸光值作为空白对照, 在酶标仪上测定734 nm 下的吸光度Ax, 空白对照A0, 根据公式: 清除率=[(A0-Ax)/A0]×100%, 计算样品对ABTS 自由基的清除能力, 以样品浓度为横坐标, ABTS 自由基清除率为纵坐标, 绘制曲线图计算IC50值。
1.6.3 细胞毒活性试验 实验选用正常肝细胞LO2和肝癌细胞Hep G2 株系, MTT 法检测细胞活力。制备20 μg/mL 三种单体化合物溶液, 阳性对照为顺铂(2 μmol/L), 每个样品设置三个重复。细胞接种于96 孔板后于CO2培养箱内37 °C 培养24 h, 每孔加入20 μL MTT 溶液, 37 °C 培养4 h。移去上清, 每孔加入150 μL DMSO, 37 °C 震荡培养2 h, 于酶标仪490 nm 测定光密度(OD490)值, 计算抑制率。抑制率%=(1-实验组平均OD 值/对照组平均OD 值)×100%。
2 实验结果
2.1 化合物分离纯化结果
组分C (1 146 mg)采用65%、70%、75%、80%和85%梯度的甲醇溶液进行反相硅胶柱层析, 基于薄层层析得到组分C-1 (356.2 mg)、C-2 (80.3 mg)、C-3 (121.3 mg)和 C-4 (435.8 mg)。将组分 C-1(356.2 mg)再次经过Sephadex LH-20 层析、反相硅胶柱层析、正相硅胶柱层析、TLC 显色合并、再利用PTLC 方法得到化合物1 (3.5 mg)(展开剂为石油醚:乙酸乙酯=8:1) (图1a)。将组分C-4 (436.8 mg)经过Sephadex LH-20 层析、正相硅胶柱层析、利用PTLC得到化合物2 (2.3 mg)(展开剂为正己烷:乙醚:冰醋酸=80:20:2) (图1b)。组分E (306.1 mg)经过Sephadex LH-20 层析、反相柱层析、正相柱层析、TLC 显色合并、再经过制备薄层层析 PTLC 得到化合物 3(3.4 mg)(展开剂为石油醚:乙酸乙酯=15:1) (图1c)。

图1 3 种单体化合物TLC 图Fig.1 The TLC diagram of the three compounds
2.2 化合物结构鉴定
化合物1: 浅黄色油状液体, 溶于丙酮、甲醇及三氯甲烷。红外谱结果如附图1: 3 321.95 处的峰宽表征该化合物结构中含有OH; 1 669.09 处较弱的吸收峰值是C=C 的特征吸收带; 736.09 处的吸收峰值表明O-H 是面外弯曲; 2 926.28 和2 868.25 处的C-H 伸缩振动暗示存在CH 饱和基团。HRMS 显示质荷比m/z319.3 [M+Na]+, 推测该化合物的分子量约为296.53(附图2)。波谱数据见表1:1H NMR (400 MHz, CDCl3):0.88(d, 6H), 0.87 (d, 3H)及0.86 (d, 3H)说明有3 个甲基官能团存在于该化合物中; 1.58—0.9 (m, 20H)表明多个亚甲基连在一起;δ1.69 (3H, S)提示该化合物中存在甲基;δ2.01 (t,J=8.3 Hz, 2H)表征该化合物中存在甲基或者亚甲基, 而且在相邻的C 原子上可能含有两个氢原子; 位于δ4.17 (d,J=7.0 Hz, 2H)处有一个化学位移, 表征该化合物骨架中存在一个与氧原子直接相连的亚甲基, 同时在其邻位的C 上连接有1 个H原子;δ5.43 (t,J=7.0 Hz, 1H)表征该化合物结构中存在双键, 与其临近的C 上有2 个质子。以上氢谱结果表明该化合物是一种含有支链的烃类物质。13C NMR(101 MHz, CH3DO): 基于δ-119.13 和δ-136.3, 我们推测该化合物中含有HC=C,δ55.47 则表明-CH2OH 骨架的存在。核磁二维谱图1H-1H COSY 中的δ-5.43 和δ-4.17 偶和相关, 推测化合物结构中存在HOCH2CH=C 骨架。波谱数据与文献(郑晓珂等, 2005;赵明等, 2014)数据基本一致, 因此推断该化合物是叶绿醇C20H40O。结构如图2 所示。
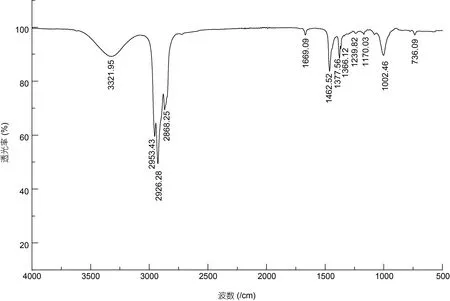
附图1 化合物1 (叶绿醇C20H40O)的红外图谱Appendix Fig.1 The infrared spectroscopy of Compound 1 (C20H40O)
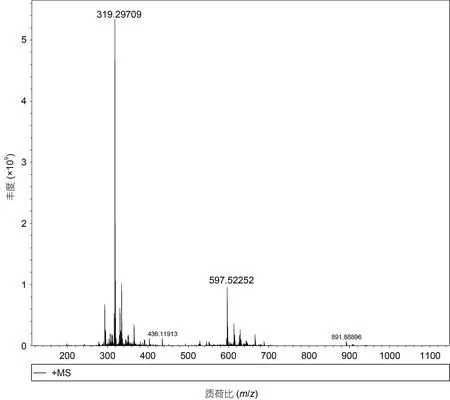
附图2 化合物1 (叶绿醇C20H40O)的HRMS 谱图Appendix Fig.2 The HRMS of Compound 1 (C20H40O)
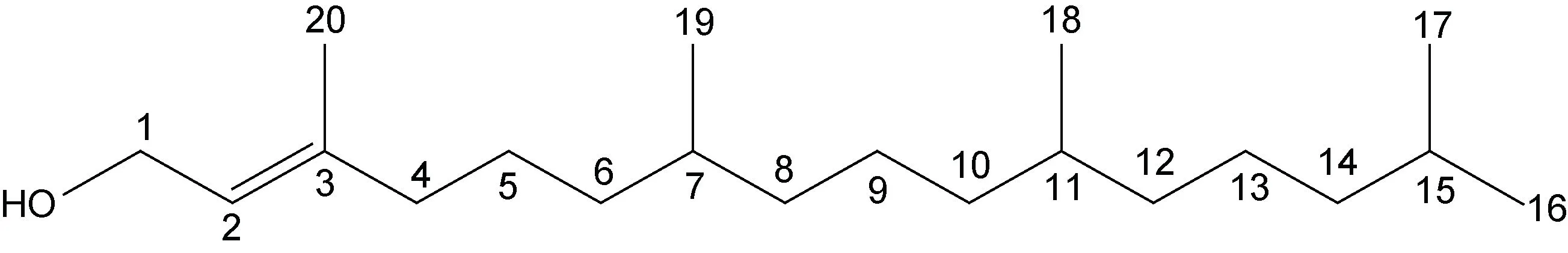
图2 化合物1 的化学结构式(叶绿醇, C20H40O)Fig.2 The chemical structures of Compound 1 (C20H40O)

表1 化合物1 的核磁共振波谱氢谱和碳谱数据Tab.1 The 1H NMR and 13C NMR data of compound 1 (400 MHz, CDCl3)
化合物2: 白色粉末, 加热溶于三氯甲烷。红外谱结果见附图3: 在940.52、1 471.73、1 703.52、2 849.00、2 917.30 和3 418.82 处均有吸收峰。1 703.52是典型的C=O 官能团; 3 418.82 则提示该化合物结构中含有COOH 或者OH。HRMS 显示m/z257.2 [M+H]+,表征该化合物的分子量为256.42 (附图4)。波谱数据(表2):1H NMR (400 MHz, CDCl3):δ0.90—0.86 处的CH3是三重峰,δ1.26 表明该化合物中位于脂肪酸长链中的亚甲基上的氢相互叠加,δ1.63 是多重峰3 位上的CH2,δ2.35 有三重峰, 靠近羧基的氢被临位上的氢裂分形成了饱和氢, 推测其为长链饱和脂肪酸。基于波谱数据和文献资料(邓思娟等, 2008; 石妍等, 2008),确定该化合物为棕榈酸C16H32O2。化学结构见图3。化合物3: 片状晶体, 紫外不显色、易溶于氯仿。红外谱结果见附图5: 在942.16、1 429.90、1 471.68、1 700.59、2 848.94 及2 916.58 处存在吸收峰值。1 700.59 表明该化合物结构中含有 C=O 官能团。HRMS:m/z251.19 [M+Na]+表征该化合物分子量是228.37 (附图6)。波谱数据(表3)和文献(Sarpeet al,2011)中的核磁数据基本一致, 该化合物为肉豆蔻酸C14H28O2, 化学结构如图4 所示。
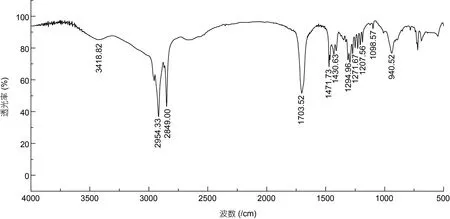
附图3 化合物2 (棕榈酸C16H32O2)的红外图谱Appendix Fig.3 The infrared spectroscopy of compound 2 (C16H32O2)
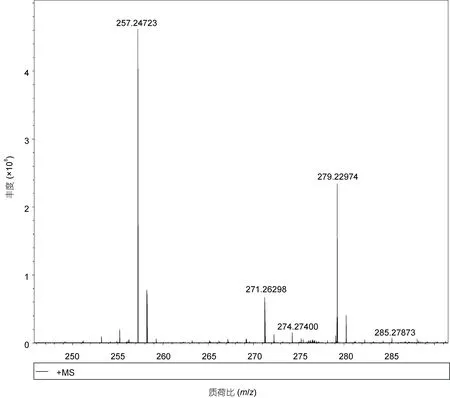
附图4 化合物2 (棕榈酸C16H32O2)的HRMS 谱图Appendix Fig.4 The HRMS of compound 2 (C16H32O2)
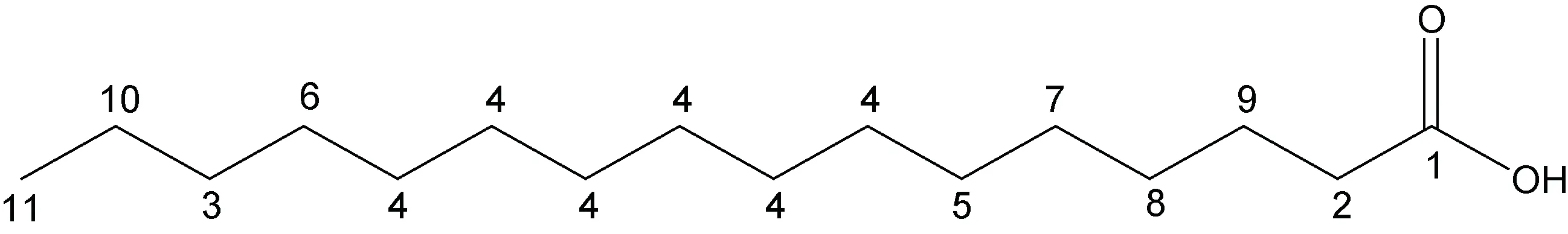
图3 化合物2 的化学结构式(棕榈酸, C16H32O2)Fig.3 The chemical structures of Compound 2 (C16H32O2)
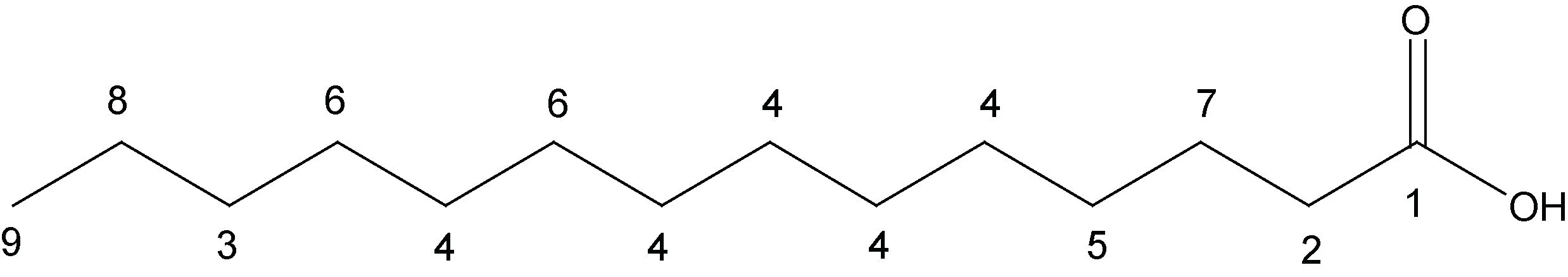
图4 化合物3 的化学结构式(肉豆蔻酸, C14H28O2)Fig.4 The chemical structures of Compound 3 (C14H28O2)

附图5 化合物3 (肉豆蔻酸C14H28O2)的红外图谱Appendix Fig.5 The infrared spectroscopy of compound 3 (C14H28O2)

附图6 化合物3 (肉豆蔻酸C14H28O2)的HRMS 谱图Appendix Fig.6 The HRMS of compound 3 (C14H28O2)
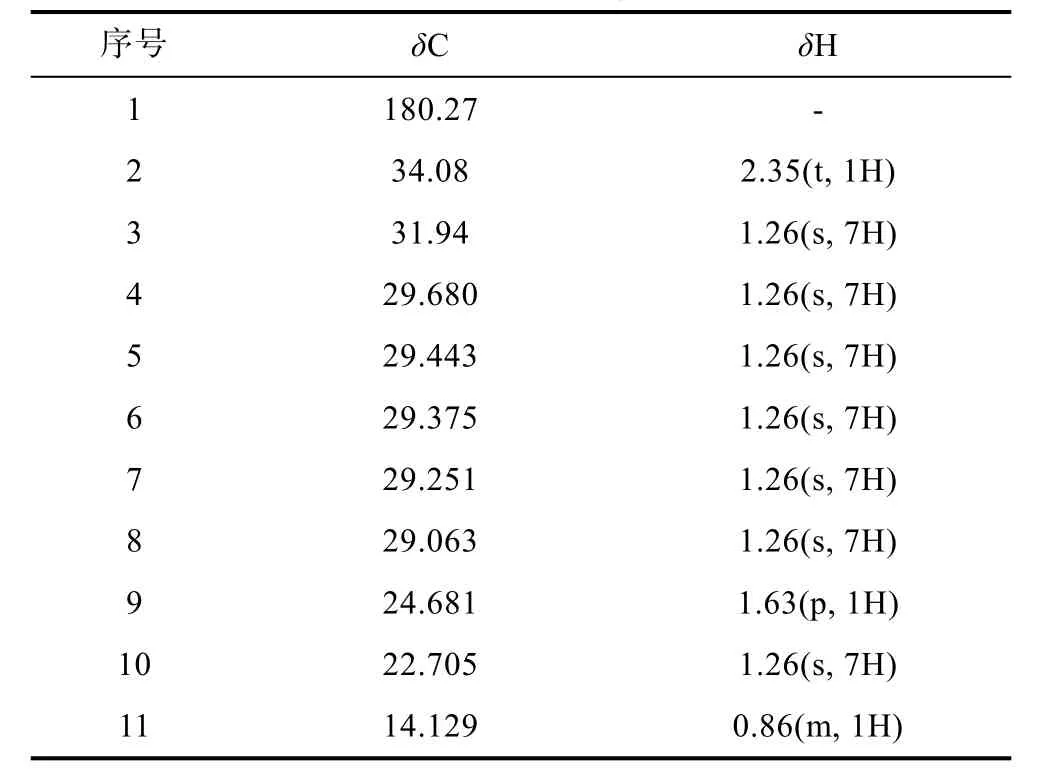
表2 化合物2 的核磁共振波谱氢谱和碳谱数据Tab.2 The 1H NMR and 13CNMR data of Compound 2 (400 MHz, CDCl3)
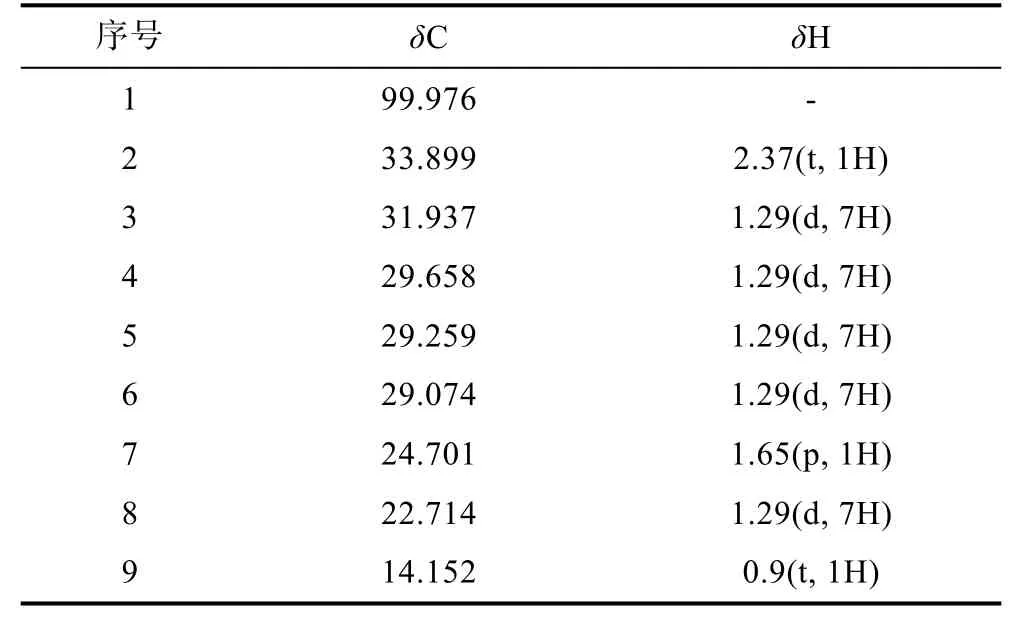
表3 化合物3 的核磁共振波谱氢谱和碳谱数据Tab.3 The 1H NMR and 13CNMR data of Compound 3 (400 MHz, CDCl3)
2.3 单体化合物活性分析
2.3.1 抑菌活性 3 种单体化合物抗菌实验结果见表4, 化合物1 对4 种受试菌基本没有抑菌能力。化合物2 对副溶血性弧菌有较强的抑制作用, 化合物3 对副溶血性弧菌和大肠杆菌生长均有较强的抑制作用。

表4 球石藻三种单体化合物的抑菌活性Tab.4 The antibacterial activity of three monomer compounds from E. huxleyi
MIC 实验结果见表5, 化合物2 能够抵抗副溶血性弧菌的生长, 其MIC 值为10 mg/mL, 化合物3 抑制副溶血性弧菌和大肠杆菌的效果较好, 其MIC 值分别为5.0 和2.5 mg/mL。

表5 球石藻分离组分的MIC (单位: mg/mL)Tab.5 MIC concentration of compounds separated from E.huxleyi (unit: mg/mL)
2.3.2 体外抗氧化活性 采用样品对自由基的半数清除率(IC50)数值表示样品的抗氧化能力, IC50值越小,则抗氧化能力越强。3 种单体化合物中只有化合物1(叶绿醇)具有清除ABTS+和DPPH 自由基能力, 且抗氧化能力较强(图5), 有望作为抗氧化药物的新来源。
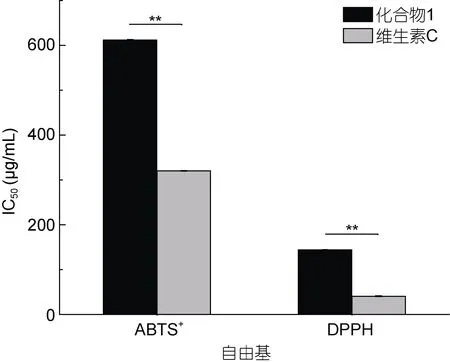
图5 化合物1 的抗氧化活性Fig.5 The antioxidant activities of Compound 1
2.3.3 细胞毒活性实验 细胞毒活性实验结果表明(表6), 3 种化合物对Hep G2 肝癌细胞均有一定的抑制作用, 特别是化合物1(叶绿醇)抑制效果较强,并优于阳性对照顺铂, 高达67.60%, 且对正常肝细胞的毒性也较低。

表6 三种单体化合物对正常肝细胞LO2 和肝癌细胞Hep G2 的抑制率Tab.6 The inhibition rate of the three compounds on LO2 and Hep G2 cells
3 讨论
棕榈酸(又称十六烷酸)作为一种饱和脂肪酸参与生物体的多种代谢过程。对海藻中脂肪酸组成和含量的分析结果显示, 海藻中棕榈酸的含量普遍较高, 最高可占到脂肪酸总量的40% (蔡春等, 1996)。正常球石藻细胞中棕榈酸的含量占总脂肪酸的6%, 在病毒感染的球石藻细胞中棕榈酸含量升高到8% (Evansetal, 2009; Zenget al, 2019)。本文从海洋球石藻中分离获得的棕榈酸对副溶血性弧菌的半数抑制率是12.5 mg/mL, 对肝癌细胞Hep G2 也有一定的毒性。来源于紫海胆中的棕榈酸具有抵抗金黄色葡萄球菌的效果(朱春芃 , 2014)。有趣的是, 病毒感染不仅改变了宿主藻细胞中棕榈酸的含量, 而且能够显著重构球石藻细胞脂肪酸代谢过程, 诱导活性氧产生, 进而损坏细胞膜的完整性, 最终诱导宿主藻细胞凋亡(Bidleet al, 2007; Liuet al, 2018; Zenget al, 2019)。另外, 棕榈酸具有抗病毒作用并能够诱导多种细胞凋亡过程(Leeet al, 2009)。由此可见, 脂肪酸代谢在调控球石藻及其病毒互作过程中具有重要作用, 而棕榈酸则可能在病毒介导的球石藻脂肪酸代谢以及细胞凋亡过程中发挥积极作用。
叶绿醇(也称植物醇)是由四个异戊二烯单位组成的双萜, 是植物叶绿素的一个组成部分。从小球藻中提取的植醇对DPPH 的IC50值为0.716 mg/mL (初金玲, 2017)。从海洋球石藻中分离提取的叶绿醇具有更强的抗氧化活性, 其对于DPPH 和ABTS+自由基的IC50值分别是0.144 和0.612 mg/mL, 并可与抗坏血酸的清除能力相媲美。苜蓿中叶绿醇含量为 13.52%,对·OH 的清除率高达35.45% (葛亚龙等, 2014)。另外,叶绿醇对HELA 和HCT-8 肿瘤细胞的半数抑制率分别是2.04 和3.51 μg/mL (孙杰等, 2007)。本文从球石藻乙酸乙酯相中获得的叶绿醇能够显著抑制肝癌细胞Hep G2 的增殖, 抑制率可达到67.6%, 有望作为肝癌治疗的有效制剂。由此可见, 不同材料来源的叶绿醇均具有较好的抗氧化和抗肿瘤功效。此外, 叶绿醇及其代谢产物也是机体氧化代谢的能量来源。例如,叶绿醇代谢产物植烷酸能够通过激活过氧化物酶体增殖激活物受体(PPAR)和视黄醇受体(RXR)参与调节机体糖脂代谢和脂肪细胞分化过程(林厦菁等,2012), 因此针对叶绿醇的分子营养学机制有待进一步深入研究。最近, 在球石藻病毒-宿主互作研究中发现了一些有趣的现象, 如病毒感染诱导合成萜类及固醇类等前体分子相关酶基因的表达显著下调, 伴随着宿主藻细胞中叶绿醇等萜类化合物的含量显著降低(Rosenwasseret al, 2014)。来源于球石藻的叶绿醇在体外具有较强的抗氧化活性, 而在病毒感染过程中则可能与病毒诱导的光合作用损伤及细胞凋亡等过程密切相关。
肉豆蔻酸(又称十四烷酸)。束毛藻(Trichodesmium erythraeum)和绿藻(Chlorococcum humicola)乙酸乙酯相中含有25.37%的肉豆蔻酸、33.40%的棕榈酸及亚油酸(Thillairajasekaret al, 2009; Bhagavathyet al,2011)。本文从海洋球石藻乙酸乙酯相中也分离获得肉豆蔻酸, 其对大肠杆菌和副溶血性弧菌具有较强的抑制作用, 它们的 MIC 值分别达到 2.5 和5 mg/mL。海洋微藻富含多种脂肪酸, 其中(多)不饱和脂肪酸可作为人类和动物的膳食营养成分, 而饱和脂肪酸如常见的肉豆蔻酸类则具有较好的抑菌作用,因此某些海洋微藻即可以作为水产动物的养殖饵料,还有望在控制副溶血性弧菌这一重要的海水养殖病害问题上有很好的应用潜力。另外, Cordo 等(1999)发现, 肉豆蔻酸类似物能够替代肉豆蔻酸作为N-肉豆蔻酰基转移酶(NMT)的竞争性抑制剂, 抑制病毒外壳蛋白的肉豆蔻酰基化, 从而能够抑制病毒颗粒的增殖。海洋球石藻病毒(E. huxleyivirus, EhV-86)外壳蛋白中富含豆蔻酰化蛋白, 而病毒感染的球石藻细胞中肉豆蔻酸的含量从占总脂的 15%降低到 10%(Zivet al, 2016), 这种病毒感染导致宿主细胞中肉豆蔻酸含量的变化是否意味着是宿主的一种防御措施?“脂筏”是细胞表面胆固醇、鞘脂和酰化的蛋白质动态聚集形成的具有一定功能的特殊结构微域, 参与物质内吞、跨膜信号转导等多种细胞过程, 被认为是病原微生物进出细胞的一种门户(周一然等, 2004)。肉豆蔻酸酰基化或与糖基化的磷脂酰肌醇相连是脂筏分子的主要蛋白修饰形式, 可见肉豆蔻酸作为一种饱和脂肪酸在调节脂筏结构和功能方面具有重要作用。自然海域中, 病毒感染在一定程度上控制着海洋球石藻的种群丰度, 它们在漫长的适应过程中形成了稳定的协同进化关系, 而肉豆蔻酸在调控病毒与海洋球石藻宿主之间的“军备竞赛”过程中可能具有重要的生物学意义。
4 结论
本研究采用一系列分离方法, 首次从海洋球石藻E. huxleyi乙酸乙酯组分中分离得到3 种活性单体化合物, 在体外具有一定的抗菌、抗氧化活性。经鉴定分别为棕榈酸、叶绿醇和肉豆蔻酸。其中源自海洋球石的叶绿醇不但具有较强的抗氧化能力, 同时对肝癌细胞Hep G2 有较强的抑制作用, 未来在食品、化妆品和医药领域具有一定应用潜力。另外, 海洋球石藻中这些化合物的存在除了具有上述常见的生理学功能外, 可能在球石藻-病毒互作过程中也具有重要调节作用。

