以医院登记为基础的初诊未转移肺癌患者的转移部位分布及生存分析
王泽洲,张 扬,莫 淼,袁 晶,周昌明,沈 洁,冯小双,吴浩旋,李 航,叶 挺,胡 鸿,陈海泉,郑 莹
1.复旦大学附属肿瘤医院肿瘤预防部,复旦大学上海医学院肿瘤学系,上海 200032;
2.复旦大学附属肿瘤医院胸外科,复旦大学上海医学院肿瘤学系,上海200032
肺癌是中国发病率和死亡率最高的恶性肿瘤,发生骨、脑、肺和肝等远处转移是肺癌患者死亡和预后差的主要原因。美国2010—2016年诊断的肺癌患者远处转移率达57%,其5年相对生存率仅为6%[1]。瑞典2002—2010年癌症登记数据显示,56%的肺癌死者有一个或多个转移部位[2]。日本的一项研究[3]显示,47.3%的非小细胞肺癌患者在随访过程中出现远处转移。因此,进一步了解肺癌转移模式以及不同转移部位与预后的关系,对肺癌转移患者的个体化治疗至关重要。
目前中国以人群为基础的肿瘤登记体系很少关注癌症的转移情况。一些登记机构会报告TNM分期,但这仅记录了诊断时有转移的情况,且通常没有转移部位或转移时间的数据。因为对患者的病情掌握不足与随访的缺失,不能掌握治疗后发生转移的情况,所以具有局限性,而以医院为基础的肿瘤登记能够弥补人群登记在这方面的缺陷。复旦大学附属肿瘤医院是一所集医疗、教学、科研、预防为一体的三级甲等肿瘤专科医院,是上海地区肿瘤登记的发源地[4],建立了国内领先的以医院为基础的肿瘤登记系统。采用诊疗病史随访、电话随访和死因数据库匹配的主动随访和被动随访相结合的方式,对患者的复发、转移和生存情况进行全面随访。截至目前,该肿瘤登记系统已累积登记了2008—2017年就诊的约2万例住院治疗肺癌患者的较为完善的临床和随访数据[5-6]。本研究旨在通过分析以医院登记为基础的初诊未发生转移但在随访过程中发生转移的肺癌患者,报告转移部位分布和转移后的生存状况,为肺癌患者的治疗和生存管理提供真实世界数据支持。
1 资料和方法
1.1 研究对象
研究对象纳入流程见图1,基于2008—2017年于复旦大学附属肿瘤医院住院就诊(住院手术、住院放疗或住院化疗)的肺癌患者,纳入初诊未发生转移但在随访过程中发生转移的肺癌患者,共计1490例进入本研究。
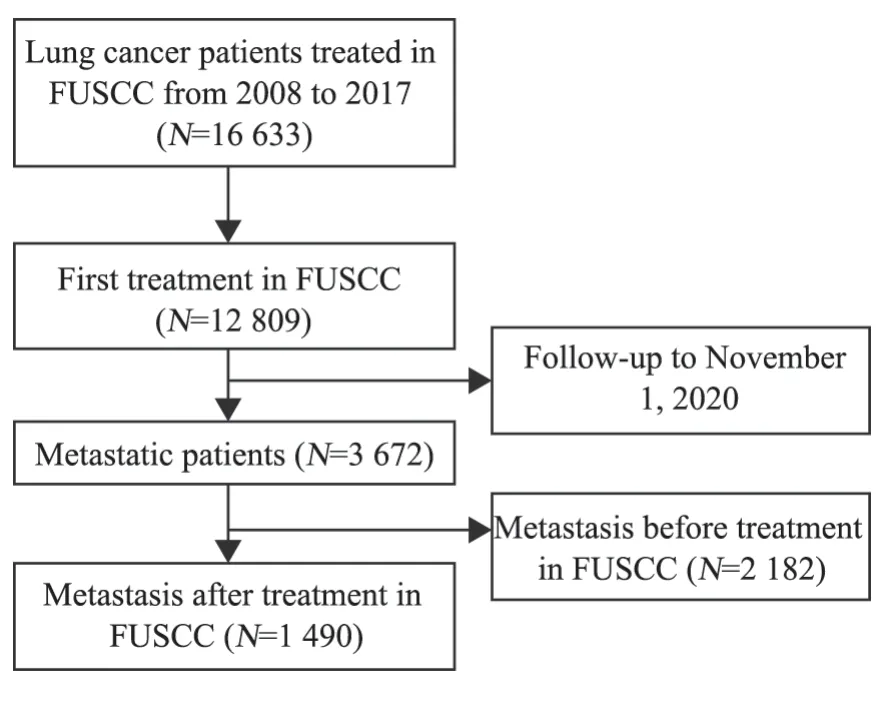
图1 研究对象纳入流程图Fig.1 Flowchart of patients’ recruitment
1.2 资料收集
本研究纳入分析的变量包含以下内容:性别;诊断时年龄;病理组织学亚型;首次治疗时间;转移信息,包括转移部位、转移时间,在转移部位分布分析中,又进一步将转移部位分为单部位转移和多部位转移,或按转移部位细分为肝转移(单纯肝转移、肝脏合并其他部位转移)、肺转移(单纯肺转移、肺合并其他部位转移)、骨转移(单纯骨转移、骨合并其他部位转移)和脑转移(单纯脑转移、脑合并其他部位转移);结局相关信息,包括是否死亡、死亡时间及末次随访时间等。
研究中患者的转移信息和结局信息通过随访获取。随访是通过主动随访和被动随访相结合完成的,共3种手段。首先是病史随访,通过查询患者在复旦大学附属肿瘤医院的诊疗信息,识别患者的复发、转移、第二原发、死亡事件,最新诊疗记录日期为末次随访日期;其次是电话随访,在随访计划规定的时间段内,患者如没有就诊记录,则由专职随访人员电话联系患者或家属,询问并记录相关随访信息;第三是死因数据链接,与各省级疾病预防控制中心的肿瘤登记系统和死因登记系统进行数据链接和匹配,获得患者死亡信息。随访周期为至少每年1次,直至死亡发生终止随访。本研究随访统计时间截至2020年11月1日。详细的随访计划见本团队前期文章[5-6]。
1.3 统计学处理
研究诊断时年龄、性别、诊断时期和组织学亚型对转移分布的影响,计数资料比较采用χ2检验。检验水准采用双侧α=0.05,P<0.05为差异有统计学意义。生存分析终点事件为全死因死亡,如在末次随访时未发生终点事件或未知终点事件,则在末次随访时间点按删失数据处理,生存时间定义为从首次转移日期到死亡或删失日期的时间。统计指标采用观察生存率,即总生存(overall survival,OS)率。根据组织学亚型和转移部位分类,应用Kaplan-Meier法绘制生存曲线,并估计对应转移后的1、3和5年OS率及其95% CI。应用COX回归模型研究诊断时年龄、性别、组织学亚型、诊断时期和不同转移部位对转移后生存的影响。统计分析使用R软件(3.6.0)进行计算。
2 结果
本研究纳入的1490例患者中,男性占65.0%(969例),诊断时平均年龄为(58.5±9.9)岁,腺癌患者占60.7%(905例)。研究的中位随访时间为40.8个月,随访期间全死因死亡937例。基线特征详见表1。
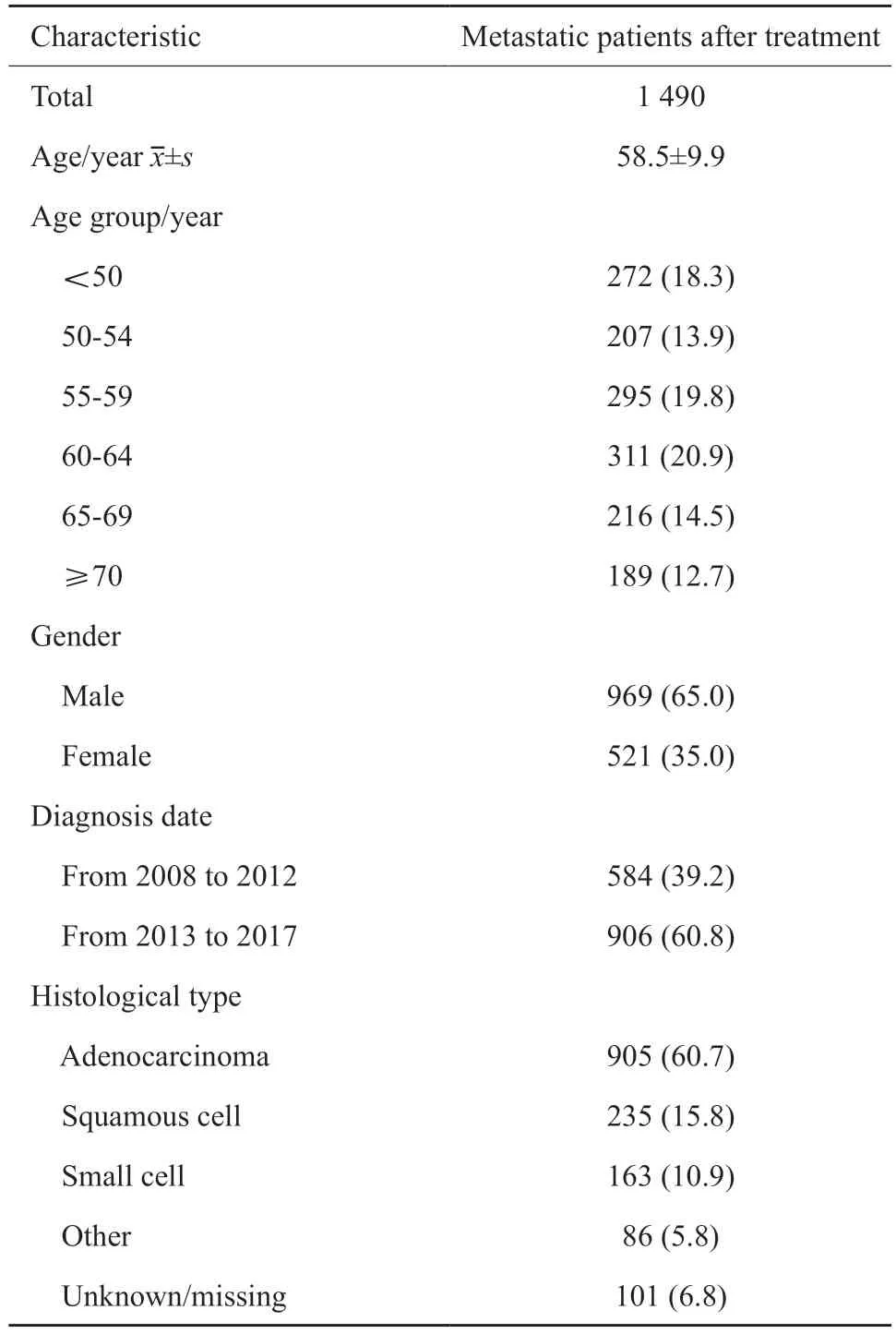
表1 2008—2017年肺癌转移患者基本信息Tab.1 Baseline characteristics of lung cancer patients in this study from 2008 to 2017[n (%)]
67.7%的患者仅发生单部位转移,而32.3%的患者有多部位转移。常见的转移部位依次为骨(33.8%)、脑(33.6%)、肺(22.8%)、肝(12.0%)和肾上腺(3.7%)。单纯骨转移患者比例为18.2%,骨合并其他部位转移比例为15.6%;单纯脑转移患者比例为22.3%,脑合并其他部位转移比例为11.3%;单纯肺转移患者比例为11.6%,肺合并其他部位转移比例为11.2%;单纯肝转移患者比例为5.2%,肝合并其他部位转移比例为6.8%;单纯肾上腺转移患者比例为1.3%,肾上腺合并其他部位转移比例为2.4%。年轻、女性、小细胞癌患者更容易发生脑转移;腺癌更容易发生肺转移;年龄大的小细胞癌患者更容易发生肝转移;肾上腺转移在男性患者中更为多见。肺癌转移患者转移部位分布详见表2。
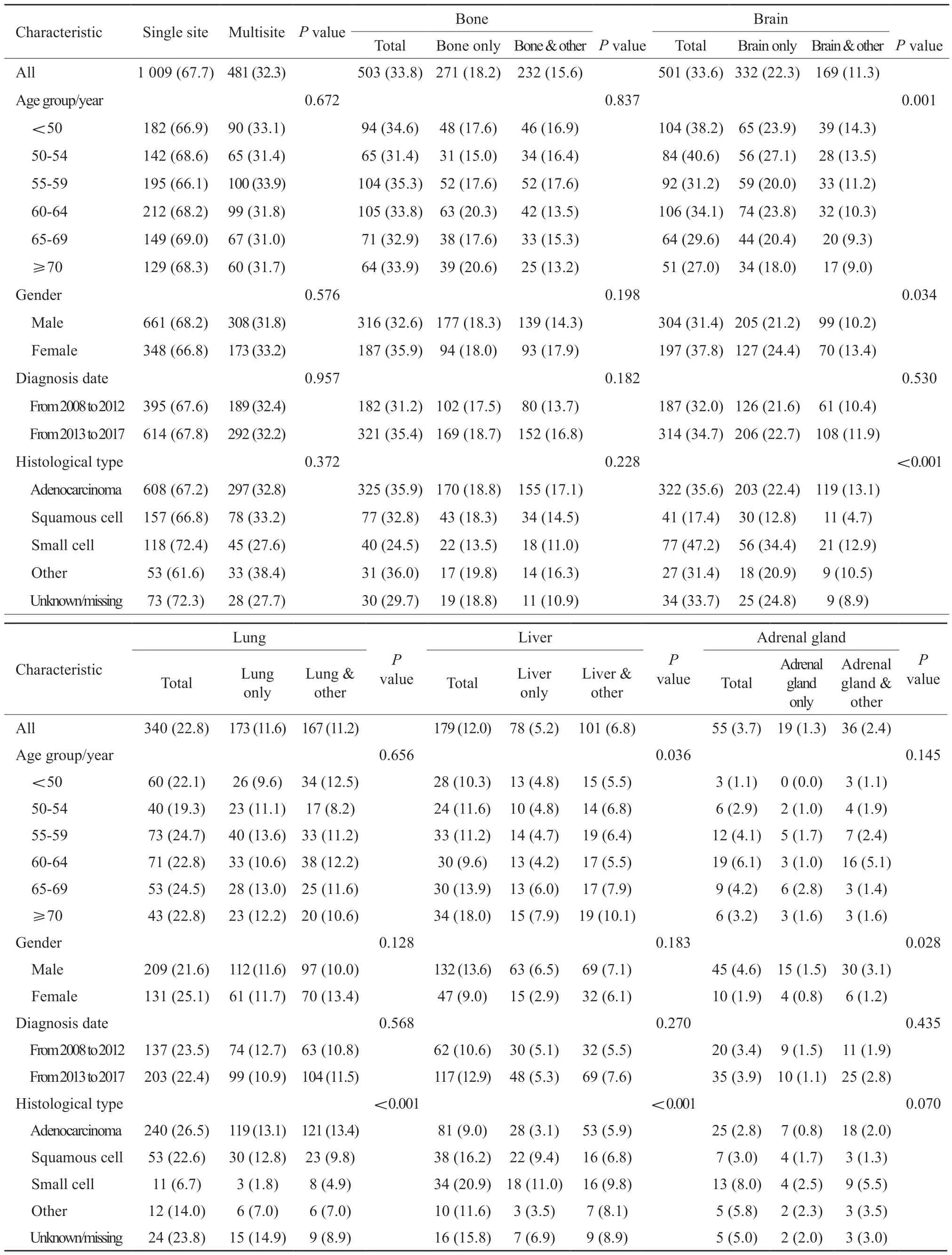
表2 肺癌转移患者转移部位分布Tab.2 Distribution of metastases in lung cancers[n (%)]
发生转移后,肺癌转移患者总体的1、3和5年OS率分别为65.5%(95% CI:62.9~68.0)、35.2%(95% CI:32.4~38.0)和21.0%(95%CI:18.2~23.9)。单部位转移患者为65.7%(95% CI:62.5~68.7)、36.3%(95% CI:32.9~39.8)和23.5%(95% CI:20.1~27.2);多部位转移患者为65.2%(95% CI:60.6~69.4)、32.9%(95% CI:28.2~37.7)和16.4%(95%CI:12.3~21.1)。肺、骨、脑、肝和肾上腺单部位转移患者的1、3和5年OS率分别为65.7%(95%CI:62.5~68.7)、36.3%(95% CI:32.9~39.8)和23.5%(95% CI:20.1~27.2),单部位转移与多部位转移的生存详见表3。
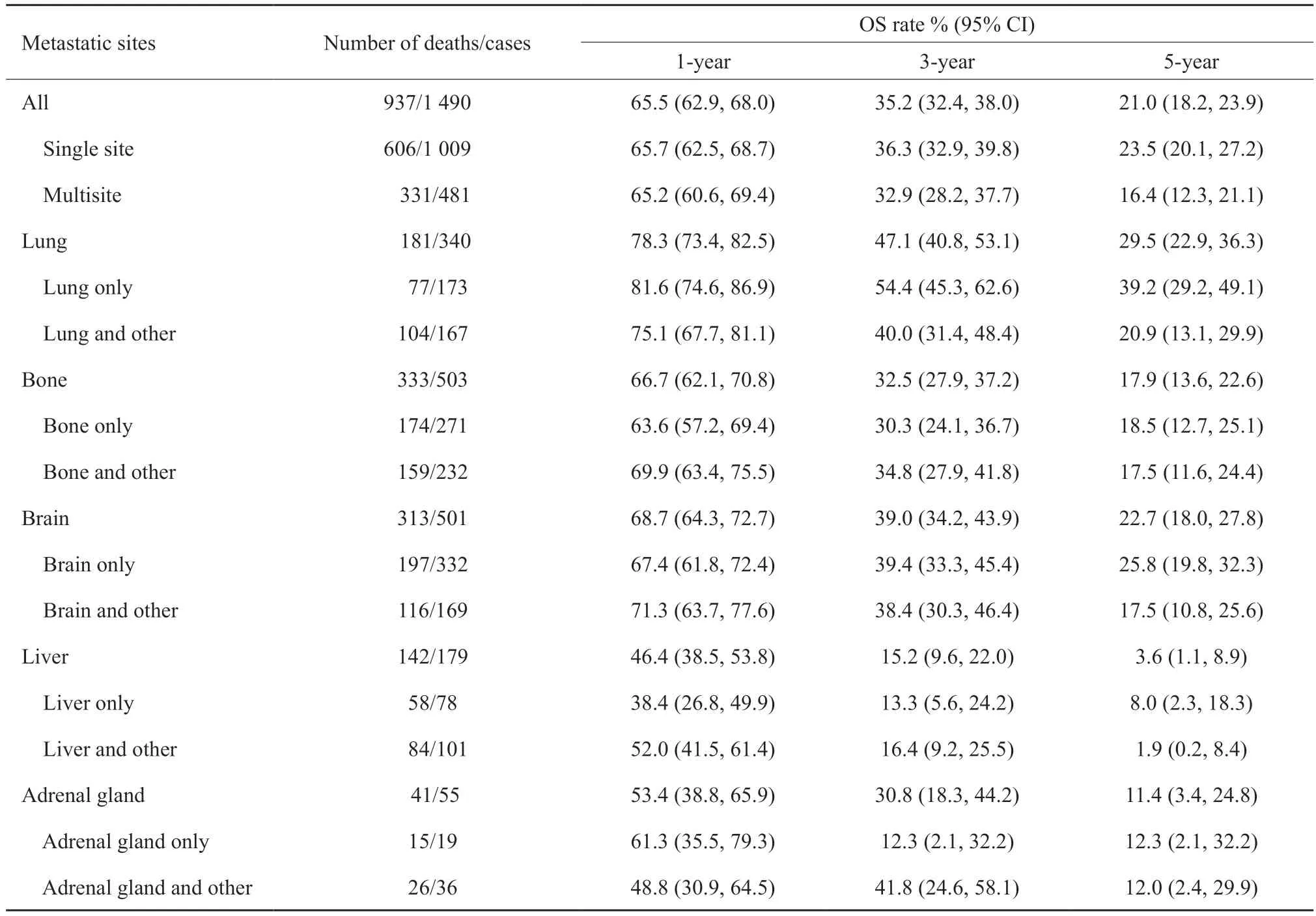
表3 肺癌转移患者发生转移后的生存Tab.3 Survival after metastasis in patients with lung cancer metastasis
单部位转移患者的中位生存时间为22.3个月。其中肺转移患者中位生存时间为39.3个月。与肺转移相比,骨(HR=2.258)、脑(HR=1.706)、肝(HR=3.692)和肾上腺(HR=2.408)转移的预后更差(表4)。
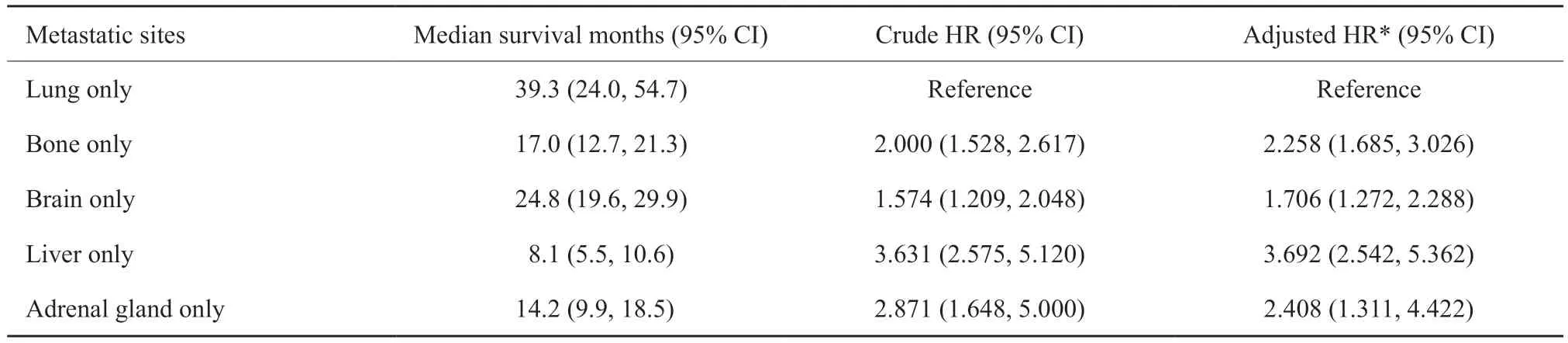
表4 肺癌转移患者不同转移部位死亡的HRTab.4 HR of death at different metastatic sites in patients with lung cancer metastasis
3 讨 论
本研究基于国内领先的单中心恶性肿瘤患者长期随访数据库,是目前已知国内最大规模的肺癌患者转移特征与生存状况研究。为了解中国肺癌患者治疗后的转移和预后情况提供了真实世界数据,也为患者的个体化治疗提供了参考。
肺癌较常见的转移部位包括骨、脑、肺、肝等。基于美国监测、流行病学和最终结果(the Surveillance,Epidemiology and End Results,SEER)数据库的研究[7]显示,美国肺癌转移患者中发生骨、脑、肺和肝转移的比例分别约50%、33%、41%和22%,其中单独骨、脑、肺和肝转移的比例分别约20%、15%、17%和10%。瑞典家庭癌症数据库[2]数据报告,骨、神经系统、呼吸系统、肝和肾上腺转移的比例分别为34%、39%、18%、20%和8%。中国单中心小样本研究[8-9]显示,骨、脑、肺、肝和肾上腺转移的比例分别为39%~45%、20%~23%、16%~29%、15%~18%和7%~12%。本研究患者骨转移、肺转移的比例低于美国人群,与瑞典人群接近;肝转移、肾上腺转移比例略低于瑞典人群;脑转移比例与既往报道基本一致。
本研究显示,脑转移在年轻、女性、小细胞癌患者中更容易发生;肺转移容易发生于腺癌;肝转移也在小细胞癌患者中容易发生。靶器官的微环境被认为是转移的重要因素[10]。腺癌可能比其他组织学亚型在含有腺体的组织中更容易生长,而小细胞癌可能在含有神经内分泌细胞的神经系统和肝脏中具有优势。在分子水平上,不同的组织学亚型可能有不同的转移相关的基因表达谱[11-12]。研究表明,老年患者存在细胞增殖慢[13]、激素浓度和细胞对激素的反应性改变[14],以及血管生成受损[15]等可能降低恶性肿瘤攻击性的机制。另外,老年患者可能在脑转移发生之前就已经死亡,或转移在患者免疫激活的其他部位被抑制,而脑是免疫特权部位。年轻患者的生存期更长,因此增加了发生转移的风险。
不同转移部位患者的预后具有差异性。常见转移部位中,单纯肺转移患者的预后相对最好,但发生肺合并其他部位转移患者生存率明显下降。骨是本研究患者中最常发生转移的部位,其预后比肺转移更差。骨痛、骨折、脊髓或神经受压症状、碱性磷酸酶升高、高钙血症是肺癌患者发生骨转移的高危因素[16]。有研究[17]报告,46%的肺癌骨转移患者会并发骨相关事件。肺癌骨转移患者一旦发生骨相关事件,生存期将缩短近一半。随着影像学技术的进步,脑转移的检出率也逐渐增高,≤60岁的非鳞状细胞癌患者和纵隔淋巴结肿大(>2 cm)被认为与脑转移率高相关[18]。由于血脑屏障会抑制治疗药物进入脑实质,所以预防性颅脑照射可能更能使患者获益[18]。肝转移患者的生存预后最差,由于肝脏肿瘤微环境的特异性,目前免疫治疗的效果不佳[19]。肝转移如果导致肝脏受损,会影响人体的解毒和代谢,进而影响患者后续的治疗,而且肝脏有双重血液供应,容易造成肿瘤播散,导致病情恶化。肺癌肾上腺转移的研究目前国内尚不多,有研究[20]报道,肺癌患者同侧肾上腺转移灶与淋巴系统播散有关,而对侧肾上腺转移灶则可能与血液系统有关。发生同侧肾上腺转移患者的预后要好于对侧肾上腺转移的患者,有研究数据[20]显示,手术同时切除原发肺肿瘤及身体同侧的肾上腺转移灶的患者5年生存率高达83%,而发生身体对侧肾上腺转移的患者5年生存率是0%。
因为研究对象构成不同,本研究结果不宜直接与以人群为基础的肿瘤登记报告结果比较,上海市户籍人口的Ⅳ期肺癌1、3和5年OS率分别为34.0%、9.8%和5.3%[21],但这也可以从侧面反映通过规范治疗肺癌可以显著改善患者的生存预后。
本研究仍存在若干缺陷:首先,缺少治疗方式的信息,缺少诊断时临床分期等数据,无法进一步分层分析相应的生存率。除患者个体因素、肿瘤相关因素外,治疗相关因素也对患者预后具有显著影响。若不治疗,患者诊断发现脑、肝转移后的中位生存期均不足3个月,肾上腺转移也仅为3个月左右。近年来对不同器官转移治疗的研究进展迅速,预后逐渐好转,为患者带来了长期生存的希望。例如,立体定向放射治疗及各种分子靶向治疗等手段综合治疗能使非小细胞癌脑转移患者生存期明显延长[22];血管生成抑制剂和程序性死亡[蛋白]-1(programmed death-1,PD-1)/程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)免疫检查点抑制剂联用能够显著延长肺癌肝转移患者的OS和无进展生存期(progression-free survival,PFS)[23],本研究假设所有患者均接受了当时的标准治疗。其次,转移信息的获取依赖于复旦大学附属肿瘤医院患者复诊记录,对于后续复诊不在复旦大学附属肿瘤医院的患者,通过电话随访和死亡信息链接,无法获取完整的转移发生的信息,对转移的发生率可能有所低估。第三,患者中位转移后随访时间未满5年,其5年生存率可能存在偏倚。但鉴于目前基于中国肺癌患者转移特征的研究较少,本研究结果具有一定价值:首先,本研究是目前国内样本量最大的肺癌患者转移特征与生存状况研究;其次,本研究通过对转移时间和转移部位的记录,确切地反映患者转移后的真实生存时间,减少了偏倚。

