水稻纹枯病菌对生物农药申嗪霉素和吩胺霉素的抗药性初探
郝祥蕊 吴小珍 崔莹 何亚文

摘 要:纹枯病是由立枯丝核菌侵染引起的一种真菌病害,是水稻发生最为普遍的病害之一。申嗪霉素和吩胺霉素是我国具有自主知识产权的微生物代谢产物农药。为了研究水稻纹枯病菌对这两种生物农药的抗药性,本研究开展了如下试验:(1)分别测定申嗪霉素和吩胺霉素在离体平板培养条件下抑制水稻纹枯病菌生长所需EC20和EC50;(2)纹枯病菌在含有EC20浓度申嗪霉素或吩胺霉素平板上连续传代传至20代、25代和30代时,分别测定了各自的EC50;(3)比较了在含有EC20浓度申嗪霉素或吩胺霉素平板上连续培养25代的纹枯病菌对水稻的致病性;(4)从相应致病水稻再分离纯化纹枯病菌,比较了所得纹枯病菌的菌落形态、菌丝颜色及其形成的菌核形态。结果表明:水稻纹枯病菌在含有申嗪霉素或吩胺霉素的平板上培养20~30代后,对申嗪霉素和吩胺霉素的敏感性与对照相比无显著性差异。申嗪霉素和吩胺霉素可长期使用防治水稻纹枯病。
关键词:水稻纹枯病;申嗪霉素;吩胺霉素;耐药性
中图分类号:S435.111.4+2 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2021.09.011
Evaluation of the Drug Resistance of Rhizoctonia to Two Metabolite Pesticides Shenqinmycin and Fenanmycin
HAO Xiangrui1,2, WU Xiaozhen1, CUI Ying2, HE Yawen2
(1.Shanghai Nongle Biological Products Limited Company, Shanghai 201419, China; 2.Shanghai Jiao Tong University-Shanghai Nongle Joint R&D center on Biopesticides and Biofertilizers, Shanghai Jiao Tong University, Shanghai 200240, China)
Abstract: Rice sheath blight is an important rice fungal disease caused by Rhizoctonia solani. Shenqinmycin and Fenanmycin are microbial metabolite pesticides with independent intellectual property rights in China. To investigate whether Shenqinmycin or Fenanmycin application caused drug resistance in Rhizoctonia solani, the following experiments were conducted in this study: (1) The EC50 (half maximal effective concentration) and EC20 values of Shenqinmycin and Fenanmycin on Rhizoctonia solani under in vitro plate culturing condition were determined; (2) After subculturing for 20, 25 and 30 generations on the plate supplemented with Shenqinmycin or Fenanmycin at EC20 concentration, the EC50 of the resultant Rhizoctonia solani was determined; (3) The virulence of the 25-generation sub-cultured Rhizoctonia solani on rice was determined; (4) The Rhizoctonia solani strains were isolated from the infected rice and compared in the colony morphology, hyphal color and sclerotioid morphology. The results suggested that no drug resistance against Rhizoctonia solani was observed after in vitro subculturing for 20-30 generations on Shenqinmycin-or Fenanmycin-containing plates. The Shenqinmycin-or Fenanmycin-treated Rhizoctonia solani remains virulent on rice as the original isolate.
Key words: Rhizoctonia solani; Shenqinmycin; Fenanmycin; drug resistance
水稻紋枯病是由立枯丝核菌(Rhizoctonia solani)侵染引起的一种真菌性病害。水稻发病后叶片枯死,结实率下降,平均减产5%~10%,严重发病时可减产30%~50%,给农业生产造成严重的经济损失[1-3]。常规使用的防治药剂,如爱苗(30%苯醚甲环唑·丙环唑乳油)、嘧菌酯悬浮剂、满穗(噻呋酰胺悬浮剂)、己唑醇和嘧菌酯悬浮剂等,可用于防治水稻纹枯病,但易产生不同程度的抗药性[4-5]。吸水链霉菌井冈山变种产生的代谢产物井冈霉素在我国已使用40多年,防治水稻纹枯病效果显著,但造成施药量和施药次数显著增加,这一问题已经引起有关部门的高度重视[6-8]。
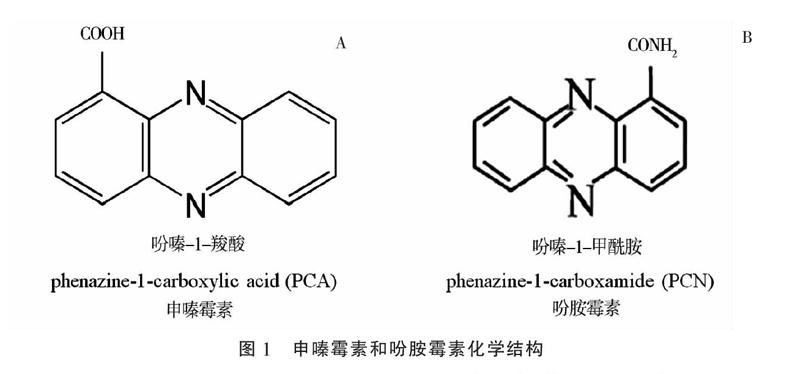
申嗪霉素是上海交通大学与上海农乐生物制品股份有限公司合作开发的一种生物农药,其活性成分是荧光假单胞菌产生的代谢产物吩嗪-1-羧酸(phenazine-1-carboxylic acid,简称PCA,图1-A)[9-10]。申嗪霉素兼具广谱抑菌活性和促进植物生长双重功能。2008—2009年期间,在全国南方10个省、市完成的大田试验结果表明,1%申嗪霉素悬浮剂能有效防治水稻纹枯病,平均防效超过80%[11-13]。2011—2016年间申嗪霉素原药和1%申嗪霉素悬浮剂先后获得了农药登记证[14]。吩胺霉素有效成分为吩嗪-1-甲酰胺(phenazine-1-carboxamide,简称PCN,图1-B),它是由绿针假单胞菌产生的次级代谢产物,具有广谱的抑菌、抗菌活性,还能有效诱导水稻和大豆等作物产生免疫抗性[15-16]。在中性和碱性pH环境条件下,吩胺霉素抗菌活性比申嗪霉素更稳定[17-18],适合我国西北部碱性土壤环境。目前高产PCN的工程菌株已经成功获得[14],吩胺霉素原药和3% 吩胺霉素悬浮剂登记正在进行中,有望成为新一代生物农药。
病原菌产生抗药性是农药防治效果下降的主要原因,为探讨水稻纹枯病菌对申嗪霉素和吩胺霉素抗药性,本研究将水稻纹枯病菌在含申嗪霉素或吩胺霉素的平板上连续培养30代后,测定其对两种药剂敏感性,以及病菌的致病性,为申嗪霉素和吩胺霉素的推广使用提供理论支撑。
1 材料和方法
1.1 供试病原菌与供试药剂
水稻纹枯病菌(Rhizoctonia solani) 浙江分离株来自上海农乐生物制品股份有限公司菌种保藏中心,原始保藏菌株在本研究中简称CK0。根据需要本研究还用到如下菌株名称。PSAY-20、PSAY-25和PSAY-30:在PSAY平板上继代培养20,25,30代的纹枯菌;PSAYA20-20、PSAYA20-25和PSAYA20-30:在含有EC20浓度申嗪霉素的PSAY平板上继代培养20,25,30代的纹枯菌;PSAYN20-20、PSAYN20-25和PSAYN20-30:在含有EC20浓度吩胺霉素的PSAY平板上继代培养20,25,30代的纹枯菌。1%申嗪霉素悬浮剂和1%吩胺霉素悬浮剂,均由上海农乐生物制品股份有限公司提供。
1.2 试验所用培养基
PSA培养基(马铃薯200 g、蔗糖20 g、琼脂20 g、蒸馏水定容至1 000 mL);PSAY培养基(PSA+0.5%酵母膏);PSA培养基和PSAY培养基经高温高压灭菌后保存备用。PSAYA培养基(PSAY+2~10 μg·mL-1申嗪霉素);PSAYA20培养基(PSAY + EC20浓度申嗪霉素):PSAYN培养基(PSAY+2~10 μg·mL-1吩胺霉素):PSAYN20培养基(PSAY+EC20浓度吩胺霉素)。
1.3 室内抑菌活性的测定
采用平皿生长速率法测定药剂对病菌的抑制效果[19]。在无菌超净台中将供试的药剂与融化后冷却至50 ℃左右的PSAY培养基均匀混合,倒入15×9 cm的培养皿中,每皿20 mL,凝固后得到含有不同浓度申嗪霉素的PSAYA平板和含有不同浓度吩胺霉素的PSAYN平板;以不添加药液的PSAY平板作为空白对照,每个浓度重复5次。将保存的纹枯菌接种在PSA平板上,置于28 ℃恒温培养箱中培养3 d,用打孔器取直径为8 mm的菌丝块,接种到上述不含或含有药剂的平板上,置于28 ℃培养箱中培养。待病原菌丝体在对照平板中长满整个平皿时,采用十字交叉法[20]测定待测平板上菌落直径。按下列公式计算抑菌率:
抑制率(%)=×100
利用GraphPad Prism8程序计算药物抑菌率与浓度对数之间的线性方程,根据线性方程,计算EC20和EC50。
1.4 纹枯病菌在PSAY平板上培养和转接继代培养
根据试验所确定得EC20浓度,计算出所需1%申嗪霉素悬浮剂和1%吩胺霉素悬浮剂的使用量,用水定容到1 mL,对照为1 mL无菌水;快速加入9 mL 50 ℃左右的PSAY琼脂培养基,混匀,倒入15×9 cm无菌培养皿。待平板冷却后取直径为8 mm的菌丝块,接种到该平板上,置于28 ℃培养箱中培养。以菌核长好为准(约8 d)。如此重复进行,培养20~30代。
1.5 纹枯病菌在水稻上致病性测试
参考许文耀发表的接种方法[21],采用菌丝块或菌核接种。在奉贤公司总部试验地水稻种植小区(共4块小区,每小区面积为13 m2)挑选未抽穗的健康水稻苗40株,在水稻叶鞘位置用针扎孔,将相同大小菌丝块放置在已扎孔的叶鞘部位。先用脱脂棉进行包扎,外用保鲜膜封住,并做好标记。每株接种2~3部位,保持该部位处于湿润状态3 d,3 d后去掉脱脂棉和保鲜膜,接种7~10 d后,分别观察和记录纹枯病菌侵染病斑大小。
1.6 从发病水稻中分离纹枯病菌
参考许文耀发表的纹枯病菌分离方法[21]。切取发病、健康交界处的水稻组织一小块(1.5 cm2),先置于70% 乙醇中浸泡5 s,后移入0.1% 升汞中浸泡5 min,再把水稻組织转移到灭菌水中漂洗3遍,最后转移到PSA平板上培养直到长出病原菌。
1.7 数据处理与统计学方法
每组试验至少设5个重复,统计试验结果后计算平均值和标准方差(SD)。利用T-test统计学方法,以P<0.05认为差异有统计学意义。相同字母代表不同处理之间不存在显著性差异(P>0.05),不同字母则代表二者之间存在显著性差异。
2 结果与分析
2.1 申嗪霉素和吩胺霉素抑制纹枯病菌株生长的EC20和EC50
通过前期预试验结果,分别准备含有2~10 μg·mL-1申嗪霉素的PSAYA平板开展试验。接种活化的原始纹枯病菌(简称CK0)菌块,培养8 d后,统计菌落直径。结果表明:在不含申嗪霉素的PSAY平板上纹枯病菌CK0的菌落平均直径为7.36 cm,而在含有2 ~ 10 μg·mL-1申嗪霉素的PSAYA平板上纹枯病菌的菌落平均直径分别为6.65,4.48,3.71,3.40,3.26 cm(表1),相应的抑菌率分别为10.82%,43.9%,55.64%,60.37%,62.50%。利用GraphPad Prism8拟合出申嗪霉素抑菌率与浓度对数之间的线性方程为:Y=74.86×lgX-7.016(图2-A)。据此,申嗪霉素抑制水稻纹枯病菌生长CK0所需EC20和EC50确定为2.30,5.77 μg·mL-1(表1)。
利用同样的方法,吩胺霉素对纹枯病菌原始菌株CK0抑菌率几率值与浓度对数之间的线性方程为:Y=77.18×lgX-4.262(图2-B)。吩胺霉素抑制水稻纹枯病菌CK0生长的EC20和EC50确定为2.06,5.05 μg·mL-1(表1)。
2.2 连续转接培养20~30代后的纹枯病菌对申嗪霉素敏感性
新鲜原始纹枯病菌CK0菌块分别接种到PSAY琼脂平板及含有2.30 μg·mL-1(EC20) 申嗪霉素的PASY琼脂平板(简称PSAYA20),培养8 d后,再分别取菌块,转接到新的PSAY平板及PSAYA20平板上,如此连续培养20,25,30代。所得纹枯病菌分别接种到含有2 ~ 10 μg·mL-1申嗪霉素的PSAYA平板上生长。记录菌落直径,换算成抑制率,分别得到相应的回归方程式(表2)。根据所得回归方程式,确定申嗪霉素抑制这些纹枯病菌生长所需EC50。结果表明:在PSAY平板上转接了20,25,30代的纹枯病菌(PSAY-20、PSAY-25和PSAY-30)对申嗪霉素的EC50分别为5.52,5.96,5.78 μg·mL-1(表2),而在含有EC20浓度(2.30 μg·mL-1)申嗪霉素平板上转接了20,25,30代的纹枯病菌(PSAYA20-20、PSAYA20-25和PSAYA20-30)对申嗪霉素的EC50分别为5.61,
5.75,5.77 μg·mL-1(表2)。统计学分析表明:两种平板继代培养后的纹枯病菌对申嗪霉素的EC50没有显著性差异,与原始菌株CK0的EC50(5.77 μg·mL-1,表1)没有显著性差异。
2.3 连续转接20~30代后的纹枯病菌对吩胺霉素敏感性
运用上述方法,原始纹枯病菌CK0菌快分别接种到PSAY琼脂平板、含有2.06 μg·mL-1(EC20)吩胺霉素的琼脂平板(简称PSAYN20),培养8 d后,再分别取菌块,转接到新的PSAY平板或PSAYN20平板上,如此连续转接培养20,25,30代。所得纹枯病菌分别接种到含有2 ~ 10 μg·mL-1吩胺霉素的PSAYN平板上生长,8 d后记录菌落直径,换算成抑制率。根据抑制率,分别得到相应的回归方程式和吩胺霉素抑制这些纹枯病菌生长所需EC50(表3)。结果表明:在PSAY平板上转接培养了20,25,30代的纹枯病菌(PSAY-20、PSAY-25和PSAY-30)对吩胺霉素的EC50分别为5.08,4.89,4.88 μg·mL-1(表3),而在PSAYN20平板上转接培养20、25和30代的纹枯病菌(PSAYN20-20、 PSAYN20-25和PSAYN20-30)对吩胺霉素的EC50分别为5.06,5.09,4.73 μg·mL-1(表3)。統计学分析表明:转接培养20~30代的纹枯病菌与原始菌株CK0对吩胺霉素的EC50没有显著性差异。
2.4 在PSAY、PSAYA20和PASYN20平板上转接了25代的纹枯病菌对水稻的致病性和形态学分析
将原始菌种(CK0)、在PSAY平板上连续培养25代的菌株PSAY-25、在PSAYA20平板上培养25代的菌株PSAYA20-25和在PSAYN20平板上培养25代的菌株PSAYN20-25接种未抽穗的水稻叶鞘部位。接种7 d和10 d后,能明显看到接种部位出现病斑(图3-4),这些菌株在水稻上所引起的平均病斑面积没有显著性差异(图5),说明申嗪霉素或吩胺霉素处理没有影响纹枯病菌的致病性。
进一步从水稻上发病部位分离纹枯病菌,经纯化培养后,所得菌株在菌落形态、菌丝颜色及其形成的菌核方面与原始菌种(CK0)基本一致(图6)。
3 结论与讨论
农药是农业和林业等领域的基本生产资料,是维持人类社会稳定的基本保障。病虫害产生抗药性是影响农药充分发挥功效的一个重要因素,病虫害抗药性的发生与农药的作用靶标密切相关。申嗪霉素是一类微生物代谢产物农药,主要活性成分是假单胞菌产生的吩嗪-1-羧酸。这种代谢产物在自然界,尤其是作物根际微生物中广泛存在,具有广谱的杀菌活性,目前已获得防治九种作物真菌性病害的农药登记证[14]。由于申嗪霉素对水稻白叶枯菌也有抑制作用,因此,南京农业大学周明国教授团队10多年前就开始以水稻白叶枯菌为对象,从不同角度研究了申嗪霉素的作用靶标。Xu等[22]发现申嗪霉素处理能显著提高水稻白叶枯菌活性氧(ROS)积累,降低过氧化氢酶(catalase,CAT)和超氧化物歧化酶(superoxide dismutase,SOD)活性。Pan等[23]进一步发现申嗪霉素与其它农药无交互抗性,水稻白叶枯菌抗申嗪霉素风险较低。吩胺霉素是申嗪霉素的衍生物,在中性或偏碱性环境中抑菌活性更强更稳定[17-18]。Xiang等[15]报道吩胺霉素抑制水稻纹枯病菌的EC50为9.093 4 μg·mL-1,作用靶标包括几丁质合成酶、线粒体中电子传递和氧化磷酸化。Ma等[16]发现0.1 ~ 1.0 μM吩胺霉素即可诱导水稻产生抗病性。Chen等[24]发现在小麦赤霉病菌中PCN的作用靶标之一是组氨酸酰基化酶。
在以水稻白叶枯菌为对象研究申嗪霉素抗药性过程中,虽然分离到了抗性突变体,但这些突变体基本上都是生长受到严重影响的突变体,没有得到典型的农药抗性突变菌株[23]。本研究利用水稻纹枯病菌为研究对象,分别研究了不同培养继代培养条件下所得纹枯病菌对申嗪霉素和吩胺霉素的EC50以及对水稻的致病性,发现经20~30代继代培养后的纹枯病菌对这两种代谢产物农药没有产生抗药性。这一结论与目前其它生物农药抗药性研究结果基本类似。虽然井冈霉素的用药量越来越高,但至今没有发现抗井冈霉素的纹枯病菌。
纹枯病菌对申嗪霉素或吩胺霉素不易产生抗药性的分子机理值得进一步研究。根据吩嗪类化合物的特点、生物学功能和申嗪霉素剂型等,纹枯病菌对申嗪霉素或吩胺霉素不易产生抗药性可能有如下几个方面的原因:(1)吩嗪类化合物具有多种生物学功能。申嗪霉素或吩胺霉素具有广谱杀菌活性,是许多微生物定殖植物根际的重要手段[25];它们在假单胞菌胞内还是一类特殊的信号分子,可以诱导基因表达,调控铁代谢和生物膜等多种生物学功能[26];申嗪霉素或吩胺霉素还是重要的电子受体,参与微生物发电或微生物之间电信号传递[27];(2)吩嗪类化合物多样化的生物学功能决定它们可能有多个靶标或影响多种生物学功能。(3)申嗪霉素和吩胺霉素是多类土壤或植物根际微生物产生的非极性强的天然产物,通常都有多种结构类似物存在,不是单一化合物,经历了长期的自然选择,病原菌不易产生抗药性。
综上所述,生物农药申嗪霉素和吩胺霉素,长期使用防治水稻纹枯病,不易产生抗药性,可在水稻主产区推广使用,为我国化学农药减量使用,农产品安全保障及品质提升提供保障。
参考文献:
[1] 董金皋. 农业植物病理学[M]. 2版. 北京: 中国农业出版社, 2007: 8-15.
[2] 胡春锦. 水稻纹枯病菌(R.solani AG-1 IA)生理分化和遗传多样性研究[D]. 南宁: 广西大学, 2005.
[3] 曹安强, 曹志勇. 水稻纹枯病的识别及其发生因素[J]. 农技服务, 2009, 26(8): 82-83.
[4] 艾爽, 侯昌亮, 胡寒哲, 等. 8种杀菌剂对水稻纹枯病菌的室内毒力比较[J]. 长江大学学报(自科版), 2014(2): 4-5, 16.
[5] 周艾艾, 田旭军, 刘世江, 等. 10种常用杀菌剂对水稻纹枯病菌的敏感性及其协同作用[J]. 南方农业学报, 2021, 52(1): 86-94.
[6] 常望霓. 水稻纹枯病防治药剂的筛选及田间防效[D]. 长沙: 湖南农业大学, 2011.
[7] 汪汉成, 周明国, 张艳军, 等. 戊唑醇对立枯丝核菌的抑制作用及在水稻上的应用[J]. 农药学学报, 2007, 9(4): 357-362.
[8] ZHANG C Q, LIU Y H, MA X Y, et al. Characterization of ssensitivity of rhizoctonia solai, causing rice sheath sheath blight, to mepronil and boscalid[J]. Crop Protection, 2009, 28(5): 381-386.
[9] WU D Q, YE J, OU H Y, et al. Genomic analysis and temperature-dependent transcriptome profiles of the rhizosphere originating strain Pseudomonas aeruginosa M18[J]. BMC Genomics, 2011, 12: 438.
[10] JIN K M, ZHOU L, JIANG H J, et al. Engineering the central biosynthetic and secondary metabolic pathways of Pseudomonas aeruginosa strain PA1201 to improve phenazine-1-carboxylic acid production[J]. Metabolic Engineering, 2015, 32: 30-38.
[11] 温广月, 张穗, 张红艳, 等. 新型微生物源农药申嗪霉素对水稻纹枯病菌的毒力测定及田间药效[J]. 植物保护, 2008, 34(4): 143-145.
[12] 陈海霞, 杜兴彬, 张穗, 等. 申嗪霉素对水稻纹枯病的田间防效分析[J]. 上海农业学报, 2012, 28(2): 69-71.
[13] 沈丽娟. 高效、广谱、安全生物杀菌劑——申嗪霉素[J]. 世界农药, 2011, 33(3): 58.
[14] JIN Z J, ZHOU L, SUN S, et al. Identification of a strong quorum sensing- and thermo-regulated promoter for the biosynthesis of a new metabolite pesticide phenazine-1-carboxamide in Pseudomonas strain PA1201[J]. ACS Synthetic Biology, 2020, 9(7): 1802-1812.
[15] XIANG Y, ZHANG Y, WANG C, et al. Effects and inhibition mechanism of phenazine-1-carboxamide on the mycelial morphology and ultrastructure of Rhizoctonia solani[J]. Pesticide Biochemistry and Physiology, 2018, 147: 32-39.
[16] MA Z, HUA G, ONGENA M, et al. Role of phenazines and cyclic lipopeptides produced by Pseudomonas sp. CMR12a in induced systemic resistance on rice and bean[J]. Environmental Microbiology Reports, 2016, 8(5): 896-904.
[17] CHIN-A-Woeng T F, THOMAS-OATES J E, LUGTENBERG B J, et al. Introduction of the phzH gene of Pseudomonas chlororaphis PCL1391 extends the range of biocontrol ability of phenazine-1-carboxylic acid-producing Pseudomonas spp. strains[J]. Molecular Plant-Microbe Interactions, 2001, 14(8): 1006-1015.
[18] CHIN-A-WOENG T F C, BLOEMBERG G V, LUGTENBERG B J J. Phenazines and their role in biocontrol by Pseudomonas bacteria[J]. New Phytologist, 2003, 157(3): 503-523.
[19] 中華人民共和国农业部. 农药室内生物测定试验准则 杀菌剂 第2部分: 抑制病原真菌菌丝生长试验 平皿法: NY/T1156.2-2006[S]. 北京: 中国标准出版社, 2006.
[20] 黄昌华. 复方甲基托布津对延缓抗性作用的研究[J]. 湖北植保, 1998(2): 7-9.
[21] 许文耀. 普通植物病理学实验指导[M]. 北京: 科学出版社, 2006: 1-176.
[22] XU S, PAN X Y, LUO J Y, et al. Effects of phenazine-1-carboxylic acid on the biology of the plant-pathogenic bacterium Xanthomonas oryzae pv. oryzae[J]. Pesticide Biochemistry and Physiology, 2015, 117: 39-46.
[23] PAN X, WU J, XU S, et al. Contribution of OxyR towards differential sensitivity to antioxidants in xanthomonas oryzae pathovars oryzae and oryzicola[J]. Molecular Plant-Microbe Interactions, 2018, 31(12): 1244-1256.
[24] CHEN, Y, WANG J,YANG N, et al. Wheat microbiome bacteria can reduce virulence of a plant pathogenic fungus by altering histone acetylation[J]. Nature Communications, 2018, 9(1): 3429.
[25] LEETOURNEAU M K, MARSHALL M J, GRANTR M, et al. Phenazine-1-carboxylic acid-producing bacteria enhance the reactivity of iron minerals in dryland and irrigated wheat rhizospheres[J]. Environmental Science and Technology, 2019, 53(24): 14273-14284.
[26] DIETRICH L E P, TEAL T K, PRICE-WHELAN A, et al. Redox-active antibiotics control gene expression and community behavior in divergent bacteria[J]. Science, 2008, 321(5893): 1203-1206.
[27] STAMS A J M, DE BOK F A M, PLUGGE C M, et al. exocellular electron transfer in anaerobic microbial communities[J]. Environmental Microbiology, 2006, 8(3): 371-382.

