温度和水分变化对冻土区泥炭地土壤氮循环功能基因丰度的影响
马秀艳,蒋 磊,宋艳宇,*,孙 丽,宋长春,侯爱新,高晋丽,杜 宇
1 中国科学院东北地理与农业生态研究所,湿地生态与环境重点实验室, 长春 130102 2 美国路易斯安那州立大学,海岸与环境学院, 美国 LA 70803
土壤微生物能够调节陆地生物地球化学循环,是土壤中重要的物质循环推动者,同时也是生物圈与非生物圈物质与能量交换的重要枢纽[1]。它们在土壤有机质分解和元素循环中起着重要作用,土壤微生物通过微生物作用与周围环境发生交换,以此获得营养物质来满足自身需要[2]。土壤微生物本身也是土壤养分库,对土壤养分的转化与供应起着重要作用[3]。
固氮微生物种类丰富,其体内存在具有催化功能的固氮酶,其中nifH 基因编码固氮酶中的铁蛋白[4],是所有固氮微生物含有的最保守的功能基因,因此nifH基因被广泛应用于研究固氮微生物群落[5]。反硝化作用是氮循环的关键步骤之一,反硝化是微生物参与土壤氮循环的重要过程之一。土壤中反硝化过程主要是由异养反硝化细菌完成[6- 7]。参与反硝化过程的酶主要有硝酸还原酶、亚硝酸还原酶、氧化氮还原酶和氧化亚氮还原酶,它们的编码基因分别为nar、nirK/nirS、norB和nosZ,其中亚硝酸还原酶中的nirK和nirS分别为可溶性含铜酶和细胞色素酶的编码基因,是反硝化过程中研究最多也是最重要的功能基因[8]。
土壤微生物对温度变化敏感,其对温度的响应直接影响生态系统过程[9]。温度是控制生物反应的基础,不同生物体温度敏感性的变化可能会影响微生物对气候变化的响应[10]。温度升高可以促进土壤微生物的呼吸作用,微生物消耗土壤中的氧气使土壤呈厌氧环境进而影响反硝化作用[11]。有研究表明,温度变化对微生物量、微生物群落及其组成有直接影响[12- 13]。对草原生态系统土壤反硝化速率及其相关微生物变化的研究发现增温显著增加了高寒草原土壤中的反硝化细菌的数量及土壤反硝化速率[14]。土壤水分含量是土壤氮素转化过程中至关重要的影响因素。土壤水分含量与其他土壤理化性质共同作用可显著改变土壤的孔隙度及孔隙分布,从而影响氧气在土壤中的流通,进而影响微生物的活性[15- 16]。短期的温度升高和水分增加可显著提高土壤nifH基因丰度[17],不同水分条件下土壤中nirK和nirS基因丰度随着水分的增加而增加[18],nirK基因对土壤水分变化的响应更灵敏[19]。因此,研究温度和水分变化对氮循环功能基因丰度的影响对于明确未来气候变化影响下氮循环过程具有重要意义。
大兴安岭是我国唯一的地带性冻土分布区,也是世界上主要的泥炭分布区之一[20],在全球变暖的影响下,中国东北的永久冻土区在过去的几十年里经历了显著退化[21],永冻层不再是永久冻土而是转变成季节融化层,温度升高使得冻土融化,导致活动层呈淹水状态。前期研究表明温度升高会促进冻土泥炭地N2O的释放,但其微生物机制尚不明确。本研究以大兴安岭冻土泥炭地为研究对象,通过室内模拟培养试验,采用实时定量PCR技术,研究土壤氮循环相关微生物对温度和水分变化的响应。本研究旨在为全球变暖影响下永久冻土区泥炭地氮循环变化提供基础数据和理论依据。
1 材料与方法
1.1 研究区概况
研究站点位于大兴安岭连续多年冻土区(东经122°86′,北纬52°94′),属于寒温带季风性气候,全年无霜85—110 d,11月—次年4月冬季积雪,冻结期大概为7个月[22]。年平均温度为-3.9℃。年平均降雨量为350—550 mm,降水主要集中在7—8月[23]。该地区主要植物类型包括常绿灌木、落叶灌木、草本植物,其中常绿灌木的主要代表为细叶杜香(Ledumpalustre)和甸杜(Chamaedaphnecalyculata),落叶灌木的主要代表为笃斯越橘(Vacciniumuliginosum),草本植物的主要代表为羊胡子草(Eriophorumvaginatum),而地被植物的主要代表为泥炭藓(Sphagnumpalustre)[24]。该地区的土壤类型为泥炭土。
1.2 样品采集与培养
2018年8月,选取大兴安岭冻土区典型泥炭地,随机选取样地,采样地之间的距离至少为10 m,每处用土钻采集8个土壤深度(0—20、20—40、40—60、60—80、80—100、100—120、120—140 cm和140—150 cm),其中0—60 cm深度为活动层,60—80 cm深度为过渡层,80 cm以下深度为永冻层。人工挑出植物根系、新鲜凋落物和石块等杂物,低温保存运回实验室。取一部分新鲜土壤样品测定土壤pH值和含水量,一部分土壤样品置于阴凉处风干后研磨,过0.25 mm筛,测定土壤样品的初始全氮含量。用于培养的土壤样品冷冻保存。

1.3 实验方法
1.3.1土壤微生物功能基因丰度及温度敏感性
土壤微生物DNA提取[25]:按照土壤Fast DNA SPIN快速提取试剂盒(MPbio,USA)说明书准确称取0.3 g土壤样品到Lysing Matrix E管中,加入978 μL Sodium Phosphate Buffer和122 μL MT Buffer,采用FastPrep®处理后离心14000 g×10 min,将上清液转移到一个新的2 mL离心管中,加入250 μL PPS离心14000 g×5 min,将上清液转移到一个新的5 mL离心管并加入1 mL Binding Matrix Suspension,用手颠倒2 min后静置3 min,去除500 μL上清后转移混合液到SPINTM Filter后离心14000 g×1 min,加入500 μL SEWS-M到SPINTM Filter中离心14000 g×1 min,将SPINTM Filter下面catch tube中的液体倒掉,再离心14000 g×2 min,将SPINTM Filter放到一个新的Catch Tube中室温下风干5 min,加入100 μL DES离心14000 g×1 min使DNA转移到Catch Tube中,-80℃冰箱保存。
提取后用0.5%低熔点琼脂糖凝胶纯化DNA提取物,用苯酚-氯仿-丁醇萃取。为了获得更具代表性的DNA样本对每个样本进行3次重复处理。通过荧光定量PCR仪(7500,ABI,美国)定量测定细菌的nifH、nirK和nirS基因丰度[26]。扩增所用引物及扩增程序见表1,实时荧光定量PCR反应体系为25 μL∶12.5 μL的1×SYBR缓冲液(TaKaRa,Japan),0.4 μL引物(10 μM),0.5 μL ROXΙΙ(TaKaRa),0.875 μL 3%BSA,0.625 μL 二甲亚砜(DMSO),10 ng DNA模板。
土壤微生物温度敏感性[30]:
式中,Abundance1代表较低温度T1测定的微生物丰度,Abundance2代表较高温度T2测定的微生物丰度。
1.3.2土壤理化性质测定

1.4 数据处理与分析
运用SPSS 17.0软件,采用双因素方差分析(two-way ANOVA)和显著性差异(Tukey)以及Pearson相关分析等方法对不同土壤深度下土壤氮循环相关微生物功能基因丰度以及无机氮含量进行差异显著性分析,检验温度和水分变化对土壤氮循环相关微生物数量的影响,所有数据在进行方差分析前均进行正态性检验(s-w 检验),且符合正态分布,并运用Excel 2007进行绘图。
2 结果
2.1 土壤初始理化性质
不同深度土壤初始理化性质如表2所示。土壤含水量范围为57.49%—79.03%,土壤pH值范围为4.50—4.76,土壤总氮含量变化范围为4.48—11.53 mg/g。土壤含水量和总氮的最大值均出现在过渡层(60—80 cm),最小值均出现在冻土层(140—150 cm)。该地区土壤偏酸性,并且土壤酸性随土层深度的增加而减弱。
2.2 温度升高对泥炭地土壤氮循环相关微生物的影响
2.2.1温度升高对土壤氮循环相关微生物功能基因丰度的影响及其温度敏感性
培养55 d后,土壤氮循环相关微生物功能基因丰度变化如图1所示:0—20、20—40、40—60、60—80、80—100、100—120、120—140、140—150 cm土层nifH、nirK、nirS功能基因丰度分别为1.11×1010—1.08×1011、2.60×106—6.87×108、9.07×107—2.18×109基因拷贝数/g干土。0—20、20—40、60—80、80—100 cm土层中nifH基因丰度随着温度的升高显著增加,140—150 cm土层中nifH的基因丰度随着温度的升高显著降低,温度升高显著提高了0—20、20—40、40—60、60—80、80—100和140—150 cm土层nirK基因丰度。0—20、20—40、60—80 cm土层中nirS基因丰度随着温度的升高而显著增加,但是100—120、120—140、140—150 cm土层中nirS基因丰度随着温度的升高而显著减少(表3)。双因素方差分析结果表明,温度和土壤深度对nifH、nirK和nirS基因有显著影响,并且存在交互作用(表4)。nifH、nirK、nirS功能基因丰度的温度敏感性(Q10)平均值分别为1.51、2.53、1.22。nifH、nirK、nirS功能基因丰度的温度敏感性分别在60—80、40—60、60—80 cm土层最高,在20—40、100—120、120—140 cm土层最低(图1)。
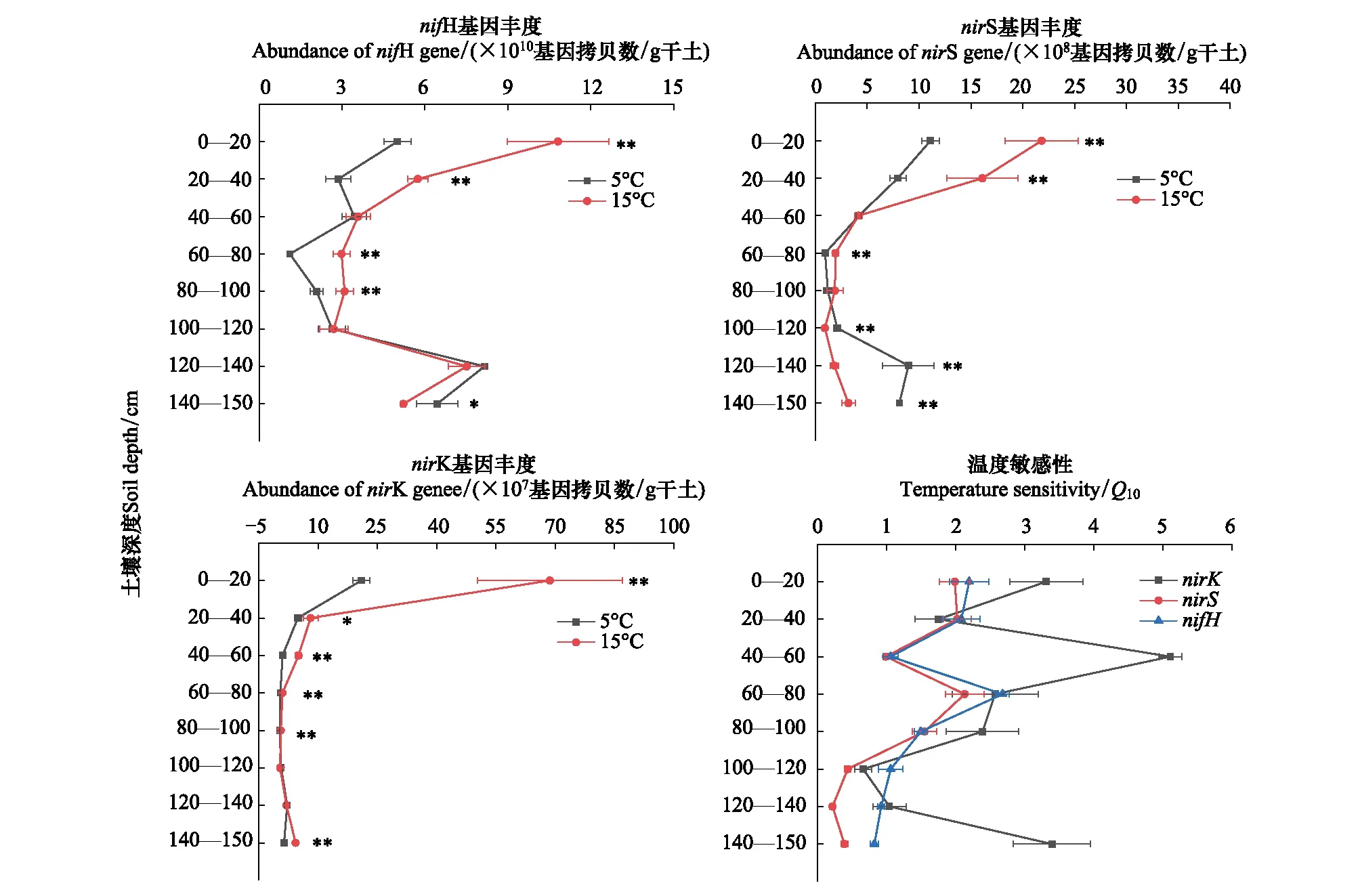
图1 温度升高对不同深度土壤氮循环相关功能基因丰度的影响及其温度敏感性Fig.1 Effect of temperature increasing on soil nitrogen cycle related functional gene abundance and its temperature sensitivity at different soil depths

表3 温度对不同深度土壤氮循环相关功能基因丰度和有效氮含量影响的方差分析
2.2.2温度升高对土壤有效氮含量的影响及其与氮循环相关微生物的相关性

表4 温度和土壤深度及其交互作用对氮循环相关功能基因丰度和有效氮含量影响的双因素方差分析

图2 温度升高对不同深度土壤含量的影响Fig.2 The effect of temperature increasing on contents at different soil depths

表5 氮循环相关功能基因与土壤氮含量相关分析
2.3 温度和水分变化对泥炭地表层土壤氮循环相关微生物的影响
2.3.1泥炭地表层土壤氮循环相关微生物基因丰度变化
不同温度和水分条件下表层土壤固氮和反硝化细菌数量变化如图3所示:在5℃和15℃条件下,淹水处理使20—40 cm土壤nifH基因丰度增加了104.19%和18.28%。0—20 cm层nirS基因丰度分别降低了37.21%和74.86%,nirK基因丰度分别降低了54.78%和57.06%。20—40 cm土壤nirS基因丰度分别降低了10.88%和67.02%,nirK基因丰度分别降低了50%和29.33%。在淹水条件下,温度升高使0—20和20—40 cm土壤中的nifH基因丰度分别增加了18.68%和11.47%,nirS基因丰度分别降低了32.26%和25.94%,而nirK基因丰度分别增加了212.17%和135.95%。水分及温度和水分的交互作用对0—20、20—40 cm层nirS和nirK及20—40 cm的nifH基因丰度有显著影响(表6)。

图3 温度和水分变化对表层土壤氮循环关键功能基因丰度的影响Fig.3 Effects of temperature and moisture on nitrogen cycle related functional gene abundance at topsoil

表6 温度和水分对表层土壤氮循环功能基因丰度及氮含量影响的双因素方差分析
2.3.2泥炭地表层土壤氮含量变化及其与氮循环相关微生物丰度的关系
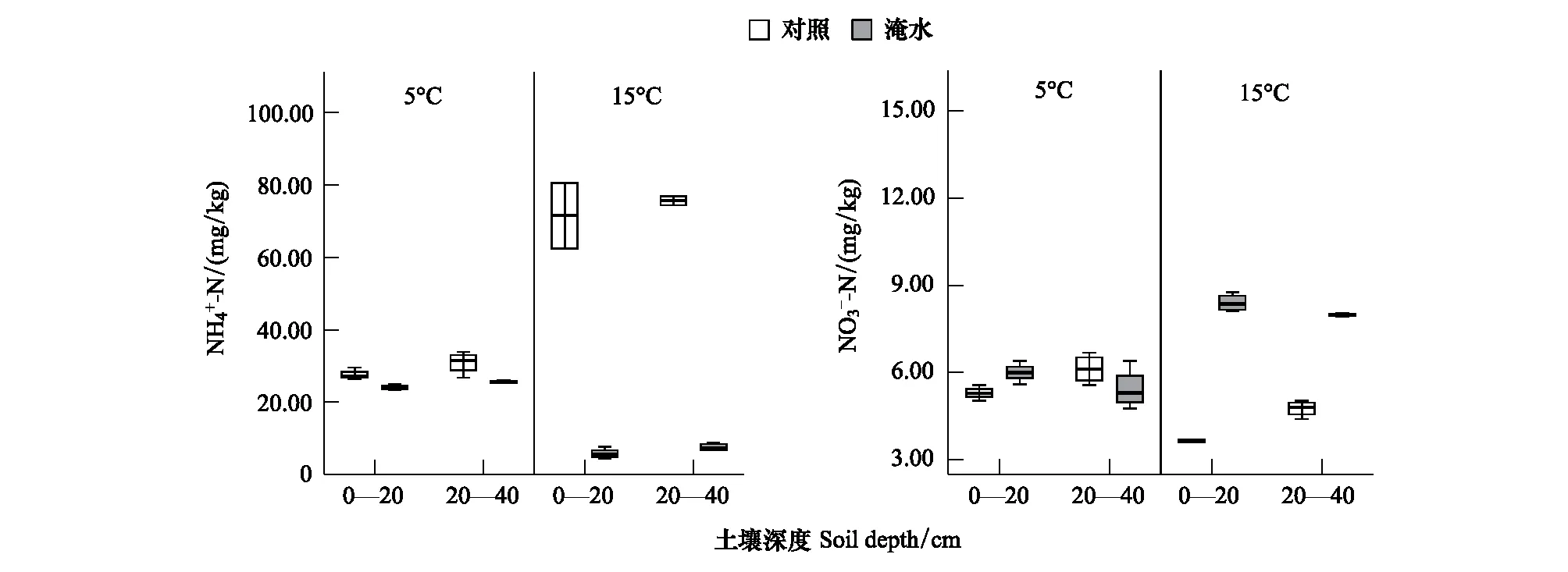
图4 温度和水分对表层土壤氮含量的影响Fig.4 Effects of temperature and moisture on nitrogen contents at topsoil

表7 表层土壤氮循环相关功能基因丰度与土壤氮含量的相关分析
3 讨论
3.1 泥炭地不同深度土壤氮循环相关微生物及有效氮含量对温度变化的响应
3.1.1泥炭地土壤氮循环微生物对温度升高的响应

3.1.2泥炭地土壤有效氮含量对温度升高的响应

3.2 温度和水分变化对泥炭地表层土壤氮循环相关微生物及有效氮含量的影响
3.2.1泥炭地表层土壤氮循环相关微生物对温度和水分变化的响应
温度和水分能够影响土壤中细菌群落的多样性[42],短期和长期的变化都可能改变土壤细菌的结构和组成[43]。我们发现在增温条件下,淹水处理使表层土壤nirS和nirK基因丰度降低,可能是因为淹水造成了过度还原的条件,使反硝化底物浓度降低,反硝化微生物活性受到抑制,此研究结果与刘若萱在水田土壤中的研究结果一致,即淹水处理使反硝化微生物nirS和nirK基因丰度降低[18]。温度和水分交互作用对表层土壤nirS和nirK基因丰度有显著影响,说明温度和水分对土壤氮循环nifH、nirK、nirS功能基因丰度的影响不是单方面的,而是二者交互作用的结果。温度和水分的变化会影响土壤微生物活性及其好氧厌氧状态,当土壤含水量发生变化时,会引起土壤孔隙度大小发生改变,微生物的活性及其利用有机物的能力受到影响。
3.2.2泥炭地表层土壤有效氮含量对温度和水分变化的响应

4 结论


