肺癌患者血清癌胚抗原和神经元特异性烯醇化酶联合检测的临床意义
周爱国,郑梦利,张书新,赵亚超,刘慧峰,郑明,周鹏宇
中国人民解放军总医院第八医学中心,北京 100091
肺癌发病早期无典型症状,早期诊断率比较低,往往错过最佳诊治阶段[1-2]。同时由于肿瘤灶体积、范围等还较小,难以通过影像学进行确认[3]。肿瘤标志物是临床诊疗恶性肿瘤的重要参考,也是肺癌诊疗的重要实验室指标[4]。但肿瘤标志物可能存在灵敏度、特异度低的问题,由此导致漏诊、误诊的发生,给医师的诊疗带来困扰[5]。癌胚抗原(CEA)是由胎儿、胎盘、消化道、支气管黏膜等产生的糖蛋白,正常人血清中含量很小,但是在恶性肿瘤患者血清中呈现高表达状况,检测支气管肺泡灌洗液中CEA含量可提高对肺癌诊断的敏感性与特异性[6-7]。神经元特异性烯醇化酶(NSE)是烯醇化酶同工酶形式,正常人NSE主要定位于神经元和神经内分泌细胞,但是在机体发生病变时可进入血循环和脑脊液中,检测血循环和脑脊液中的NSE水平,就可能对这些病变提供诊断的有用信息[8-9]。单一的血清肿瘤标志物不仅存在于肺肿瘤组织中,还存在于其他组织与器官中,为此在临床上需要将多种肿瘤标志物进行统一检测与联合判断[10-11]。本文探讨肺癌患者血清CEA和NSE联合检测的临床意义与价值。
1 对象与方法
1.1 研究对象 选取2017年8月至2020年12月在解放军总医院第八医学中心诊治的非小细胞肺癌患者78例作为肺癌组,同期选择在解放军总医院第八医学中心体检的健康人群78例作为健康组。在肺癌组中,肿瘤最长径(4.10±0.21)cm;病理类型:鳞癌43例,腺癌35例;组织学分化程度:低分化34例,中分化29例,高分化15例;临床分期:Ⅰ期43例,Ⅱ期27例,Ⅲ期8例;淋巴结转移26例。本研究经解放军总医院第八医学中心伦理委员会批准。
1.2 纳入与排除标准 纳入标准:年龄在30~70岁;肺癌组符合非小细胞肺癌的病理学诊断标准;无严重的自身免疫系统、血液系统疾病;无严重的心脑血管、肝肾等器官组织疾病;临床、病理资料完整;入选者签署知情同意书。排除标准:合并其他恶性肿瘤;妊娠与哺乳期妇女;伴有遗传代谢性疾病;伴有其他基因疾病患者。
1.3 血清CEA和NSE检测 清晨空腹静脉抽取两组入选者的外周静脉血2 mL,静置5 min后,采用离心机在4 ℃ 离心后(3 000 r/min,离心10 min),取上层血清,采用酶联免疫法检测血清CEA和NSE含量,由上海西唐生物科技有限公司提供试剂盒,按照说明书规范操作。CEA正常参考范围0~5.0 μg/L;NSE参考范围0~3.0 μg/L。联合检测阳性判断标准:CEA和NSE任一一项判断为阳性。
1.4 临床资料调查 调查所有入选者的性别、年龄、体重指数、收缩压、舒张压、心率、空腹血糖,肺癌的临床病理特征包括病理类型、组织学分化程度、临床分期、淋巴结转移等。

2 结果
2.1 一般资料比较 两组患者的性别、年龄、体重指数、收缩压、心率、舒张压、空腹血糖等指标差异无统计学意义(P>0.05)。见表1。
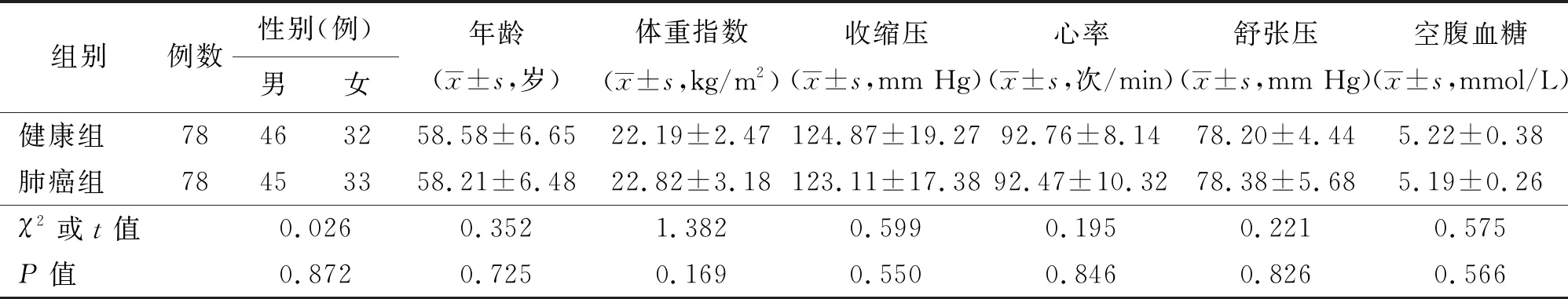
表1 两组一般资料对比
2.2 血清CEA和NSE含量 肺癌组的血清CEA和NSE含量都高于健康组(P<0.05)。见表2。
表2 两组血清CEA和NSE含量对比
2.3 CEA、NSE与联合检测阳性率对比 肺癌组的CEA、NSE与联合检测阳性率为47.4%、48.7%、55.1%,高于健康组的2.6%、3.8%、5.1%(P<0.05)。见表3。
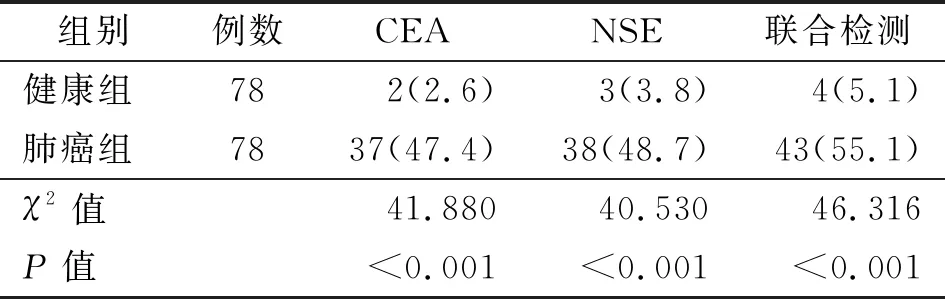
表3 两组CEA、NSE与联合检测阳性率对比[例(%)]
2.4 不同病理特征肺癌患者的血清CEA和NSE含量对比 在肺癌组中,不同组织学分化程度、临床分期、淋巴结转移患者的血清CEA和NSE含量差异有统计学意义(P<0.05)。见表4。
表4 不同病理特征肺癌患者的血清CEA和NSE含量对比
2.5 相关性分析 在肺癌组中,Pearson相关分析显示CEA(r=0.563,P=0.001)、NSE(r=0.488,P=0.008)与淋巴结转移存在相关性(P<0.05)。
logistic回归分析显示CA21-1、鳞状细胞癌抗原(SCC)、胃泌素释放肽前体(ProGRP)为影响肺癌患者淋巴结转移的主要影响因素(P<0.05)。见表5。
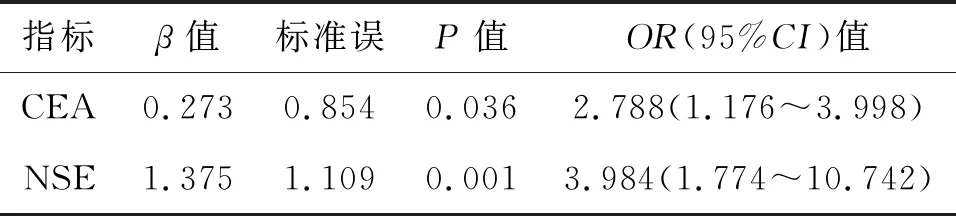
表5 影响肺癌患者淋巴结转移的多因素分析
2.6 诊断价值 ROC曲线分析显示CEA、NSE与联合检测诊断非小细胞肺癌的曲线下面积分别0.765,0.675,0.814,诊断敏感性分别为47.4%、48.7%和55.1%,特异性分别为97.4%、96.2%、94.9%。见表6。
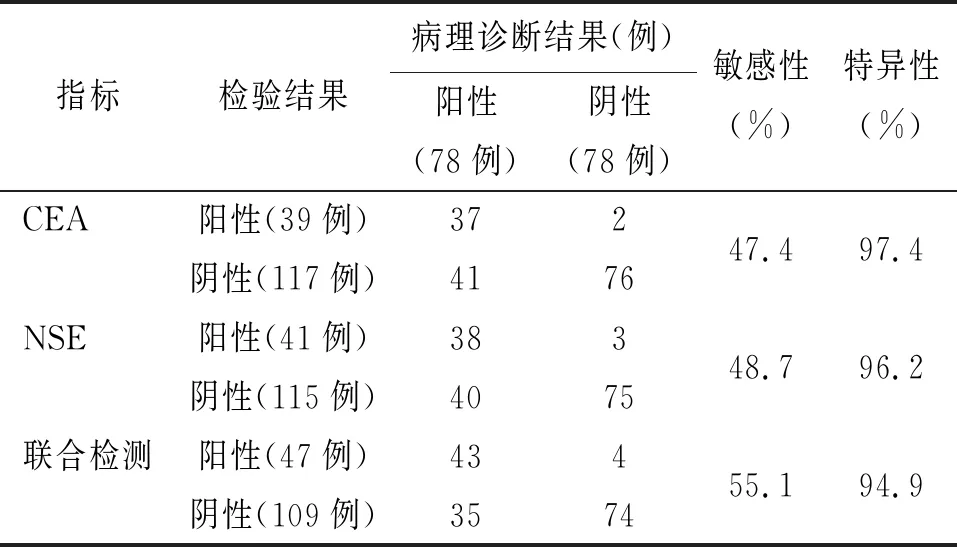
表6 CEA、NSE与联合检测在肺癌诊断的敏感性与特异性(n=156)
3 讨论
肺癌作为常见的呼吸系统肿瘤,在所有恶性肿瘤中属于高发病率肿瘤,但如能在早期及时采用科学有效的干预方法,患者5年生存率可达90%以上[12];但如未能在疾病早期确诊,晚期患者其预后较差,5年生存率为20%~30%[13]。因此肺癌的治疗关键和基础是早期诊断,目前临床上仍以病理活检作为肺癌诊断的金标准,但是其为一种创伤性检查,临床上的应用有一定的局限性,很难反映患者的预后情况[14]。肿瘤标志物的检测快速、简便、非介入性、可重复性、方便动态监测,能对肿瘤的早期诊断及鉴别诊断和预后等做出有价值的判断。本研究显示肺癌组的血清CEA和NSE含量高于健康组(P<0.05);肺癌组的CEA、NSE与联合检测阳性率为47.4%、48.7%、55.1%,高于健康组的2.6%、3.8%、5.1%(P<0.05)。CEA是存在于恶性肿瘤组织中的一种基因编码于19号染色体上胎儿性糖蛋白,也是最早应用于肺癌的肿瘤标志物之一[15]。NSE在神经内分泌细胞和神经源性肿瘤中广泛表达,也是一种哺乳动物组织中普遍存在的糖酵解酶[16]。CEA和NSE都具有一定免疫抑制作用,属于肺癌细胞直接或间接分泌标志物,可作为肺癌特异性较强的肿瘤标志物[17-18]。
肺癌发病率与死亡人数已居癌症之首[19]。淋巴结转移是影响肺癌患者预后的重要因素,研究[20]显示无淋巴结转移的患者术后5年的存活率在60%以上,而伴有淋巴结转移的患者术后5年的生存率≤30%。肺癌术前准确评估淋巴结转移、及时进行转移淋巴结清扫,对改善患者预后具有重要作用。肺癌细胞的转移为比较复杂的过程,其中丰富的毛细血管可为肿瘤细胞侵袭到脉管系统提供了便利,患者肿瘤血管的生成可随肿瘤细胞脱落并侵入到基质内,进入脉管系统,导致癌细胞在血液循环中存活,导致患者预后恶化[21]。本研究显示在肺癌组中,不同组织学分化程度、临床分期、淋巴结转移患者的血清CEA和NSE含量对比差异有统计学意义(P<0.05);Pearson相关分析显示CEA、NSE与淋巴结转移存在相关性(P<0.05);logistic回归分析显示CA21-1、SCC、ProGRP为影响肺癌患者淋巴结转移的主要影响因素(P<0.05)。当肿瘤细胞发生转移时,CEA可释放入血清中,导致CEA表达水平上升[22]。同时当机体癌细胞增多时,可释放大量的NSE,参与肿瘤的浸润与侵袭[23]。CEA是一个经典的肿瘤标志物,其生成主要来源于恶性肿瘤增殖的过程中。临床研究显示恶性肿瘤在生长的过程中,CEA释放进血液中,其中肺癌、食管癌、甲状腺癌患者即使在早期也可检出[24]。NSE与神经细胞的分化成熟和能量代谢有关,NSE在神经元的细胞质起主导作用,可在轴突损伤的情况下分泌[25]。NSE可激活巨噬细胞并减少中性粒细胞的凋亡,致使肿瘤侵袭深入,转移加速[26]。另外NSE还可通过激活JAK-STAT信号通路调节肿瘤细胞周期,加速肿瘤新血管的生成[27]。本研究ROC曲线分析显示CEA、NSE与联合检测诊断非小细胞肺癌的曲线下面积分别0.765、0.675、0.814,诊断敏感性分别为47.4%、48.7%和55.1%,特异性分别为97.4%、96.2%、94.9%,表明肿瘤标志物联合应用能提高对肺癌的诊断敏感性,且不会降低诊断特异性;联合影像学与临床特征有助于提高肺癌的早期诊断准确率。
总之,肺癌患者CEA和NSE呈现高表达状况,与患者的病理特征存在相关性,CEA和NSE联合检测能提高对肺癌的诊断敏感性,且不会降低诊断特异性。

