响应面耦合遗传算法优化超声-酶辅助提取金银花绿原酸工艺及其抗氧化活性研究
谷 红,尹本林,袁建全,裴云逸
(1.玉溪农业职业技术学院,云南 玉溪653100;2.云南省农业科学院质量标准与检测技术研究所,云南 昆明650205)
金银花(Lonicera japonicaThunb.)又称为金花、双花和银花,为忍冬科忍冬属。金银花提取物中含有黄酮类、三萜类、有机酸类、环烯醚萜类、糖类和醇类等活性成分[1]。其中绿原酸和黄酮类化合物是金银花中最重要的活性成分。大量研究结果表明:金银花绿原酸具有较好的抗氧化活性,同时具有较强的药理活性,对消化系统、血液系统及生殖系统等方面的疾病具有显著的治疗效果[2-3]。金银花中活性成分的提取是金银花产业中最关键的环节,也是制约金银花发展的瓶颈,因此寻找绿色高效的提取技术是当前研究的热点。
超声提取是一种新型的物理提取技术,超声所产生的“空化效应”、“机械效应”和“热效应”加速了植物细胞壁的破裂,降低活性成分的传递阻力,从而显著提高活性成分得率[4-5]。植物细胞壁主要成分为纤维素和果胶,通过利用纤维素酶和果胶酶来水解植物细胞壁,可以显著降低活性成分由内向外的传质阻力,促进活性成分的提取分离[6]。因此,利用超声-酶辅助提取金银花绿原酸是一种新颖的提取技术,目前在金银花绿原酸提取中还未见报道。此外,影响金银花绿原酸提取率的因素有溶剂性质、萃取温度、萃取时间、固液比和超声功率等。因此,优化金银花绿原酸的提取条件是提高金银花绿原酸提取率的关键。响应面法(Response surface methodology,RSM)是一种数学统计方法,常被应用于提取工艺优化,但RSM对试验点的选择有很高的要求,试验点选取不当,很难得到理想的优化结果[7]。遗传算法(Genetic algorithms,GA)具有全局寻优的特点,能取得较好的预测和优化效果。将RSM与GA相结合,既能避免RSM的缺陷,又能充分发挥GA在全局优化中的优势。因此,本试验采用该组合方法来对金银花绿原酸的提取条件进行优化,同时探究该提取条件下获得的金银花绿原酸提取物的抗氧化活性。本文通过超声-酶辅助提取法对金银花绿原酸进行提取,进而探究超声功率、提取时间、提取温度、果胶酶添加量和乙醇体积分数对金银花绿原酸提取率的影响,并通过RSM耦合GA来优化其提取工艺,最后探究金银花绿原酸提取物的体外抗氧化活性。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
金银花,采于河南封丘;绿原酸标准品(≥98%),张家界久瑞生物科技有限公司;果胶酶(6.0×105U/g),合肥博美生物科技有限责任公司;DPPH,酷尔化学科技(北京)有限公司;过硫酸钾和乙酸钠,上海金锦乐实业有限公司;水杨酸和双氧水,上海澄绍生物科技有限公司;乙醇(分析纯),常州市启迪化工有限公司。
1.1.2 仪器与设备
HJ911-8P超声波提取仪,上海达洛科学仪器有限公司;LGJ-20G冷冻干燥机,四环福瑞科仪科技发展(北京)有限公司;RX-Z005旋转蒸发仪,建湖瑞祥玻璃制品有限公司;UV759紫外可见分光光度计,青岛聚创环保集团有限公司;JIDI-20D台式高速离心机,广州吉迪仪器有限公司。
1.2 方法
1.2.1 样品前处理
金银花经除杂,冷冻干燥处理,并利用植物粉碎机将其粉粹,过40目筛,制得金银花粉末,密封避光保存于4℃冰箱中备用。
1.2.2 超声-酶辅助提取绿原酸
称取5.0 g金银花粉末置于具塞三角瓶中,按照1∶30(g/mL)的料液比加入不同体积分数的乙醇溶液,用玻璃棒搅拌使其充分混合,然后加入不同添加量的果胶酶,将其置于超声波提取仪中,通过仪器控制面板,设置超声时间和超声温度,待提取结束后,将提取物置于离心机中以7 000 r/min离心15 min,真空抽滤获得滤液,残渣重复上述操作,合并滤液。将部分滤液用蒸馏水定容至100 mL容量瓶中,用于测定不同提取条件下绿原酸的提取率。此外,取另一部分滤液置于40℃旋转蒸发仪减压浓缩,真空冷冻干燥,制得绿原酸提取物。
1.2.3 绿原酸提取率测定
1.2.3.1 金银花中绿原酸标准曲线的制作
准确称取绿原酸标准品0.005 g,加入少量体积分数为70%乙醇溶液,使标准品充分溶解,随后将其定容于100 mL容量瓶中。然后从中分别取出1、2、3、4、5、6 mL溶液,置25 mL容量瓶中,用体积分数70%乙醇定容至刻度,在波长327 nm处测各样品吸光度。以吸光度作为纵坐标,标准溶液浓度作为横坐标,进行线性拟合,其标准方程为:y=0.031 87x-0.012 72(R2=0.999 3)。
1.2.3.2 金银花中绿原酸含量计算
依据“1.2.2”步骤对金银花中绿原酸进行提取,将提取液定容至250 mL容量瓶中,从中移取2 mL溶液定容至50 mL容量瓶中。在波长327 nm处,测定其吸光度,将吸光度代入标准方程中,计算得出样品中绿原酸浓度,然后将其样品中绿原酸浓度代入方程(1)中,即可计算得出绿原酸提取率(Y)。

式中:C为样品溶液浓度,mg/mL;V为溶液体积,mL;
n为稀释倍数;m为金银花粉末的质量,g。
1.2.4 单因素试验设计
选择超声-酶辅助提取法提取金银花绿原酸,操作步骤同“1.2.2”。称取5 g金银花粉末,分别从超声功率、提取时间、提取温度、果胶酶添加量和乙醇体积分数5个因素进行单因素试验,讨论试验因素对样品绿原酸提取率的影响。超声功率分别为100、150、200*、250、300 W;提取时间分别为10、20、30*、40、50 min;提取温度分别为30、35、40*、45、50℃;果胶酶添加量分别为0.10%、0.15%、0.20%*、0.25%和0.30%;乙醇体积分数分别为40%、50%、60%*、70%和80%。每组试验重复3次,结果用平均值±标准差表示。其中:“*”表示当考察其他因素对绿原酸提取率影响时,用“*”标记的因素保持恒定水平。
1.2.5 响应面法试验设计
本研究选择试验自变量分别为超声功率(X1)、提取温度(X2)、果胶酶添加量(X3)和乙醇体积分数(X4),同时选取绿原酸提取率(Y)为响应值。利用Design Expert 8.0软件设计Box-Behnken组合试验,本研究的试验因素与水平如表1所示。

表1 试验设计因素与水平Table 1 Factors and levels of experimental design
采用响应面分析法得到的二次回归模型,如式(2)所示:
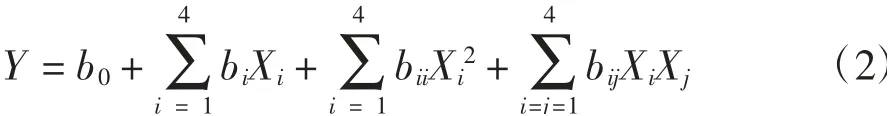
式中:b0为截距回归系数;bi为线性回归系数;bii为二次项的回归系数;bij为交互项的回归系数;Xi、Xj为自变量。
1.2.6 遗传算法设计
GA是一种基于自然遗传和选择机制的随机非线性优化算法。采用RSM模型作为遗传算法的适应度函数,对绿原酸提取率的提取工艺进行优化。选择高斯变异函数为每个向量条目添加一个随机数,在原始得分的基础上,采用秩-量函数对个体进行拟合。优化过程中选择随机均匀函数和分散交叉函数,采用Matlab R2018b版遗传算法工具箱进行优化研究。目标函数如式(3)所示。

式中:f(x)是从RSM模型得到的目标函数;x是输入向量;y是绿原酸提取率,%;XiL和XiU分别是Xi的下边界和上边界。
1.2.7 抗氧化活性的测定
1.2.7.1 ABTS+自由基清除能力的测定
参照Liang等[9]的方法并略作改动。分别将金银花绿原酸提取物配制成质量浓度为1、3、5、7、9、11 mg/mL的样品溶液。将7.0 mmol/L ABTS与终浓度为2.45 mmol/L过硫酸钾充分混合,在25℃条件下,避光静置12 h。利用pH为4.5的乙酸钠溶液稀释至波长734 m处的吸光度为0.7±0.02。取3 mL上述溶液与20 mL样品溶液混合,静置6 min,在波长734 nm处测定每个样品的吸光度,以VC为对照,依据式(4)计算ABTS+自由基的清除率。
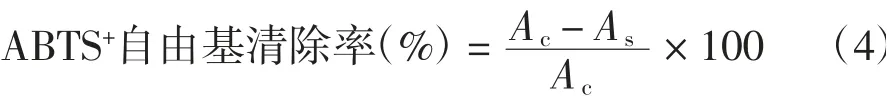
式中:Ac为对照品的吸光度;As为样品的吸光度。
1.2.7.2 羟基自由基清除能力的测定
参照Wu等[10]的方法并略作改动。分别将金银花绿原酸提取物配制成质量浓度为1、3、5、7、9、11 mg/mL的样品溶液。分别取1 mL上述不同浓度的样品溶液于20 mL具塞玻璃瓶中,依次加入1 mL 7.0 mmol/L FeSO4溶液和1 mL 6.0 mmol/L H2O2溶液,混合均匀,静置10 min,然后加入1 mL 6.0 mmol/L水杨酸溶液,充分混合,静置30 min后,在波长510 nm处测定每个样品的吸光度。以乙醇溶液代替待测液作空白,测定吸光度,以VC为对照,依据式(5)计算羟基自由基清除率。
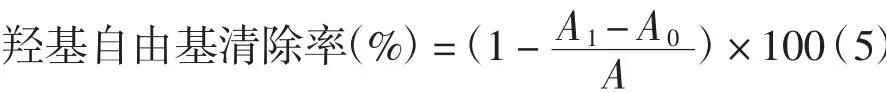
式中:A0为无水杨酸时样品液的吸光度;A1为对照品的吸光度;A为空白对照的吸光度。
1.2.8数据处理
本研究所有试验均重复3次,试验结果采用平均值±标准差表示;采用Statistics 8.0软件和Origin 9.0软件分别对试验数据进行显著性分析和作图;利用Design Expertver 8.0软件和Matlab R 2018b软件分别对组合试验进行设计和提取工艺优化。
2 结果与分析
2.1 超声功率对绿原酸提取率的影响
由图1可知,当超声功率在100~200 W范围内,随超声功率的增加,绿原酸提取率呈显著升高趋势(P<0.05)。其原因是随超声功率增加,超声“空化效应”增强,传质阻力降低,扩散系数增加,有利于绿原酸溶出[11]。当超声功率超过200 W,继续增加超声功率,绿原酸提取率呈显著降低的趋势(P<0.05)。其原因是较大的超声功率可能会破坏绿原酸结构,同时也会提高杂质在萃取溶剂中的溶解度,故造成绿原酸提取率降低[12]。综合考虑,本试验选择超声功率为100、150、200 W进行后续响应面优化试验。
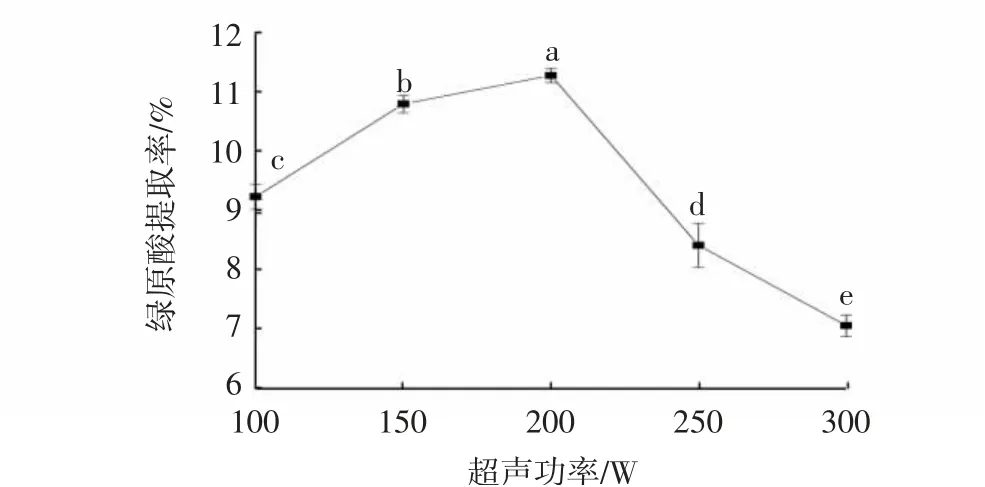
图1 超声功率对绿原酸提取率的影响Fig.1 Effects of ultrasonic powers on extraction rates of chlorogenic acid
2.2 提取时间对绿原酸提取率的影响
由图2可知,当提取时间在10~30 min范围内,随提取时间延长,绿原酸提取率显著升高(P<0.05)。这归因于在提取初期,金银花颗粒细胞内外绿原酸浓度存在较大差异,促进绿原酸由内向外扩散,从而提高绿原酸提取率[11]。当提取时间超过30 min时,随提取时间延长,绿原酸提取率无显著变化。这是因为当提取时间超过30 min时,绝大多数绿原酸被提取出来,因此,延长萃取时间对绿原酸提取率无显著变化。综合考虑,本试验选择提取时间为30 min。

图2 提取时间对绿原酸提取率的影响Fig.2 Effects of extraction time on extraction rates of chlorogenic acid
2.3 提取温度对绿原酸提取率的影响
由图3可知,随着提取温度的升高,绿原酸提取率呈现先显著升高后显著下降的趋势(P<0.05)。当提取温度为35℃时,绿原酸提取率取最大,为11.63%±0.24%。其原因是随着提取温度的升高,一方面增加果胶酶催化活性,有助于破坏植物细胞壁,降低绿原酸传质阻力;另一方面温度升高提高了绿原酸的溶解度和扩散系数,从而有利于绿原酸的提取[13]。但当提取温度过高时,高温一方面降低或灭活果胶酶活性;此外高温破坏绿原酸结构,从而降低绿原酸提取率[14]。综合考虑,本试验选择提取温度为30、35、40℃进行后续响应面优化试验。

图3 提取温度对绿原酸提取率的影响Fig.3 Effects of extraction temperatures on extraction rates of chlorogenic acid
2.4 果胶酶添加量对绿原酸提取率的影响
由图4可知,当果胶酶添加量在0.10%~0.20%时,随果胶酶添加量的增加,绿原酸提取率呈现显著升高的趋势(P<0.05)。其原因是随果胶酶添加量的增加,单位时间内果胶酶催化能力增强,使得金银花细胞壁发生不同程度的降解,绿原酸传质阻力显著降低,有利于绿原酸的提取[15]。但当果胶酶添加量超过0.20%时,随果胶酶添加量的增加,绿原酸提取率显著降低(P<0.05)。其原因是果胶酶添加量过高,金银花细胞壁破壁越彻底,此时溶剂会溶解过多的杂质,使得绿原酸溶解度降低,不利于绿原酸提取[16]。综合考虑,选择果胶酶添加量0.15%、0.20%、0.25%进行后续响应面优化试验。

图4 果胶酶添加量对绿原酸提取率的影响Fig.4 Effects of pectinase additions on extraction rates of chlorogenic acid
2.5 乙醇体积分数对绿原酸提取率的影响
由图5可知,当乙醇提取分数在40%~60%范围内,随着乙醇体积分数的增加,绿原酸提取率呈显著升高趋势(P<0.05)。当乙醇体积分数增加到60%时,此时绿原酸提取率取得最大值,为11.37%±0.13%。这归因于乙醇体积分数为60%时,乙醇极性与绿原酸极性相似,故此时绿原酸溶解度最大,进而使提取率取得最大值[11]。但继续增加乙醇体积分数,绿原酸提取率呈显著降低的趋势(P<0.05)。其原因是高浓度乙醇会溶解醇溶性杂质和色素等,从而降低了绿原酸的溶解度,造成提取率降低[17]。综上考虑,选择乙醇体积分数50%、60%、70%进行后续响应面优化试验。

图5 乙醇体积分数对绿原酸提取率的影响Fig.5 Effects of ethanol volume fractions on extraction rates of chlorogenic acid
2.6 响应面试验结果
2.6.1 模型建立与显著性检验
响应面试验方案和结果如表2所示。对自变量与响应值进行多元回归拟合分析,得到试验因素与响应值的回归模型,该模型如式(6)所示。
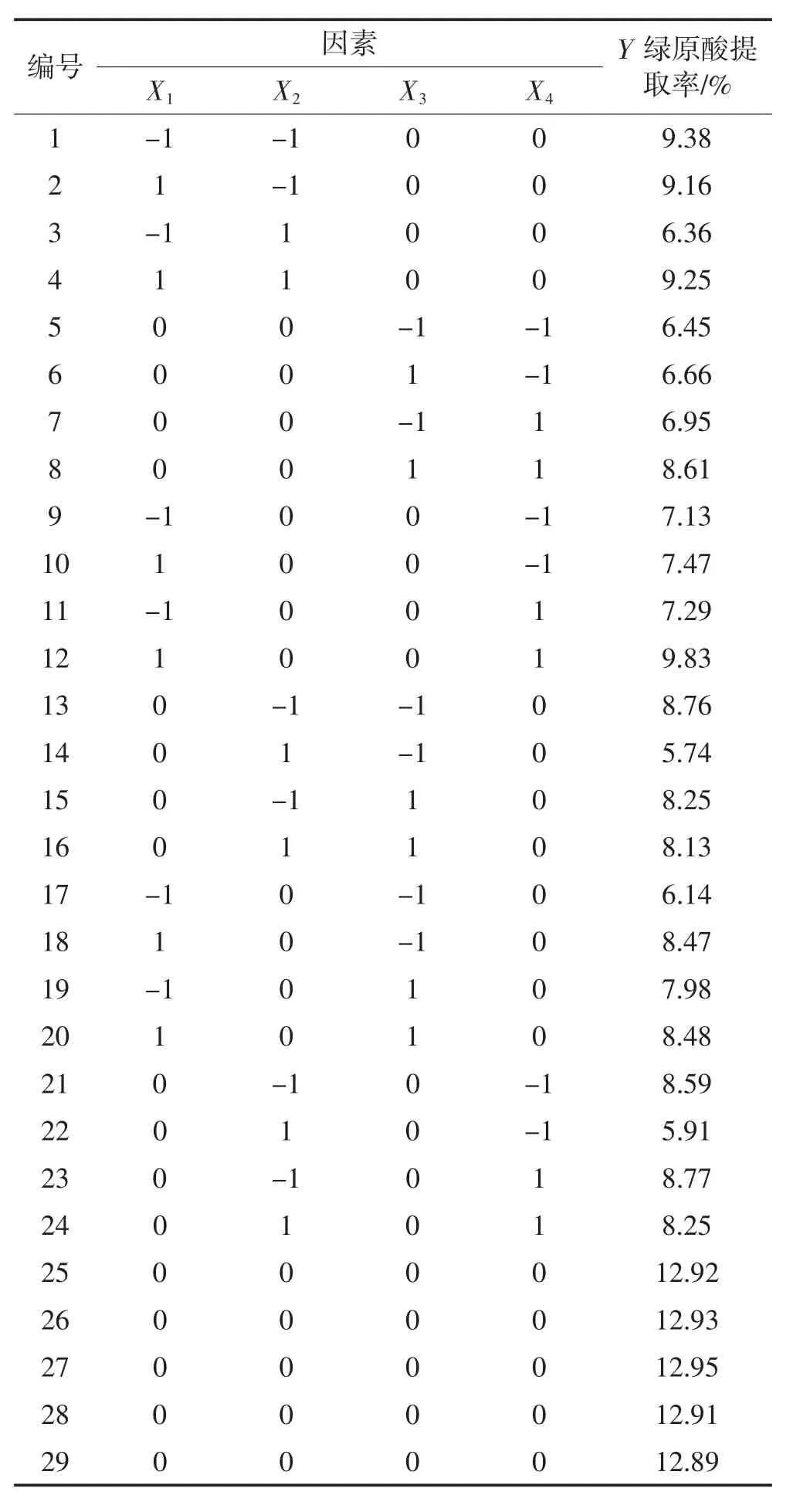
表2 响应面试验设计及结果Table 2 Experimental design and results
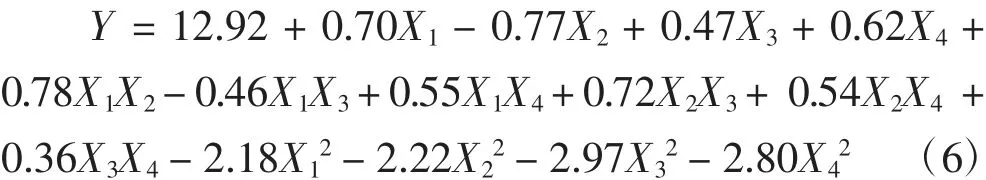
对模型进行方差分析,结果如表3所示。
由表3可知,本试验所得回归模型的R2=0.999 8,F=6 005.45,P<0.000 1,表明所建的回归方程极显著。失拟项P=0.088 1>0.05,说明回归模型失拟项不显著。综上分析可知,回归模型拟合充分,模型可靠,进一步表明利用该模型可以预测不同提取条件下金银花绿原酸提取率。
利用F值大小可以判断各因素对响应值的影响程度,F值越大,因素对响应值的影响越显著。由表3知,F(X1)=3 527.60、F(X2)=4 316.69、F(X3)=1 575.31和F(X4)=2 818.09,即各因素对金银花绿原酸提取率的影响顺序为提取温度(X2)>超声功率(X1)>乙醇体积分数(X4)>果胶酶添加量(X3),且这4个因素对金银花绿原酸提取率的影响均达到极显著水平(P<0.01)。
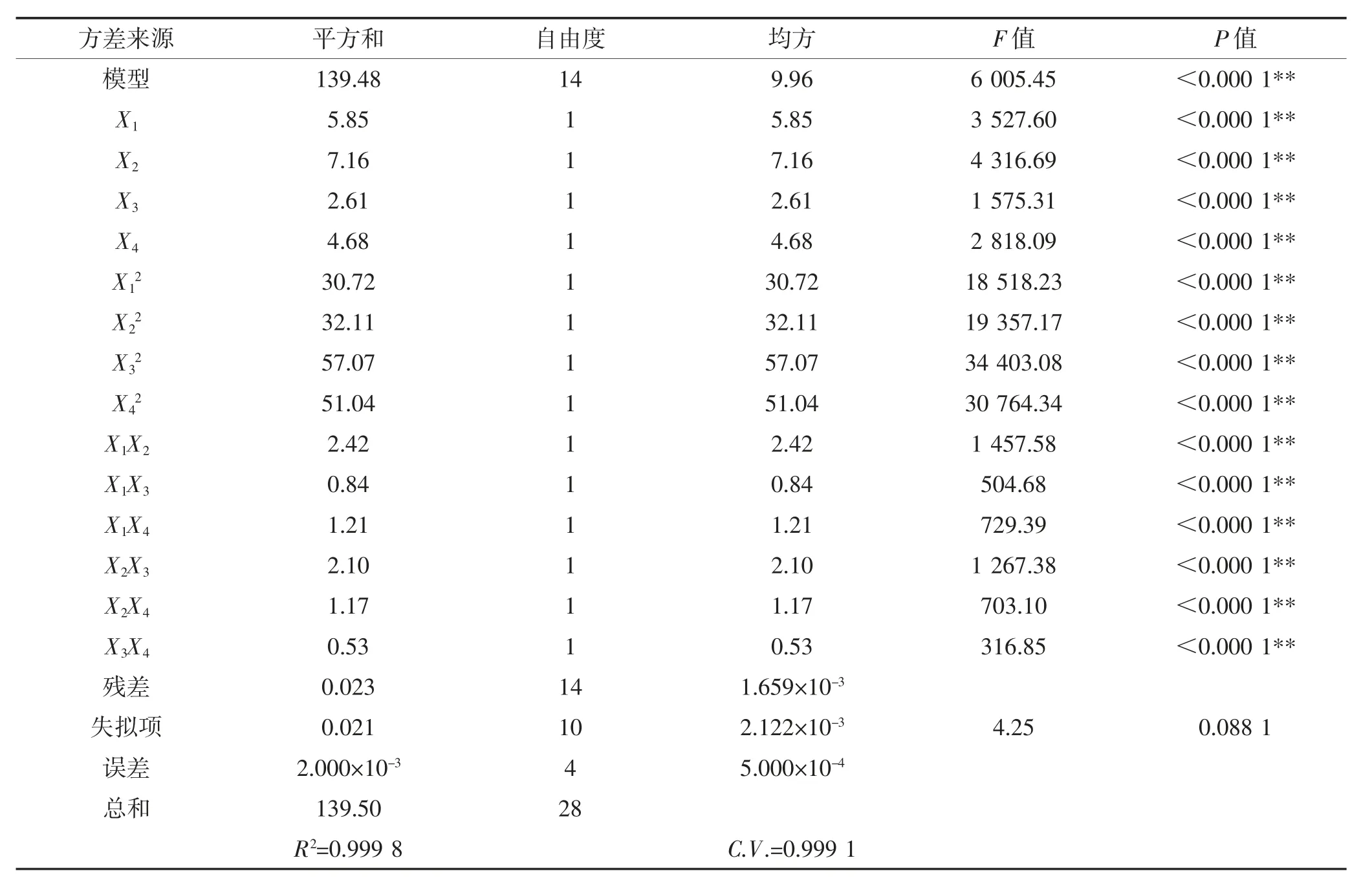
表3 金银花绿原酸工艺优化回归模型的方差分析Table 3 Variance analysis of regression model of chlorogenic acid process optimization of honeysuckle
图6 反映了各试验因素交互作用对金银花绿原酸提取率的影响。由表3方差分析结果可知,X1X2、X1X3、X1X4、X2X3、X2X4和X3X4的交互作用均对金银花绿原酸提取率有极显著影响(P<0.01)。由图6A、6C、6E、6G、6I和6K可知,金银花绿原酸提取率存在极值点。图6B、6D、6F、6H、6J和6L均呈现椭圆型,表明X1X2、X1X3、X1X4、X2X3、X2X4和X3X4的交互作用均显著影响金银花绿原酸提取率。综上可知,对金银花绿原酸提取率影响因素顺序为提取温度(X2)>超声功率(X1)>乙醇体积分数(X4)>果胶酶添加量(X3),该结果与方差分析的结果一致。
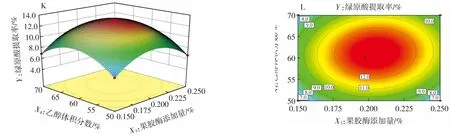
图6 各因素交互作用对绿原酸提取率影响的响应面和等高线图Fig.6 Response surface plots and contour maps showing interaction effects between every two parameters on the extraction rab of chlorogenic acid
2.6.2 绿原酸提取工艺参数优化
采用Matlab R 2018b软件对提取工艺进行优化,其结果如7所示。由图7可知,当运算迭代86次,绿原酸提取率取得最大值,此时试验因素(超声功率、提取温度、果胶酶添加量和乙醇体积分数)编码分别为0.147、-0.124、0.06、0.117,对应的因素水平分别为157.35 W、34.38℃、0.203%和61.17%,此时绿原酸提取率的理论值为13.07%。

图7 遗传算法优化结果Fig.7 The results optimized by genetic algorithm
2.6.3 验证试验
采用响应面耦合遗传算法优化绿原酸提取工艺参数为:超声功率157.35 W、提取温度34.38℃、果胶酶添加量0.203%和乙醇体积分数61.17%,在此条件下,绿原酸提取率的理论值为13.07%。考虑实际情况,将上述参数进行修正:超声功率157 W、提取温度34℃、果胶酶添加量0.20%和乙醇体积分数61%,在此条件下,绿原酸提取率为12.85%±0.37%,试验值和理论值的相对误差为1.68%。表明响应面耦合遗传算法可以较好地模拟和预测不同提取条件下的绿原酸提取率。
2.7 抗氧化活性研究
2.7.1 ABTS+自由基清除能力的结果分析
ABTS经过氧化剂氧化后生成性质稳定的蓝绿色ABTS+自由基,当有抗氧化剂加入时,ABTS+自由基与抗氧化剂发生反应,使得蓝绿色褪色或消失[18]。因此,通过测定反应液吸光度的变化,可以反应样品的抗氧化能力的强弱。由图8可知,随金银花绿原酸提物和VC质量浓度的增加,ABTS+自由基清除率显著增加(P<0.05),且呈浓度依赖性。对上述数据进行回归分析可知,金银花绿原酸提物和VC对ABTS+自由基清除率的IC50分别为(6.18±0.07)mg/mL和(8.79±0.05)mg/mL。IC50值越小,说明物质的抗氧化活性越强,对比金银花绿原酸提物和VC的IC50值可知,金银花绿原酸提物抗氧化活性显著高于VC(P<0.05)。

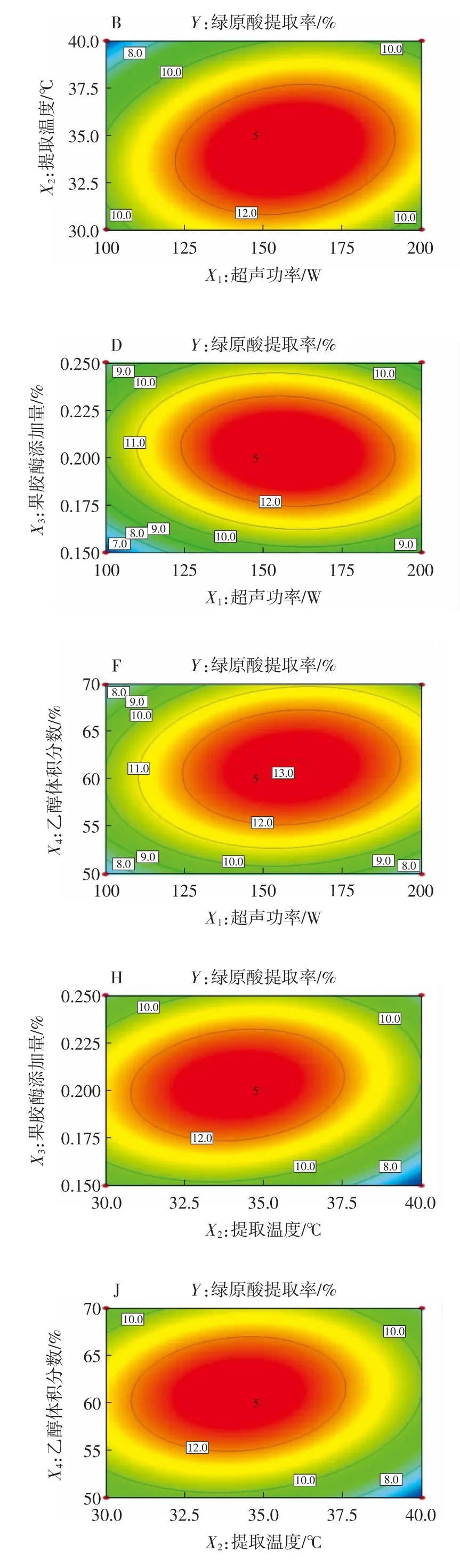
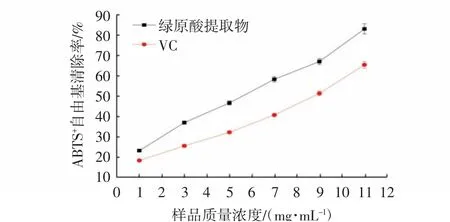
图8 金银花提取物和VC对ABTS+自由基清除能力的影响Fig.8 Effects of honeysuckle extract and VC on ABTS+radical scavenging ability
2.7.2 羟基自由基清除能力的结果分析
羟基自由基属于活性较强的自由基,几乎可以与细胞内的所有有机物发生反应,造成DNA和细胞膜损伤等变化[19]。因此,羟基自由基的清除能力是抗氧化活性评价中最重要的指标之一。由图9可知,随着金银花绿原酸提取物和VC质量浓度的增加,其对羟基自由基清除率呈显著上升趋势(P<0.05),且呈浓度依赖性。对上述数据进行回归分析可知,金银花绿原酸提取物和VC对羟基自由基清除率的IC50值分别为(4.75±0.06)mg/mL和(6.82±0.04)mg/mL。对比金银花绿原酸提取物和VC对羟基自由基清除率的IC50值可知,金银花绿原酸提物抗氧化能力优于VC。结果进一步表明金银花绿原酸提取物是较好的天然抗氧化剂。
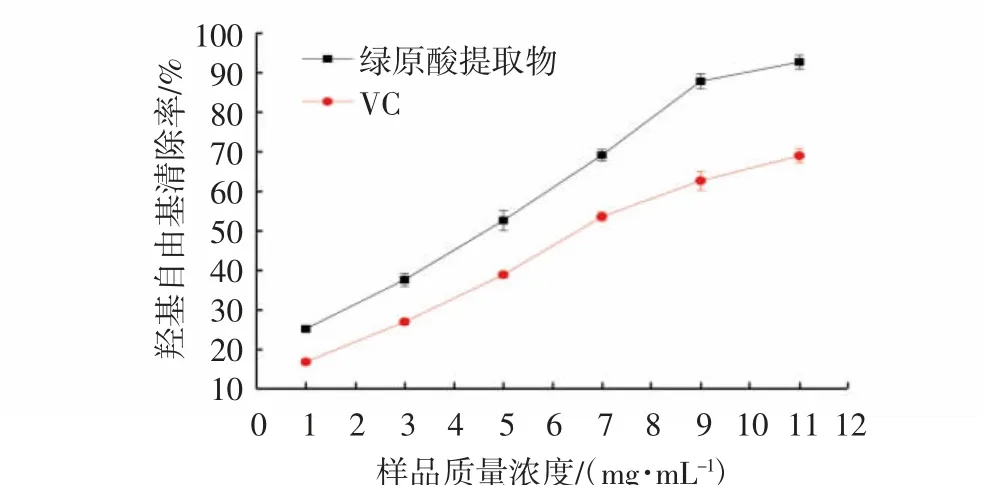
图9 金银花提取物和VC对羟基自由基清除能力的影响Fig.9 Effects of honeysuckle extract and VC on hydroxyl radical scavenging ability
3 结论
本研究通过响应面耦合遗传算法优化超声-酶辅助提取金银花绿原酸工艺,得到最优工艺参数为:超声功率157 W,提取时间30 min,提取温度34℃,果胶酶添加量0.20%,乙醇体积分数61%,在此条件下所得绿原酸提取率为12.85%±0.37%。金银花绿原酸提物对ABTS+自由基和羟基自由基清除率的IC50值分别为(6.18±0.07)mg/mL和(4.75±0.06)mg/mL。研究结果为金银花绿原酸提取提供了绿色可行的方法,同时为天然抗氧化剂的开发提供一定的参考借鉴。

