人工湿地对低污染水中氮去除的研究进展:效果、机制和影响因素
王宇娜,国晓春,卢少勇*,刘晓晖,王晓慧
(1.北京化工大学化学工程学院,北京 100012;2.湖泊水污染治理与生态修复技术国家工程实验室,国家环境保护洞庭湖科学观测研究站,国家环境保护湖泊污染控制重点实验室,湖泊生态环境研究所,中国环境科学研究院,北京 100012)
由于人为影响,全球范围内湖泊与河流的富营养化日益严重,水华爆发频繁,对环境产生不利影响,湖泊富营养化成为严重的全球性环境问题[1]。20 世纪70 年代,我国开始了湖泊水污染治理与富营养化防治工作,金相灿等[2]通过结合不同类型湖泊的治理实践经验,提出了以“污染源系统治理+流域清水产流机制修复+湖泊水体生境改善+流域管理”为主的湖泊水污染防治理念,其中提到关于低污染水的净化与治理模块,指出经污染源工程治理后达标排放的水对湖泊而言属于低污染水。低污染水源(如污水处理厂出水或非点源污染)积累的氮化合物被认为是中国水体富营养化和生态毒性的诱因[3]。因此,亟需对低污染水进行有效脱氮处理。然而由于低污染水排放与受纳水体功能不能良好衔接,以及流域低污染水净化体系的缺失,低污染水成为湖泊富营养化驱动因素之一,因此在低污染水排放前需对水中污染物进一步处理,以减少对受纳水体的污染负荷。在“十二五”水专项期间,研究学者分别在洱海、滇池、太湖等流域展开了对低污染水的控制与治理研究。低污染水浓度相对较低、波动性较大、排放量大的特点[4],要求其处理工艺耐冲击能力强。人工湿地处理技术具有建设、运行和维护成本低,效率高及景观效果好等优点,在农业径流、城镇地表径流及江河湖海低污染水处理中的应用最佳[5-7]。因此,采用人工湿地技术可在低污染水入水体前进一步削减水体中污染物负荷,保护水体水质。
人工湿地对污染物的去除常依赖物理、化学和生物手段,多取决于环境因子和工艺参数。低污染水进入人工湿地后,在植物、基质和微生物协同作用下污染物被高效去除[8]。然而低污染水碳氮比(C/N)低、碳源不足是人工湿地处理低污染水时面临的重要问题。此外,人工湿地技术在处理低污染水时,存在因冬季低温可能影响其持续稳定运行、系统结构欠佳导致污染物去除性能降低等问题。目前,人工湿地水质净化技术日渐成熟,但关于低污染水中氮的处理还需深入研究。
本文总结了低污染水的概念、特点及污染现状,探讨了不同类型人工湿地去除低污染水中氮的效果,总结了人工湿地低污染水处理系统的微生物机制,分析了不同因素(pH、溶解氧、温度、C/N、植物、基质)对人工湿地去除低污染水中氮的影响,以期为人工湿地净化低污染水的工程实践提供理论参考。
1 低污染水的概念、特点及现状
1.1 低污染水的概念
“低污染水”的概念最早应用于洱海、星云湖、抚仙湖等湖泊的水污染防治中,最初是指经污染源治理达标后排放的水,其主要水质指标不满足湖泊水质保护要求,对湖泊仍有一定威胁[2]。经不断研究发展,低污染水的含义不再局限于湖泊治理,也延伸到河水保护中,学者对低污染水的定义也不断丰富。目前常认为低污染水是主要污染物浓度超过《地表水环境质量标准》(GB 3838—2002)Ⅳ类水质标准限值,但不高于《城镇污水处理厂污染物排放标准》(GB 18918—2002)中二级标准限值的微污染河水、达标排放的污水厂出水及类似性质的水体。低污染水类型多,水体性质复杂,主要包括低污染河水、经污水处理设施处理但对河湖仍为污染源的污水处理厂处理尾水、城镇地表径流、农业径流(含农村分散性生活污水)4类[4]。
1.2 低污染水的特点
(1)排放总量大,污染负荷高
低污染水中污染物浓度显著低于生活污水。根据《城镇污水处理厂污染物排放标准》一级B 标准:低污染水中ρ(COD)≤60 mg·L-1,ρ(TN)≤20 mg·L-1,ρ(NH3-N)≤15 mg·L-1,ρ(TP)≤1 mg·L-1。滇池农田径流排水中COD 浓度范围为20.2~72.7 mg·L-1,TN浓度范围为4.0~33.5 mg·L-1[4]。太湖流域城镇地表径流中,COD 浓度范围为5.55~129.99 mg·L-1,TN 浓度范围为1.33~7.70 mg·L-1[9],显著低于其他污水浓度。
虽然低污染水的主要污染物浓度较低,但排放总量大,所以污染负荷较高。以洱海为例,“十二五”水专项“洱海低污染水处理与缓冲带构建关键技术及工程示范”的课题调查发现,近10 年,经工程治理排放的低污染水量增加3 倍以上,其与农田村落径流等低污染水总量合计每年已超过1×108m3。白献宇等[4]估算了洱海流域低污染水污染负荷,其中TN 为1 393 t·a-1,TP 为77 t·a-1。大量低污染水如不经净化直接排入水体,无法满足水体水质保护的要求。此外,由于土地利用类型、作物种植种类、温度、降雨特征(降雨强度、降雨历时和峰现时间等)和不同下垫面等因素的变化影响了农业径流和城市地表径流的产生量、污染负荷量,导致低污染水污染具有很强的随机性,这也是其难治理的重要原因[9-10]。
(2)碳氮比低,可生化性差
一方面,随各类含氮、磷物质的大量使用,城镇生活污水呈低碳源化,经污水厂的生物脱氮,碳源被大量消耗,造成尾水C/N降低[11-12],无法满足生物脱氮要求。另一方面,农田径流排水中氮主要为硝态氮,缺乏有机碳源,碳氮比低,使反硝化作用受到一定限制,造成除氮困难[13-15]。
“水十条”发布后,国内大部分污水厂被要求出水达到《城镇污水处理厂污染物排放标准》一级A 排放标准。如北京、天津以及敏感区域(重点湖库、近岸海域汇水区域)城镇污水厂对总氮、总磷的去除提出更高要求。但从污水厂排放水质分析,一级A排放标准的水质ρ(BOD5)/ρ(COD)=0.2,可生化性差。在经济发达省份,城镇污水厂进水中工业废水比例较高,以浙江省为例,工业废水水量占比超过30%,使污水厂进水ρ(BOD5)/ρ(COD)低、可生化性差,导致尾水水质不能稳定达标[11]。
1.3 低污染水污染现状
由《生态环境统计年报》[16]可知,2011—2015 年,全国污/废水排放总量不断增加,城镇污水厂建成数量一直处于上升趋势。由于政府环保力度不断加大,污水厂日处理能力不断提高,尾水排放量逐年增加。截至2019 年底,全国城市污水厂处理能力为1.77×108m3·d-1,累计处理污水量已达5.32×1010m3,低污染水产生量仍逐年增加。低污染水的去向主要有两方面:①将尾水经再生工艺处理后达到回用水水质标准并资源化利用。截至2012 年,城市污水处理回用主要用于景观环境、工业生产、农林牧业、城市非饮用水和地下水回灌5 个方向,其中,景观环境回用水和工业回用水分别占45.4%和37.0%[17]。《水务管理年报》数据显示,2009—2012 年我国再生水利用率为16.07%~19.15%,回用量趋于稳定。从2015年低污染水再利用情况看,回用的低污染水主要集中在京津冀地区,其他城市的再生水利用率普遍较低[18]。②将尾水直接排入受纳水体。以太湖为例,崔云霞等[19]分析了太湖主要入湖河流的水环境状况。其中,污水厂排放尾水占入河总量的10%~20%。然而,低污染水对污染物入河总量的贡献不限于此,还包括来自流域的农村生活排放、农田径流等其他类型。白献宇等[4]通过调查估算出洱海流域低污染水的产生量为2.01×108m3·a-1,其中,污水厂尾水占15.9%,农田径流排水和城镇地表径流分别占74.7%和9.4%。
农田径流排水中氮、磷流失量会随施肥量增加、施肥结构失调等而不断增加。2009—2018 年,全国农用氮肥施用量从2.30×107t 增加至3.79×107t,总量波动不大,整体呈上升趋势[20]。农用氮肥会随农田径流进入水体,造成受纳水体富营养化。太湖地区是我国农业最发达区域之一,耕地平均化肥施用量为600 kg·hm-2,为全国平均水平的2.16 倍,2002—2017 年太湖地区果、菜、茶种植面积显著增加,其中果园和茶园分别增加2.852×104hm2和1.892×104hm2,然而稻田种植面积显著下降1.985×105hm2,2017 年太湖地区稻田、菜园、果园和茶园的氮流失负荷分别为10 200、10 100、670 t 和250 t,磷流失负荷估算量分别为290、3 000、400 t和50 t[10]。
城镇地表径流产生量及污染负荷会因不透水地表面积增加、暴雨冲刷效应加大等而增加。由于城市化发展,1980—2015 年,京津冀城市群地区不透水地表面积急剧增加,其净增长值为12 690.14 km2,随之地表径流量呈逐年增长趋势,增长值为1.8×1010m3,增幅为11.83%[21]。王海邻等[22]于2018 年6—9 月对北京城市主干道降雨径流进行取样监测并估算年污染负荷量,结果显示,北京城市主干道径流年污染负荷产生量为:TSS 5 538.17 t、COD 451.52 t、TN 27.47 t、TP 3.20 t。此外,不同类型的下垫面也影响地表径流的产生量和污染负荷。王浩升[23]研究了武汉市不同下垫面的径流污染物浓度,结果表明COD、TN、TP 浓度均低于北京、上海、广州、昆明,估算的COD、TN、TP和SS 的年污染负荷分别为23 608.4、1 299.4、95.4 t和102 081.5 t。
虽然不同类型低污染水中主要污染物浓度较低,但其产生量大,污染负荷高,一旦直排进入受纳水体,将直接影响地表水环境质量。
2 处理低污染水的人工湿地技术
低污染水由于污染物浓度低、量大面广、可生化性差及部分水碳氮比低等特点,对污水处理技术经济性提出更高的要求。人工湿地(CWs)是模拟自然湿地的绿色处理技术,因其成本低、运行维护要求低及处理效果好等优点而备受关注,近几十年来已被广泛用于污水厂尾水、农业径流、城镇地表径流及污染河水等各类水体净化,是处理低污染水的可行且有效的技术之一[5-7]。
根据水文条件,人工湿地一般分为自由水面人工湿地(FWSCWs)和潜流人工湿地(SSFCWs)[24]。根据水流流向,潜流人工湿地可进一步分为水平流人工湿地(HFCWs)和垂直流人工湿地(VFCWs)。人工湿地系统的应用具有多种形式,如混合人工湿地(Hybrid CWs),该形式通常包括两级串联的多个平行人工湿地,也有三级以上的人工湿地组成的多级人工湿地(Multi-stage CWs)。此外,也有湿地与其他工艺的组合设计,如氧化塘+人工湿地组合工艺、厌氧池+人工湿地组合工艺等。近年来,为强化湿地处理效果,研究者提出强化型人工湿地(Enhanced CWs),如微生物燃料电池人工湿地(MFC-CWs)、人工曝气人工湿地(Artificial aerated CWs)、折流人工湿地(Baffled flow CWs)、微电解人工湿地(Micro-electrolysis CWs)、光伏电解强化人工湿地[25]等。
3 人工湿地对低污染水的处理效果
笔者检索并整理了约70 组关于人工湿地处理低污染水的文献数据,主要包括FWSCWs、HFCWs、VFCWs、组合工艺(Combined CWs)、Hybrid CWs、Enhanced CWs 以及其他人工湿地对污染物的去除率数据。
利用One-way ANOVA(SPSS 22.0)进行显著性分析,各类型人工湿地对-N 的去除率差异不显著(P>0.05),对TN和-N的去除率存在显著差异(P<0.05)。其中,VFCWs 对-N 的平均去除率最高,为85.23%。这可能与湿地内部结构、光照条件或溶解氧分布不同引起的微生物特征差异有关。SAEED等[27]的研究表明VFCWs 具有良好供氧功能与硝化作用,从运行初期就有很好的净化作用,对-N 去除效果优于HFCWs。本研究(图1)显示HFCWs对-N的平均去除率(59.43%)远低于VFCWs(85.23%),与SAEED等[27]的研究结果类似,可能是由于VFCWs中水流从表面流向底部,增强了污染物与氧气的混合,提高了-N去除率。
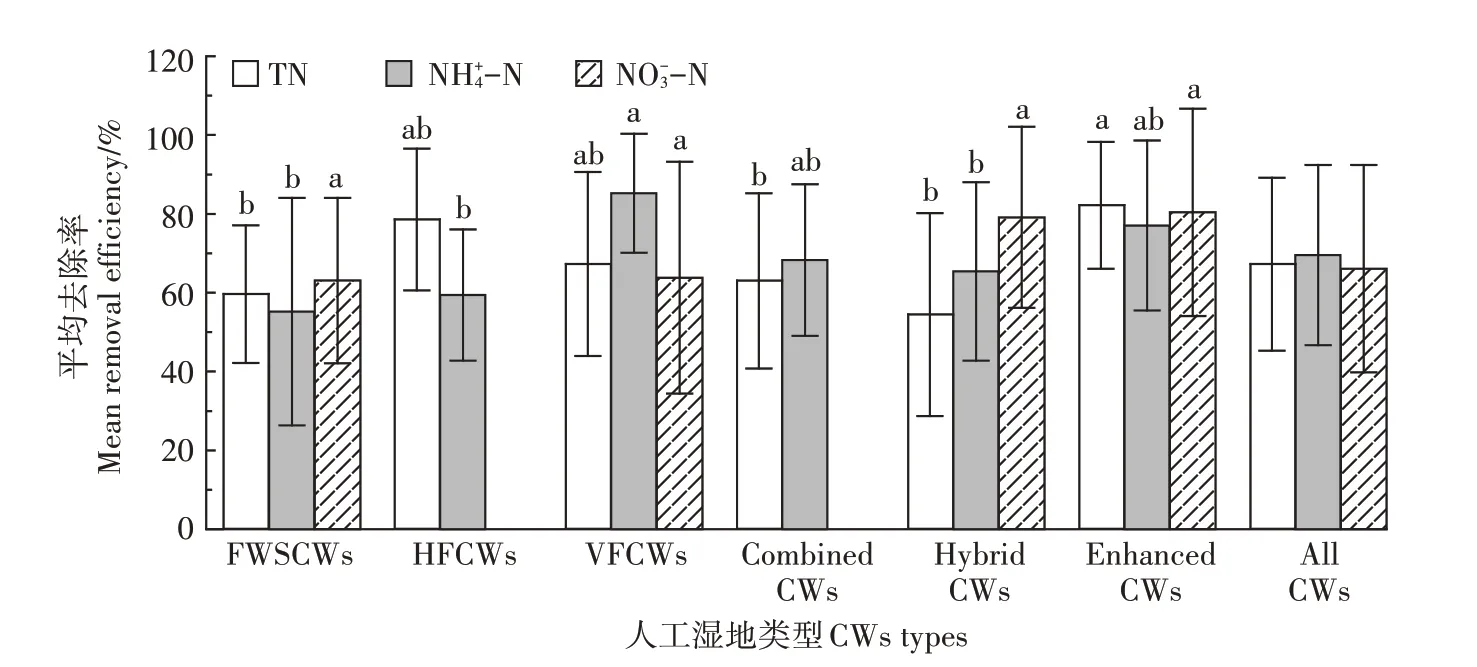
图1 不同类型人工湿地(CWs)对低污染水中3种污染物去除性能的比较Figure 1 Comparison of removal performance of pollutants in low-polluted water by different types of constructed wetlands(CWs)
目前,FWSCWs 也用于处理农业径流、低污染河水、污水厂尾水等低污染水[5,28-29]。图1 显示,FWSCWs 对-N 的平均去除率最低,为55.19%,且去除效果不稳定(标准偏差为28.82%)。这与LI 等[30]的综述结果类似,该研究显示不同国家不同规模FWSCWs 对-N 平均去除率仅为30.92%。且FWSCWs的净化性能受环境因素影响较大,因而不同尺度和环境条件下的净化性能差异较大。如HERNÁNDEZ-CRESPO 等[31]的研究显示在田间规模下FWSCWs 对污染湖水中-N 去除率为12.5%~30.92%,而WU 等[32]在实验室条件下对-N 的去除率达到92.7%~94.4%。
4 人工湿地对低污染水中氮去除的微生物机制
氮是低污染水中的主要污染物之一,是水体富营养化的主要因素之一。在人工湿地中,氮去除途径主要包括植物、基质、微生物三部分。ABE 等[28]构建了自由水面人工湿地用以处理低污染水,结果表明微生物(主要是反硝化作用)对氮去除的贡献为58.6%,土壤吸附的氮占25.2%,植物吸收对氮去除的贡献为16.2%。DU 等[33]研究复合垂直流人工湿地中不同路径对污水厂尾水中氮去除的贡献,结果表明微生物过程是复合垂直流人工湿地(IVCW)中氮的主要去除途径(占83.87%~87.94%),种植植物平均可提高8.16%的氮去除率。CHEN 等[34]构建了用于净化污水处理厂三级污水的序批式潜流人工湿地,氮稳定同位素分析结果表明,反硝化作用的贡献占54%~94%,氮沉降占1%~46%,植物吸收占7.5%~14.3%。JIA 等[35]构建的以铁改性生物炭为填料的水平潜流人工湿地系统中,微生物转化、基质吸附和植物吸收对脱氮总量的贡献分别为92.69%、2.97%和4.34%。以上研究表明,微生物对低污染水氮转化与去除的贡献最大。微生物除氮途径被认为是人工湿地处理低污染水中氮的主要机制[36]。
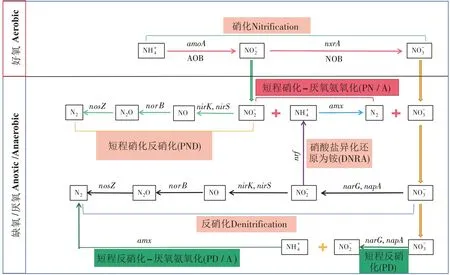
图2 微生物氮转化途径Figure 2 Microbial nitrogen transformation pathway
(1)硝化反硝化(Nitrification denitrification,ND)
硝化和反硝化是最常见的微生物脱氮过程。在硝化过程中,amoA是好氧氨氧化的功能基因,nxrA是将-N 氧化为-N 的功能性标志物[37]。好氧氨氧化细菌的生理活性与DO 和-N 浓度有关。ZHANG 等[38]的研究表明在ρ()∶ρ()=3∶0 且低DO 浓度(0.67 mg·L-1)条件下,amoA的表达会受到抑制。
反硝化作用是人工湿地去除TN的主要微生物机制。在该过程中[37],有机碳作为电子供体,-N(通过硝化过程产生)作为电子受体,在缺氧条件下最终产生N2。narG和napA是编码硝酸还原酶的基因,nirK和nirS是编码亚硝酸还原酶的主要基因,nosZ是编码一氧化二氮还原酶的基因,它们被用作功能标记来研究反硝化过程。nirS基因在反硝化中起主要作用,可将亚硝酸盐还原为N2,并以此方式在人工湿地中实现氮的永久去除。而nosZ基因通常充当完全反硝化的标志物。然而因低污染水低碳氮比的特点,反硝化效果常不理想。一些研究表明,铁、碳和硫源的引入改变了微生物群落结构,进一步强化了反硝化生物过程。
(2)自养反硝化(Autotrophic denitrification)
人工湿地中的反硝化过程取决于有机碳源,然而低污染水的低碳氮比是去除硝酸盐的主要障碍。因此,可利用无机电子供体作为替代方案。目前自养反硝化过程根据其电子供体的不同主要分为硫自养反硝化、铁自养反硝化和氢自养反硝化[39]。
①硫自养反硝化(Sulfur autotrophic denitrification)
硫自养反硝化作用是无机化能营养型或光能营养型细菌在缺氧条件下将还原态硫作为电子供体,作为电子受体,产生N2和硫酸盐()的过程[40]。LI等[41]将硫源引入系统使根际微生物群落发生变化,Denitratisoma、Sulfurimonas和Thiobacillus成为优势菌属,表明湿地存在自养和异养反硝化过程。
②铁自养反硝化(Iron-based autotrophic denitrification)
铁自养反硝化作用是光能营养型和化能营养型的反硝化细菌在厌氧条件下将Fe2+作为电子供体,作为电子受体,产生N2的过程[42]。JIA 等[35]将铁改性生物炭作为填料,显著增加了参与反硝化的相关基因丰度。其中,铁改性生物炭系统中(nirS+nirK)/bacteria 约为3.33×10-3~1.26×10-2,显著大于未经铁改性的系统,说明铁改性生物炭可显著加快反硝化中-N 的去除。此外,在铁改性系统中,(nirS+nirK)/(nosZ-Ⅰ+nosZ-Ⅱ)约为1.28~2.644,表明铁改性生物炭更能有效富集nosZ基因,促进最终的反硝化过程,并减少N2O 排放。以上研究显示,铁的引入增加了反硝化基因的丰度。此外,一些人工湿地基于微电解反应发生自养反硝化过程[43]。在微电解人工湿地中经过长时间的阳极氧化,铁离子的释放量增加。被释放的铁离子强化的铁氧化还原菌与反硝化菌具有协同作用,可以有效去除。
③氢自养反硝化(Hydrogen-based autotrophic denitrification)
氢自养反硝化作用是氢自养反硝化的细菌将H2作为电子供体,作为电子受体,进行反硝化脱氮的过程[42]。H2可以在生物反应器中直接电解产生。GAO 等[39]在电解强化水平潜流人工湿地中发现噬氢菌属(Hydrogenophaga)占24.3%,而在普通水平潜流人工湿地中仅占6.0%。噬氢菌属是一种自养反硝化菌。从前面的结果可以看出,电解结合水平潜流人工湿地可以促进以H2为电子供体的自养噬氢菌。
(3)硝酸盐异化还原为铵(Dissimilatory nitrate reduction to ammonium,DNRA)
不同于反硝化作用,硝酸盐异化还原为铵[44]是在厌氧条件下将溶解性有机碳作为电子供体,作为电子受体,将氮最终保留为-N 的生物过程,然后,-N 被植物吸收或被微生物氧化为-N。nrf是亚硝酸盐氧化为铵盐的主要标志物[37]。在湿地中,控制DNRA 的一个重要因素是电子供体,如有机碳、Fe2+和硫化物等[45]。研究表明,总碳与-N浓度的比值越高越有利于DNRA 过程的发生[46]。大多数情况下,在湿地中同时发生DNRA 和反硝化过程,但当总碳与-N 的浓度比大于12 时,DNRA 过程可单独存在[47]。
(4)同时硝化反硝化(Simultaneous nitrification and denitrification,SND)
硝化反硝化可以在同一时间、同一地点发生,称为同时硝化反硝化。在生物膜反应器中,由于溶解氧不均匀分布,形成具有氧梯度的特殊生物膜。生物膜表面细菌首先接触废水和溶解氧,然后将氨转化为亚硝酸盐或硝酸盐。在缺氧条件下,亚硝酸盐或硝酸盐进入生物膜的深层后,被还原为N2,缩短了氮去除过程反应的时间[48]。在人工湿地中,也存在同时硝化反硝化过程[36]。SUN 等[49]在安装微曝气设备的上流式垂直流人工湿地系统的-40 cm 以下位置发现了-N 和-N 同时去除的情况,推断系统中发生了SND 过程,并观察到氮功能基因amoA、nirS、nirK和nosZ的功能划分。
(5)短程硝化反硝化(Partial nitration and denitrification,PND)
(6)厌氧氨氧化(Anammox)
除反硝化作用外,厌氧氨氧化还提供了另一种永久性除氮途径。厌氧氨氧化过程是利用NH+4作为电子供体,并将亚硝酸盐还原为N2的过程。厌氧氨氧化菌是厌氧自养菌,amx是厌氧氨氧化的功能基因[37]。与传统硝化-反硝化比,厌氧氨氧化由于其显著的优势(无需外部碳源、耗氧量低)而得到广泛研究[27]。研究者在处理低污染水的人工湿地中发现了厌氧氨氧化菌及厌氧氨氧化相关功能基因。JIA 等[35]的研究发现在含铁改性生物炭填料的水平潜流人工湿地中amx的丰度约为4.78×106copies·g-1,比未加此填料的人工湿地中检测到的丰度高1.63 倍。YIN等[52]研究发现Fe(Ⅲ)可促进厌氧菌的生长,并对脱氮有积极影响。JIA 等[35]的研究也表明铁改性生物炭的添加促进了厌氧菌的丰度和活性,加快了厌氧氨氧化进程。
(7)全程自养脱氮(Completely autotrophic nitrogen removal over nitrite,CANON)
全程自养脱氮是基于短程硝化和厌氧氨氧化的一种新型节能脱氮工艺[53]。氨氧化菌及厌氧氨氧化菌通过对溶解氧的控制,使得短程硝化和厌氧氨氧化同时进行,生成N2,这种完全自养的脱氮方式是迄今为止最简单的脱氮工艺之一。CANON 具有曝气量小、无需添加有机碳源的优势。因此,此工艺可用于人工湿地处理低碳氮比和高氨氮的低污染水[54]。
(8)部分反硝化/厌氧氨氧化(Partial denitrification-anammox,PD/A)
以往的研究常集中在硝化-厌氧氨氧化工艺,因选择抑制亚硝酸盐的氧化菌较为困难,所以硝化-厌氧氨氧化工艺组合中-N 的残留和不稳定的问题亟需解决。部分反硝化(PD)和厌氧氨氧化(Anammox)的耦合(PD/A)是有前景的替代方法[55]。此过程是指由-N还原产生-N(即部分反硝化),作为厌氧氨氧化细菌的底物,将作为电子供体,最后产生N2的过程[55]。DU 等[55]指出短程反硝化有望成为城市污水厌氧氨氧化的研究方向,短程反硝化-厌氧氨氧化工艺具有反应时间短、过程控制简单及所需有机碳源少等优点[56]。在此过程中,amoA、nxrA和Anammox是主要标志物[35]。ZHAN 等[57]在潮汐式复合垂直流人工湿地系统的潮汐区发现nxrA和amoA被富集,且nxrA的绝对丰度比amoA高近5倍,表明在该系统中很难实现部分硝化。相反,nirS和AMX16S rRNA 主要富集在饱和区,平均丰度分别为2.87×107copies·g-1和2.61×107copies·g-1,表明由部分反硝化(PD)产生的和饱和区中引入的为厌氧氨氧化菌提供了底物,促进了PD/A 过程。该过程可用于同时处理含和的低污染水。
HUANG等[58]和CHEN等[59]的研究认为在处理低污染水的人工湿地中存在厌氧氨氧化-反硝化厌氧甲烷氧化-反硝化共存过程及同时硝化、厌氧氨氧化和反硝化过程等其他氮转化路径。
人工湿地中微生物脱氮过程复杂。湿地构型、工艺、环境或运行等条件不同,就可能产生不同的微生物耦合机制。总之,湿地氮转化过程极复杂,需要多途径共同作用来提高低污染水的除氮率。
5 人工湿地对低污染水中氮去除的影响因素
人工湿地对低污染水中氮的去除过程受许多关键因素影响,包括环境因素(pH、温度、碳源和溶解氧)及植物基质筛选等。分析这些环境因素的变化并提出优化措施及选择适宜的植物对提高人工湿地的氮去除率至关重要。
5.1 pH
人工湿地对低污染水中氮的去除过程受pH的影响。微生物硝化过程会产生H+,消耗碱度,导致水中pH 大幅下降,阻碍反硝化进程[8]。当pH 值为7.5~8.5时,湿地氨氧化过程最理想[60],当pH范围处于7.0~7.5时,反硝化速率最高。当湿地系统pH<6 或pH>8 时,反硝化作用则会受抑制,pH 等于5 时,反硝化速率变慢,活性下降。pH 降到4 以下时反硝化作用受到很大抑制甚至消失[27]。
5.2 温度
温度对人工湿地污染物去除过程也具有重要影响。温度变化一方面影响植物呼吸,另一方面直接影响湿地系统中微生物作用。FAULWETTER 等[61]的研究表明当温度范围在28~36 ℃时,利于人工湿地硝化作用,温度低于6 ℃或高于40 ℃时,硝化作用几乎完全受抑制。同样,在低温下,反硝化速率慢慢减缓。为适应或改善温度对低污染水中氮去除效果的影响,一些学者研究发现采用对季节适应性更高的植物或选择合理的植物配置可改善低温对湿地系统净化效果带来的负面效应。WANG 等[62]开发了两级折流式表面流人工湿地对河流进行生态修复,随温度变化,TN、-N 和CODCr的去除效果受显著影响。人工湿地在夏季和秋季具有最佳处理效果,而在11 月至次年3 月间处理效果最差。适当替换和引入适应季节变化的湿地植物,可降低低温对系统的负面效应。此外,覆盖系统可改善低温对脱氮产生的影响。DING等[63]评估了小型潜流人工湿地中不同覆盖系统对氮转化的影响(温度条件设定约为10 ℃),在凤眼莲植物覆盖系统中-N 和TN 的去除率最高,分别为56.3%和60.1%,泡沫板覆盖系统和无覆盖系统中的-N去除率分别为37.9%和38.3%,都低于植物覆盖系统的去除效果。为改善低温对系统的影响,LIANG等[64]提出了一种寒冷气候区人工湿地建设新思路,即利用浅层地热能的新型湿地结构,能使人工湿地在冬季正常运行,利于寒冷地区人工湿地的推广应用。
5.3 碳氮比
低污染水具有低C/N 的特性,不能为污水中的微生物提供足够的碳源,抑制了微生物的生长,降低了生物反硝化速率,从而进一步影响低污染水的脱氮效果。表1总结了不同C/N 下不同类型人工湿地的脱氮效率,以及强化措施和强化后的脱氮效果。
由图3 可以看出,不同C/N 下,人工湿地对TN 去除效果不同,TN 去除率随着C/N 增加而增加。当C/N为12 时,TN 去除率高达90%,而当C/N 为0~3 时,TN的去除率低于40%。为了改善因低C/N 造成去除率低的问题,研究者提出多种增加污水碳源或增加电子供体的方法(表1):①引入电子供体。LI 等[41]将硫源引入人工湿地,实现高脱氮率(总无机氮去除率63.5%~84.8%,-N 去除率90.2%~100%)。②外加植物碳源(植物发酵液)。FU等[69]和ZHANG等[70]通过添加植物发酵液的方式提高C/N,使得TN 去除率分别提高到92.8%和97.1%,但这种方法可能会增加人工湿地堵塞的风险,降低了这种碳源的实用性。③配置大型植物。作为替代策略,ZHAO 等[65]在人工湿地中配置冷季大型植物,不仅避免因外源植物碳源带来的负面影响,还将-N 和TN 的平均去除率从41.6%和70.2%分别提高到68.6%和83.7%。④固相反硝化。与可溶性碳源相比,固相反硝化可避免COD 过量积累[66]。YANG 等[66]和SUN 等[49]采用固相反硝化技术,提高了低污染水中氮的去除率。⑤电化学方法。近几年,一些研究者还通过电化学工艺与人工湿地工艺结合法改善低污染水处理效果,如铁碳微电解强化人工湿地工艺[26]和微生物燃料电池工艺[71]使得出水达到地表水环境质量Ⅴ类标准。
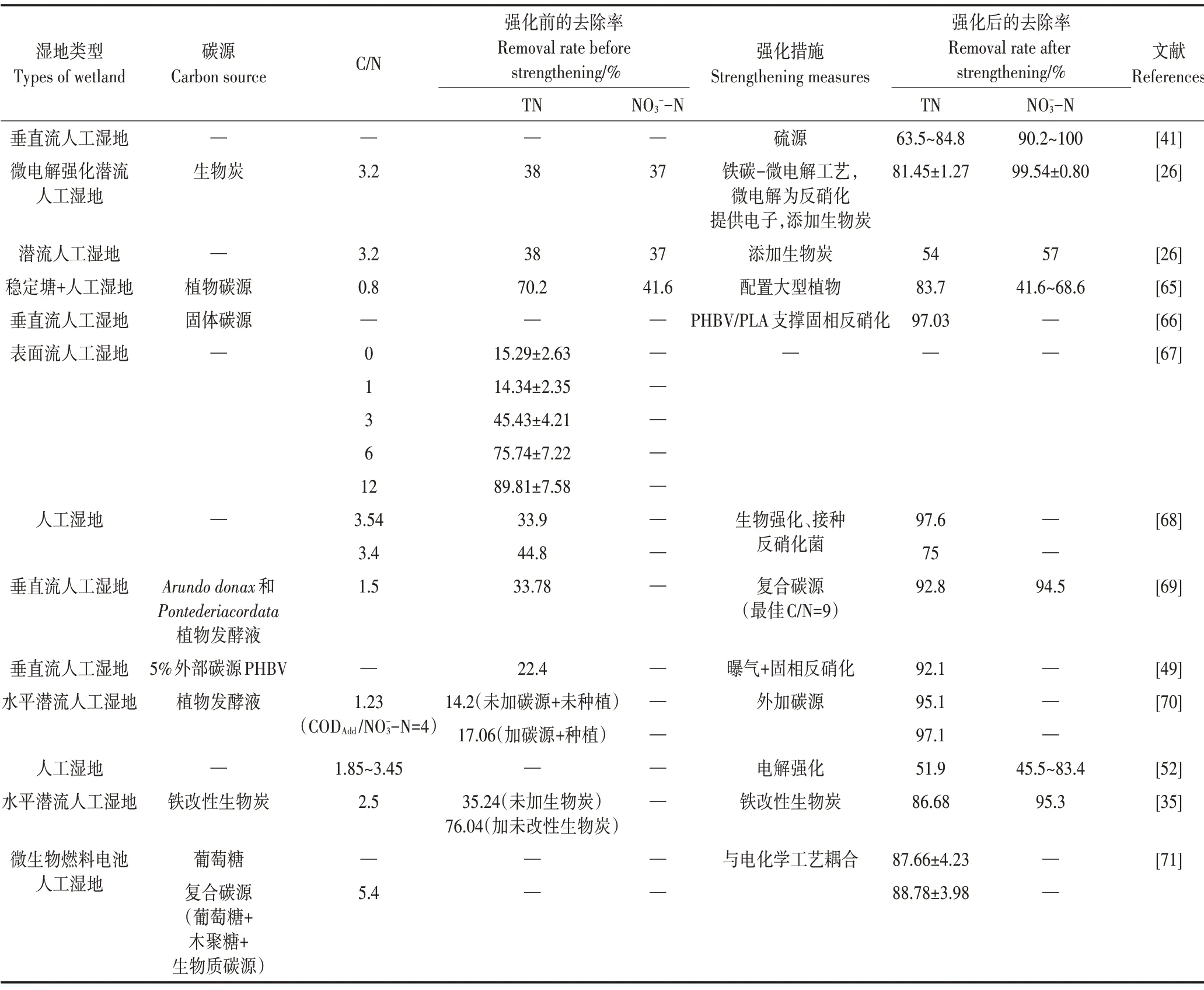
表1 不同强化模式下人工湿地对不同C/N低污染水的脱氮效率Table 1 Nitrogen removal efficiency of different C/N low-polluted water by constructed wetland under different intensification modes
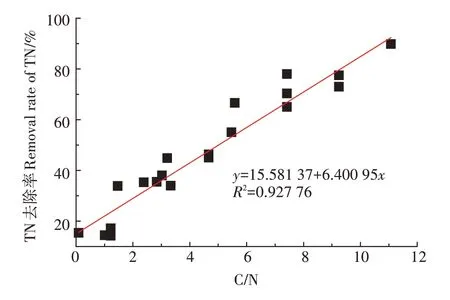
图3 不同C/N下TN的去除率Figure 3 The removal rate of TN with different C/N
5.4 溶解氧(DO)
DO 是影响人工湿地污染物去除的重要因素之一。高浓度DO 会抑制反硝化,当DO 浓度低于0.5 mg·L-1时,不会发生氨氧化,这是DO影响污染物去除的直接原因[72]。间接原因是DO 影响有机碳浓度,从而影响反硝化过程。传统潜流人工湿地因DO 不足、DO 分配不当等问题使其对低污染水的去除性能受限。因而可采取多种改善措施来增强人工湿地对污染物的去除性能:①人工曝气被证明是一种改善潜流人工湿地中DO浓度、提高污染物去除率的有效方法。SUN 等[49]采用微曝气法使人工湿地中-N 的去除率提高了40.8%。YANG等[66]的研究表明在人工湿地中引入曝气能获得较高的-N(91%)和TN(97.3%)去除率。②污水再循环。LIN等[73]构建了由前曝气和内部再循环组成的创新湿地系统,-N 去除率由15.1%~78.3%提高到98.5%~98.6%,凯氏氮(TKN)由18.2%~77.1%提高到93.5%~94.3%,去除效果明显改善。③采用不同孔隙率的基质也可改善人工湿地DO供应。FU 等[74]的研究显示以“砂+活性炭+陶粒”为填充基质的系统对-N 和TN 的去除率最高,分别为97.4%和96.2%。④基于新技术的新型氧气转移方法。如一种潮汐流运行方式[57]的人工湿地,可处理低C/N 的污水厂尾水,并获得较高-N(85.08%)和TN(81.18%)去除率。
5.5 其他因素
在人工湿地系统中,植物的筛选和填料的选择也是重要的考虑因素。人工湿地处理低污染水的过程中,合适的植物配置与填料是污染物高去除率和系统稳定性的保证。
人工湿地处理中常用的大型植物包括挺水植物、沉水植物、浮叶植物和自由漂浮植物[24]。然而在人工湿地中能广泛应用的植物种类不多。在植物的选择上,应推荐适应寒冷气候、适应低污染水质、氮素净化效果好及适合本地区生长且经济的植物。潘傲[75]的研究表明,在冬季沉水植物的TN 去除效果比挺水植物更稳定。张瑞斌[76]研究了旱伞草、美人蕉、伊乐藻、金鱼藻4 种水生植物对太湖流域污水处理厂尾水中氮的去除差异,结果表明挺水植物旱伞草和沉水植物金鱼藻的综合净化效能较强。王骥[77]研究不同挺水植物(再力花、菖蒲、茭白和鸢尾)对低污染河水的净化效果,结果表明再力花具有较高的污染去除率。然而,多种植物的合理搭配比单一植物具有更好的处理效果。孙映波等[78]选择了香根草、风车草、美人蕉、菖蒲、再力花、花叶芦竹、梭鱼草、黄花鸢尾、水葱和蜘蛛兰10 种净化能力较强的挺水植物,研究不同的植物组合对河涌污水污染物的净化效果,结果显示香根草+风车草+美人蕉+菖蒲+再力花的配置方式处理效果最佳。植物的选择还应结合当地情况,可考虑在生产粮食的同时,发挥人工湿地的作用,如在太湖流域可开展稻田湿地对低污染水中氮的净化研究。薛利红等[79]的研究显示稻田湿地对低污染水中TN 的去除率可达77%。此外,还有学者研究应用海菜花处理洱海低污染水的可行性[80]。海菜花属于沉水植物,为中国特有物种,它具有较高的食用、药用和观赏价值。低污染水的营养足以保证海菜花生长,而海菜花四季生长旺盛,具有一定的净水能力,同时也为当地带来了较好的经济效益。
人工湿地使用的常规填料一般有沸石、砾石、陶粒、砂等[81]。然而低污染水C/N 低且缺乏有机碳源,只使用常规材料无法达到严格的排放标准。一些处理低污染水的人工湿地中会添加生物炭作为填料的一部分,或者将加入铁源、硫源的填料应用到湿地中,以达到较好的氮净化效果[35,41]。不同的填料会形成不同的溶解氧环境,如以“砂+活性炭+陶粒”为填充基质的系统表现出更为多样化的DO 条件[74],有利于好氧硝化-反硝化和厌氧氨氧化进行,对-N和TN的去除率最高,分别为97.4%和96.2%。
6 结论
(1)低污染水指主要污染物浓度超过《地表水环境质量标准》(GB 3838—2002)Ⅳ类水质标准限值,但不高于《城镇污水处理厂污染物排放标准》(GB 18918—2002)二级标准限值的微污染河水、达标排放的污水厂出水及类似性质的水。低污染水类型多样,水体性质复杂,主要包括低污染河水、经污水处理设施处理达标但对水体仍为污染源的污水厂尾水、城镇地表径流、农业径流(含农村分散性生活污水)4 类。低污染水具有污染物浓度低、排放量大、污染负荷高及低碳氮比等特点。
(3)在人工湿地中,氮去除途径主要包括植物、基质、微生物去除。微生物在人工湿地对低污染水的脱氮过程中至关重要(贡献率大于50%)。常规微生物氮转化途径包括氨化、硝化、反硝化、异化硝酸盐还原,非常规脱氮途径包括短程硝化反硝化、厌氧氨氧化、完全自养脱氮、部分反硝化-厌氧氨氧化、同时厌氧氨氧化-反硝化厌氧甲烷氧化-反硝化等。总之,人工湿地的氮转化过程极为复杂,须通过多种途径提高低污染水中氮的去除率。
(4)人工湿地对低污染水氮去除的效果受多种环境因素影响,包括pH、温度、碳源以及溶解氧等。选用对季节适应性更高的植物或选择合理的植物配置、植物覆盖系统、新型湿地结构(如含浅层地热能设计)等措施可有效改善低温对湿地系统净化效果带来的负面效应。通过采用外部碳源、固定反硝化、微电解强化及微生物燃料电池等措施可提高低C/N 废水的脱氮率。针对人工湿地内部溶解氧分配不当的问题,可通过曝气、前置曝气+内部再循环、不同孔隙基质组合及潮汐流运行等措施改善溶解氧条件,从而提高人工湿地净化低污染水的能力。此外,合适的植物配置与适当的填料也是低污染水中氮的高效去除和系统稳定性的保证。
(5)目前,关于人工湿地处理低污染水的微生物去除机理和影响因素,以及微生境与设计运行条件的内在联系和耦合机制尚不清楚,下一步应加强这些方面的研究。

