中甸牦牛HIF-1α基因表达差异分析
唐 嘉, 杨 宇, 杨 凯, 和占星, 金显栋, 亐开兴*, 王 昕*
(1. 陕西省动物遗传育种与繁殖重点实验室,西北农林科技大学动物科技学院,陕西 杨凌 712100;2.云南省草地动物科学研究院,昆明 650212)
中甸牦牛是云南省迪庆州高原藏区独有的牦牛品种,是高寒地区的役、乳、肉兼用型地方优良品种[1-2]。中甸牦牛适应高山自然气候环境,主要生活在海拔3 000~4 300 m高原和高山垂直带,具有耐严寒、耐低氧、耐放牧、耐粗饲、采食能力强等优良特点[3-4]。牦牛养殖业是高度适应高寒生态条件的特定生态养殖模式,是广大农牧民世代经营并赖以生存和发展的基础产业,发展牦牛业对提高藏区人民生活水平、繁荣藏区经济和文化传承等具有重要作用。但其目前仍存在生产性能低、牧场载畜力下降、新技术推广迟缓等问题[3,5],中甸牦牛的基础研究薄弱。
低氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)是一种基本的螺旋-环-螺旋蛋白,由α和β两种蛋白质的异质体组成,是在研究低氧诱导的EPO(促红细胞生成素,erythropoietin)基因表达时被发现的[6]。HIF-1α基因受缺氧信号的调控,是HIF-1的活性亚基;HIF-1β亚基在细胞内稳定表达,起结构性作用。HIF-1α亚基在翻译后会被降解,因而在正常氧饱和度下的细胞中基本检测不到HIF-1α亚基的表达;而在缺氧状态下,HIF-1α亚基的降解被抑制,α和β亚基形成有活性的HIF-1,转移到细胞核内调节多种基因的转录[7-9]。通过氧分压对HIF-1活性的控制是通过改变HIF-1α亚基的水平来实现的[8,10]。HIF-1缺氧诱导的特异性和敏感性在哺乳动物转录因子中独一无二,作为急、慢性缺氧生理反应的重要介导因子,HIF-1是介导这些反应的包括心脏和血管的系统发育所必需的。无论是在细胞还是在机体的局部水平,HIF-1都是低氧信号传递的重要枢纽,而HIF-1α被认为是细胞低氧感应所必需的核心转录因子[8,10-12]。
牦牛具有很多生理学特征使它们适应高海拔地区的生活,包括心肺体积大、觅食能力强、对外界环境敏感和能量代谢高等,在天然的低氧环境经过长期的进化也形成了特有的耐低氧适应机制,牦牛对低氧环境在分子层面上做出的适应性和调控是极其复杂多样的[13-14]。然而高原地区常年缺草缺料,牦牛产业处于传统“夏肥-秋壮-冬困-春乏”的恶性循环中,寻求草料丰富的农区进行异地育肥势在必行,可大幅度提高牦牛生产力,缩短饲养周期,同时改善牛肉品质,获取较高的养殖效益[5,15]。本试验为了比较中甸牦牛HIF-1α基因在不同饲养条件下的心脏、肝脏、肺脏、肾脏、背脂、胰脏和眼肌等组织器官中的差异表达水平,以揭示牦牛这一高原土著哺乳动物的耐低氧、高海拔及对不同饲养条件下的分子适应机制,为探讨异地驯养牦牛的生产问题提供一定的理论参考。
1 材料与方法
1.1 试验材料
1.1.1 样品采集 样本采自于高山放牧海拔>3 200 m云南省香格里拉市(年均气温5.8 ℃)的成年中甸牦牛7头(>5岁,年均气温5.8 ℃)和异地圈养于1 910 m昆明小哨示范牧场1.5年以上(年均气温14.92 ℃)育肥的中甸牦牛2头(>3.5岁)。屠宰后取其心脏、肝脏、肺脏、肾脏、背脂、胰脏和眼肌等组织器官,剪碎后放入冻存管进液氮罐保存,带回实验室-80 ℃保存备用。
1.1.2 主要试剂 RNAiso Plus购自宝生物工程(大连)有限公司(Cat. No.9109);DEPC水购自Sigma公司(Cat. No.V900882)。荧光定量PCR相关试剂:反转录试剂iScriptTM cDNA Synthesis Kit购自BIO-RAD公司(Cat. No.170-8891);荧光染料SsoFastTMEvaGreen Supermix购自BIO-RAD公司(Cat. No.172-5201AP)。
1.1.3 主要仪器 超净工作台(SW-CJ-1FD)购自苏州净化设备有限公司;高速冷冻离心机(75005440)购自Thermo Fisher Scientific公司;凝胶成像系统(Tanon-1600)购自天能科技有限公司;电泳仪(DYY-7C)购自北京六一仪器厂;移液器(KA0052521)购自DRAGON公司;荧光定量PCR仪(580BR 12007)购自BIO-RAD公司、恒温水浴锅(HWS12)购自上海一恒科学仪器有限公司。
1.2 试验方法
1.2.1 引物设计 根据NCBI GenBank中公布的HIF-1α基因序列(NC_037337.1)和以GAPDH基因(NM_001034034)为内参设计引物(表1)用于PCR检测,引物由昆明硕擎生物科技有限公司合成。

表1 引物信息表
1.2.2 RNA提取及反转录 剪取100 mg左右解冻组织样品加入到研磨器中,待组织样品研碎后加入1 mL RNAiso Plus(TRIZOL),震荡使其缓冲液与样本均匀混合。将离心管横放在架子上,4 ℃静置20 min后,12 000 r/min离心10 min。取上清(600~800 μL),取上清过程中尽量不要吸到组织碎片,加入200 μL氯仿,在震荡器上震荡混匀后,4℃静置10 min,12 000 r/min离心15 min。离心结束后,用移液器小心吸取上层无色溶液(400~600 μL)于无RNase的1.5 mL离心管中,加入与上清等体积的异丙醇,上下颠倒充分摇匀,4 ℃静置10 min,12 000 r/min离心10 min,使RNA沉淀于离心管底部。小心倒去上清,向离心管内加1 mL 75%乙醇进行洗涤,颠倒混匀后4 ℃静置10 min,12 000 r/min离心10 min。弃去上清,轻甩,用吸水纸吸干离心管壁上的液体,可以在底部看到RNA沉淀,根据沉淀的大小,用不同体积的DEPC水(50~100 μL)溶解。将溶解后的RNA分装到PCR管后冻存于-80 ℃。按照反转录试剂盒(iScriptTM cDNA Synthesis Kit)说明书,将提取的RNA反转录为cDNA,反应体系如表2所示。

表2 反转录反应体系
1.2.3 实时荧光定量PCR反应 反应体系如下:SYBR 10 μL,上游引物0.8 μL,下游引物0.8 μL,cDNA 1.5 μL,DEPC水6.9 μL,反应总体系为20 μL。荧光定量PCR反应程序:95 ℃预变性90 s;95 ℃变性15 s,95 ℃~55 ℃梯度退火20 s;循环35次;收集溶解曲线65 ℃升高到95 ℃,每5 s升高0.5 ℃。
1.3 数据处理
首先计算HIF-1α基因的相对表达量,再采用SAS 9.2软件的GLM程序分析不同器官组织和不同饲养条件对中甸牦牛HIF-1α基因相对表达量的影响,模型如下:
Yijkl=μ+ti+aj+tak+eijkl
其中:Yijkl为HIF-1α基因相对表达量;μ为总体均值效应;ti为不同组织器官效应;aj为不同饲养条件效应;tak为不同组织器官和不同饲养条件的互作效应;eijkl为随机残差效应。结果用“最小二乘均值±标准差”表示,并进行多重比较;P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 HIF-1α基因在不同饲养条件下及不同组织器官中的表达分析
由表3可看出,HIF-1α基因在不同饲养条件下的中甸牦牛不同组织器官相对表达量的最小二乘方差分析结果表明,不同组织器官的HIF-1α基因相对表达量有极显著的差异(P<0.01),异地饲养对HIF-1α基因相对表达量有显著影响(P<0.05)。

表3 不同饲养条件下中甸牦牛不同组织器官HIF-1α基因相对表达量的最小二乘分析
由图1可见,通过比较HIF-1α基因在不同饲养条件下及不同组织器官中的相对表达量,HIF-1α基因的相对表达量在高山放牧的中甸牦牛肝脏中显著高于圈养育肥的(P<0.05),其余组间差异不显著(P>0.05)。
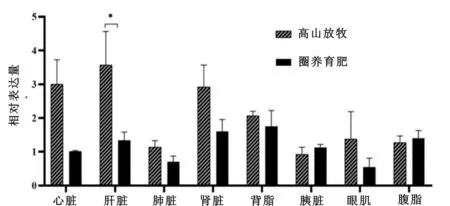
图1 中甸牦牛HIF-1α基因在不同饲养条件下及不同组织器官中的表达量
2.2 HIF-1α基因在不同组织器官中的表达分析
由表4看出,HIF-1α基因在中甸牦牛不同组织器官中相对表达量的最小二乘均值(LSM)及多重比较结果表明,HIF-1α基因在中甸牦牛的肝脏、肾脏、心脏和背脂中表达量较其它组织器官的高(P<0.05),肝脏中的相对表达量极显著高于腹脂、眼肌、肺脏、胰脏中(P<0.01),肾脏、心脏中的表达量极显著高于肺脏、胰脏中(P<0.01),显著高于腹脂、眼肌中(P<0.05);在肺脏、胰脏、眼肌和腹脂之间的表达量无显著差异(P>0.05),以胰脏、肺脏和眼肌的表达量最少。
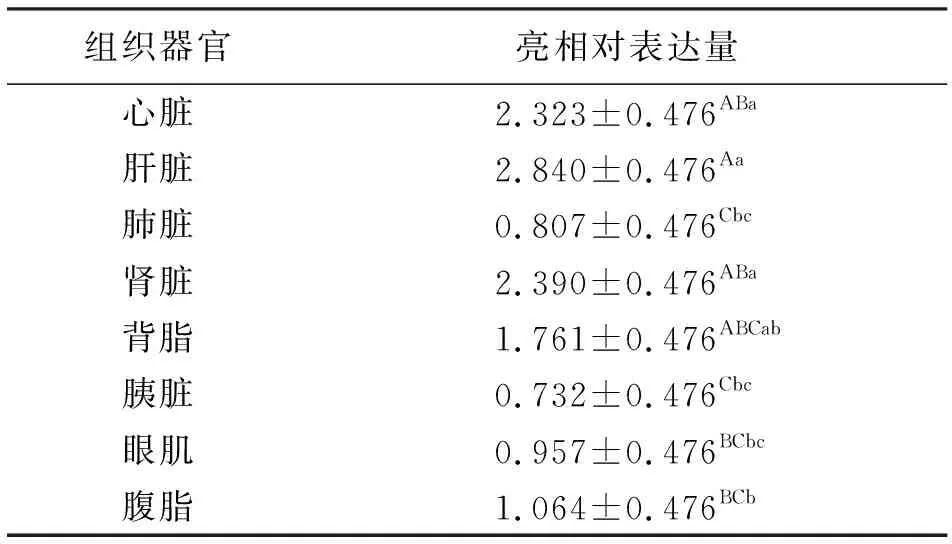
表4 中甸牦牛不同组织器官HIF-1α基因相对表达量的最小二乘分析
2.3 HIF-1α基因在不同饲养条件下的表达分析
由表5看出,HIF-1α基因在不同饲养条件的中甸牦牛中相对表达量的LSM及多重比较结果表明,HIF-1α基因在高山放牧的中甸牦牛中的相对表达量显著高于圈养育肥的中甸牦牛,是异地圈养表达量的1.7倍(P<0.05)。

表5 不同饲养条件下中甸牦牛HIF-1α基因相对表达量的最小二乘分析
3 讨论
HIF-1α是作为低氧应答信号通路中的关键基因,通过调节下游基因的表达水平,还能介导能量代谢、细胞生长和凋亡、血管新生、氧的摄取和运输等表达,以及氧平衡状态的调节。常氧状态下,HIF-1α经泛素化后迅速被蛋白酶降解,而在低氧高寒条件下HIF-1α在核内迅速积累,与HIF-1β结合形成功能性转录因子复合体HIF-1,呈高度表达,是维持低氧条件下氧平衡的关键性转录因子[10-11,16-18]。通过研究高原动物对环境的适应性机制,有人发现机体并不依赖某些器官功能的变化,更主要的是通过调整细胞代谢、低氧诱导因子HIF-1α信号通路的基因表达等分子水平的改变而适应高原环境,所进化的适应性机制主要有肌红蛋白(Mb)及血红蛋白(Hb)含量增加、血红蛋白氧亲和力增加、血管内皮生长因子(VEGF)及舒张因子(EDRF)含量增加、细胞代谢及内呼吸适应等[11,16-18]。研究发现,低氧应答信号通路中的重要基因HIF-1α在牦牛以及藏族人群中都受到剧烈的正向选择,表明该基因在高海拔适应性中具有重要作用[19-20]。高原地区地理位置独特、自然环境恶劣,因而牦牛需要克服低氧、低温、高紫外线辐射等恶劣因素,除了生理形态上适应,其基因组也发生了极大的变化[21]。
HIF-1α基因mRNA表达为揭示高原土著哺乳动物的适应性机制提供了分子基础,在各种哺乳动物如藏羚羊、高原鼠兔、鼹鼠、牦牛等的不同组织中广泛表达,具有组织特异性[22-31]。在各种组织中的HIF-1α基因表达水平不一,对于藏羚羊,HIF-1α基因表达以肺脏最高,显著高于藏绵羊和平原绵羊,而通过驯化的藏绵羊的基因表达水平也显著低于藏羚羊[23],马岗鹅HIF-1α基因表达以肺脏和胰腺较高[24]。而在牦牛的报道中,HIF-1α基因在麦洼牦牛肝脏和脑中高度表达[25],在青海家牦牛睾丸和脾脏中的表达量高于其他组织器官[26],而在甘南牦牛中其在心脏中表达量高于骨骼肌和肝脏,肝脏中的表达量在三者中最低[27]。本研究首次建立中甸牦牛HIF-1α基因表达差异的检测方法,高山放牧和异地饲养的中甸牦牛在不同组织器官中均有表达,在肝脏、肾脏、心脏中显著高表达,在眼肌、胰脏和肺脏中的表达量较少。因此,推测不同高原土著动物的HIF-1α基因在组织中表达的特异性可能对于维持体内HIF-1α高水平有一定的调节作用,而且不同高原土著动物中HIF-1α基因的组织差异性较大,其遗传机制需进一步研究。
本研究通过将原本在海拔>3 200 m、年均气温5.8℃的迪庆州高山放牧的中甸牦牛异地圈养于海拔1 910 m、平均气温14.9 ℃小哨示范牧场,通过比较二者HIF-1α基因的相对表达量,首次发现高山放牧的中甸牦牛中显著高于圈养育肥(昆明饲养时间>1.5年)的表达水平,相差1.7倍多,跟鼹鼠的低氧调节机制接近[31];同时,发现高山放牧的中甸牦牛HIF-1α基因在肝脏的相对表达量显著高于圈养育肥的水平。本研究结果与藏鸡胚胎的表达模式不一样[32],与短时间(7 d)饲喂的高原鼠兔的表达水平也相去甚远[33]。本研究结果可能从一个侧面反应了中甸牦牛适应异地饲养的分子变化水平,但要全面综合探讨高原动物不同组织器官中HIF-1α基因表达差异,有待考虑更多基因的表达水平。
4 结论
作为低氧应答信号通路中的关键基因,HIF-1α基因在中甸牦牛不同组织器官中广泛表达且具有组织特异性,其在不同海拔饲养条件的相对表达量具有显著差异。

