血浆miR-130a-3p在高原低氧环境中表达的研究*
闫 岩,袁云龙
南京医科大学附属苏州医院/苏州市立医院医学检验科,江苏苏州 215000
微小核糖核酸(miRNA)是一类长度约22个核苷酸的小的非编码RNA,它们能够通过在转录后水平降低或阻断信使RNA的翻译来调节基因的表达,从而参与多种生理、病理过程[1]。miRNA稳定存在于多种体液中,并且可作为许多疾病的潜在生物标志物[2-3]。缺氧或低氧张力,是一种独特的环境压力,能够引起转录因子和信号蛋白的广泛变化以协调细胞在代谢、增殖、DNA修复和凋亡中的适应。机体调控细胞适应缺氧的过程是复杂且不完全相同的。一些证据表明,miRNA通过转录后机制调节基因的表达在应对缺氧反应中起关键作用,此外缺氧在对miRNA的生成、活性等方面也有重要的调节作用[4-5]。多项研究表明在缺氧条件下或与缺氧相关的疾病中miR-130a-3p在细胞或组织内的表达水平发生变化[6-7]。但是高原低氧环境能否影响循环miR-130a-3p表达的报道较为少见。本研究采用实时荧光定量 PCR(qRT-PCR)法,对移居到我国高原地区的健康汉族人和长期居住在平原地区的健康汉族人群血浆中miR-130a-3p水平进行比较分析。
1 资料与方法
1.1一般资料 收集包括从江苏省、安徽省、上海市移居到海拔3 560 m的高原地区1~2年(平均17个月)的健康汉族人(高原汉组)的血浆,高原汉组中男性55例,女性25例,平均年龄为(36.13±11.70)岁;同时期收集与移居到高原地区个体年龄、性别相匹配的150例长期居住在海拔高度8.9 m的平原地区健康汉族个体(平原汉组)的血浆作为对照。平原汉组中男性88例,女性62例,平均年龄为(34.87±9.40)岁,所有入选对象均经病史询问,排除血液系统疾病、全身免疫性疾病、急慢性感染性疾病、高血压、心脏病、肿瘤等干扰性疾病。
1.2仪器与试剂 2720型PCR仪(美国Applied Biosystem公司),7300型实时荧光定量PCR仪(美国Applied Biosystem公司),5418型高速冷冻离心机(德国Eppendorf 公司),XE-2100全自动血液分析仪(日本Sysmex 公司);Trizol试剂(美国Invitrogen公司),异丙醇、氯仿、无水乙醇(国药集团试剂公司),人工合成peu-MIR2911、miR-130a-3p的引物和探针(美国Applied Biosystem公司);逆转录反应体系及qRT-PCR反应体系所用试剂(日本TaKaRa公司) 。
1.3方法
1.3.1标本采集 所有受试者均空腹8~10 h,清晨采集2 mL静脉血于乙二胺四乙酸二钾抗凝真空采血管中,15 min内上机进行血常规检测。剩余血液迅速用室温离心机1 500×g离心10 min。收集分离出的血浆于Eppendorf(EP)管中,置于-80 ℃保存。
1.3.2血浆RNA提取 采用苯酚氯仿抽提法进行,将上述收集的血浆样本室温融化混匀后,各取100 μL血浆样本于新的除酶的EP管中,再加300 μL DEPC水稀释混匀血浆标本;每管中各加入200 μL水饱和酚,充分涡旋混匀,然后每管加入20 μL人工合成的外源性植物miRNA MIR2911(MIR2911序列:5′-GGC CGG GGG ACG GGC UGG GA-3′) 以控制样本提取纯化过程中的差异,涡旋混匀,室温静置5 min;每管中各加入200 μL氯仿,充分涡旋混匀,室温静置5 min;室温,16 000×g,离心20 min;取离心后的上清液于新的除酶EP管中;每管加入1/10倍上清液体积的乙酸钠(浓度=3 mol/L,pH=5.3)和2倍上清液体积的异丙醇。涡旋颠倒混匀数次,置于-20 ℃沉淀60 min;沉淀结束后,4 ℃,16 000×g,离心20 min;离心后去除上清液,保留沉淀,每管加1 mL 75% DEPC水乙醇洗涤沉淀;4 ℃,16 000×g,离心20 min。离心后弃去上清液,保留沉淀,将EP管倒置,室温干燥沉淀;沉淀晾干后,每管加入20 μL DEPC水溶解沉淀,将溶解好的RNA置于-80 ℃冰箱备用。
1.3.3qRT-PCR检测 采用基于TaqMan 探针的qRT-PCR方法检测所有受试者血浆标本中miR-130a-3p表达水平。逆转录反应体系(10 μL体系):DEPC水3.5 μL,5×反转录缓冲液2.0 μL,10 mmol/L dNTP 1.0 μL,AMV反转录酶0.5 μL,miR-130a-3p反转录引物1.0 μL,RNA 标本2.0 μL。反应条件:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min,4 ℃保存,1个循环;qRT-PCR 总反应体系(20 μL体系),ddH2O 14.77 μL、10×PCR buffer 2 μL、10 mmol/L dNTP 0.4 μL、25 mmol/L MgCl21.2 μL、Taq 酶0.3 μL,探针及上、下游引物 0.33 μL,cDNA 1 μL。以DEPC水作为阴性对照,每个样本均设3个复孔,阴性对照的cDNA与待测样本的cDNA同时进行扩增,95 ℃ 5 min;95 ℃ 15 s,60 ℃ 1 min,共40个循环。血浆中miRNA表达水平采用相对定量的方法进行计算。用样本中待测miRNA的Cq值减去相应样本中参考基因Cq值得到ΔCq值,即ΔCq=Cq(miR-130a-3p)-Cq(MIR2911)。待测miRNA相对于参考基因的表达水平用2-ΔCq表示。
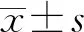
2 结 果
2.1两组临床基本信息 两组人群的年龄、性别比较差异无统计学意义(P>0.05)。与平原汉组比较,高原汉组血液中红细胞计数(RBC)、血红蛋白(Hb)、血细胞比容(Hct)、平均血红蛋白含量(MCH)均显著升高,而血小板计数(PLT)则显著降低,差异有统计学意义(P<0.05);两组血液中平均血红蛋白浓度(MCHC)比较,差异无统计学意义(P>0.05)。见表1。
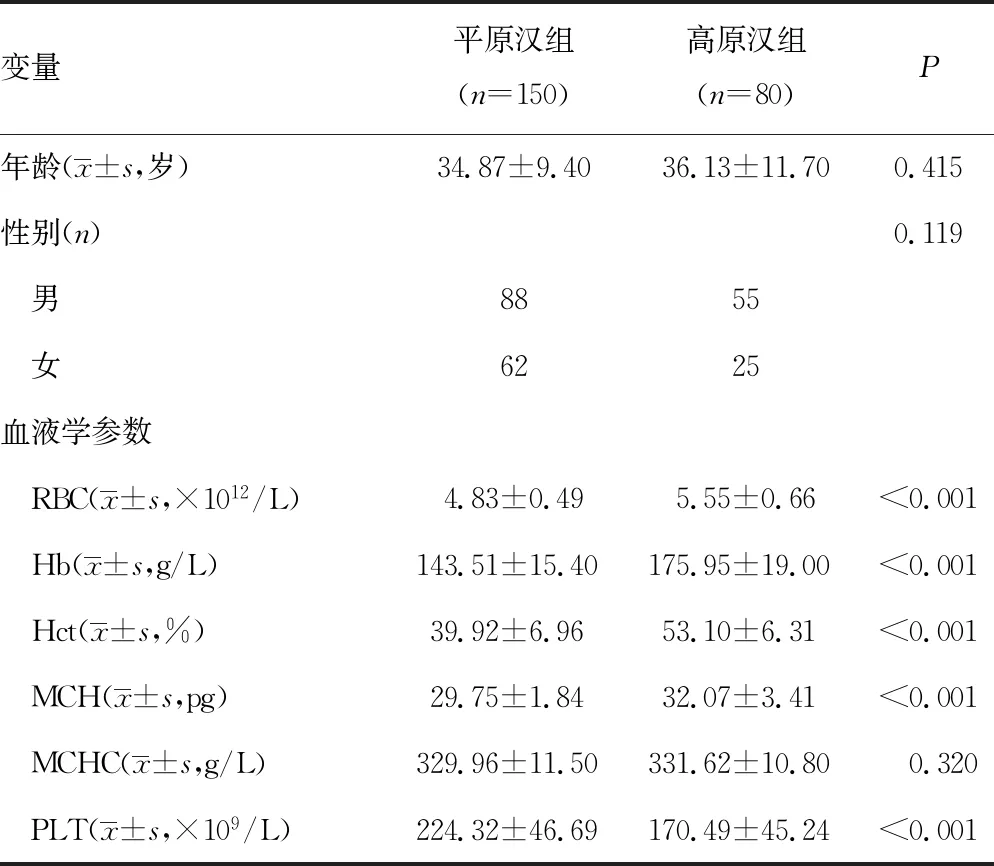
表1 两组临床基本信息
2.2两组血浆外源性MIR2911表达水平比较 采用qRT-PCR技术分别检测150例平原汉组及80例高原汉组血浆中的MIR2911表达水平,用Cq值表示。两组血浆中外源性MIR2911表达水平比较,差异无统计学意义(P=0.087 1),见图1。
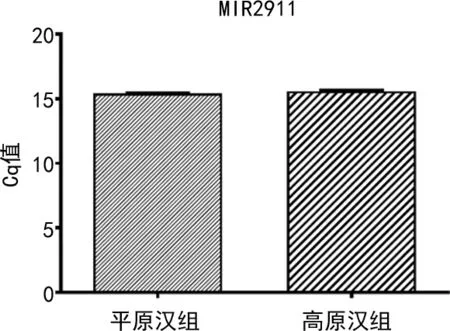
图1 两组血浆外源性MIR2911表达水平比较
2.3血浆miR-130a-3p的qRT-PCR检测结果 高原汉组血浆miR-130a-3p表达水平为[323.12(209.46,618.54)]×10-5高于平原汉组血浆miR-130a-3p表达水平[210.51(158.18,274.98)]×10-5,差异有统计学意义(Z=-5.318,P<0.05)。
2.4miR-130a-3p与血液学指标的相关性 为了验证miR-130a-3p与机体适应高原低氧环境相关,进一步利用Spearman秩相关分析了miR-130a-3p与RBC、Hb、Hct、PLT之间的相关性。miR-130a-3p与RBC(r=0.58、P<0.001)、Hb(r=0.59、P<0.001)、Hct(r=0.69、P<0.001)均呈正相关,而与PLT(r=-0.21,P=0.001 4)呈负相关。
2.5miR-130a-3p的靶基因预测 为了探讨miR-130a-3p在应对高原低氧环境中的作用及潜在的分子学机制,利用TargetScan,miRanda和PicTar靶基因预测软件预测了其潜在的靶基因,发现miR-130a-3p存在一些与缺氧相关(DDX6、EGLN3、FOSL1、EDN1、CHRN2、PRKA1、I7PR1、PXDN、TGFB1、TGFB2、UCP3等)、红细胞生成相关(SMAD5、SP1等)、巨核细胞系统增殖与分化(MAFB、HOXD1、CXDCL2、CBFA、MYB、PDGFRA、MAFG、HOXA3)等相关的靶基因。
3 讨 论
miRNA可作为多种疾病的潜在生物标志物,但是环境等非病理因素对miRNA表达的影响研究很少。为了将miRNA更好地应用到疾病的诊断、预测中去,必须了解非病理因素对miRNA表达的影响。缺氧发生在许多病理生理过程中,例如组织的快速生长、急慢性缺血及处于高海拔地区等。当平原地区的居民移居到高原环境中时将面对缺氧的威胁,而身体在高原发生缺氧的生理变化很复杂,涉及一系列的生理机制[8-9]。有研究发现,在缺氧情况下机体、细胞中的一些miRNA的表达水平会发生变化,除此之外在与缺氧相关的疾病中一些miRNA的表达水平也会发生变化[5-7]。然而这些研究主要集中在组织或细胞层面的miRNA的表达水平上。考虑到miRNA是应对缺氧的关键因素,推测高原低氧环境可能对循环miRNA的表达也存在影响。
红细胞的生理功能是将氧气从肺部毛细血管运输到组织毛细血管进行气体交换,红细胞生成过程受到包括氧含量在内的多种因素的影响。当平原地区居民移居到高海拔地区时不能很好地适应高原低氧的环境,为了获得充分的气体交换,机体内RBC、Hb、Hct等会升高[10]。本研究发现,与一直居住在平原地区的人群相比,从平原地区移居到高原地区的人群的RBC、Hb、Hct都显著升高,与其他研究报道结果一致[9-10]。进一步分析了miR-130a-3p与这些血液学指标的关系,发现miR-130a-3p与RBC、Hb、Hct呈正相关。这些结果提示 miR-130a-3p可能通过调节红细胞的生成、分化等参与机体对低氧环境的适应过程。
另外,通过分析生物信息学技术预测了miR-130a-3p的靶基因,发现miR-130a-3p的部分靶基因与氧代谢及氧敏感度有关。如预测到miR-130a-3p的靶基因DDX6,miR-130a-3p能够通过靶向调节DDX6进而增强缺氧诱导因子1α(HIF-1α)的作用来调节细胞对缺氧的反应[11]。此外,miR-130a-3p还存在一些与红细胞生成、巨核细胞分化相关的靶基因。例如,SMAD5[12]和SP1[13]是与红细胞生成有关的靶基因,MAFB[14]和MYB[15]是在巨核细胞分化过程中起重要作用的转录因子。以上结果进一步说明miR-130a-3p可能通过参与红细胞的生成和巨核细胞的分化来调节机体对高原低氧环境的适应过程。但是,在本研究中并未涉及miR-130a-3p在机体应对低氧环境中的具体分子机制,在之后的试验中有待更深入的研究。
综上所述,高原低氧环境能够影响血浆miR-130a-3p表达水平,miR-130a-3p可作为应对缺氧环境的一个循环因子。本研究进一步分析了miR-130a-3p与血细胞指标的相关性并预测了miR-130a-3p的一些潜在的靶基因。以上研究结果为研究人类适应高原环境的分子机制提供了新视角,miR-130a-3p可能参与这一适应过程。

