1株解淀粉芽孢杆菌的分离、鉴定及在马铃薯疮痂病防治上的应用
糜芳 吴紫燕 王承芳 张莹莹 干华磊 毛伟力


摘要:运用形态学、生理生化特征及16S rDNA序列构建系统发育树等方法,就从上海市浦东新区黄瓜地土壤中分离获得的1株对马铃薯疮痂病原(Streptomyces scabiei)及多种植物病原菌生长有抑制作用的芽孢杆菌(菌株Ba0002)进行鉴定。结果表明,Ba0002菌株为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。通过液体发酵和剂型处理,将Ba0002菌株制成悬浮剂 (Ba0002-SC),用于对马铃薯疮痂病的大棚盆栽和大田防治试验,结果表明,对马铃薯疮痂病的防治效果与所施用的Ba0002-SC浓度正相关。当Ba0002-SC的施用浓度为100倍液时,在大棚和大田的防治效果分别达到59.72% 、66.44%,显著高于化学农药多菌灵(稀释500倍)和空白对照处理。大田试验的测产结果表明,经Ba0002-SC 处理的植株,马铃薯产量为2 923.38 kg/667 m2,显著高于经多菌灵处理的产量(2 776.42 kg/667 m2)。
关键词:解淀粉芽孢杆菌;分离鉴定;生物防治;马铃薯疮痂病
中图分类号:S435.32 文献标志码: A
文章编号:1002-1302(2021)18-0122-06
收稿日期:2020-12-30
基金项目:上海市科委科技支撑项目(编号:16391902400);大理州毛伟力专家工作站(编号:大科联发[2019]6号 )。
作者简介:糜 芳(1991—),女,四川达州人,助理农艺师,主要從事农业微生物开发与利用研究。E-mail:mif@sh-wlh.com。
通信作者:毛伟力,博士,主要从事植物病理学研究。E-mail:maowl@sh-wlh.com。
马铃薯(Solanum tuberosum)属茄科,一年生草本植物,块茎可食用,是全球第4重要的粮食作物[1]。早在2016年,我国就启动了将马铃薯作为主粮的战略[2],并在随后的几年里,马铃薯种植面积和产量呈逐步上升的趋势。在大规模种植马铃薯的同时,也面临着许多病虫害的困扰。晚疫病、环腐病、疮痂病等都是影响马铃薯产量的主要病害[3-4]。其中,由链霉菌属(Streptomyces spp.)引起的马铃薯疮痂病是一种土传和种传病害[5],主要危害马铃薯的块茎。侵染初期会在块茎表面出现褐色小点,逐渐形成各种凸起、凹陷以及扁平状的近圆形或不定型病斑。疮痂病可给马铃薯生产造成每年数以亿计的经济损失[6]。目前防治该病害的主要方法是轮作以及使用广谱的土壤杀菌剂或硫酸铜、克菌丹、冠菌铜、代森锰锌等化学药剂[7]。但长期使用化学农药易使病原菌产生耐药性,并且给生态环境带来严重的污染[8]。因此筛选并开发出对马铃薯疮痂病有较好防治效果的生物制剂,是当前生物农药研究的重要课题之一。
为保护环境,提高人类健康水平,生物农药在植物病虫害防治方面已展现出能减少或取代部分化学农药的重要作用[9]。在生防细菌中,应用最普遍的有链霉菌 (Streptomyces spp.) 、假单胞杆菌(Pseudomonas spp.) 以及芽孢杆菌(Bacillus spp.)[10]等。芽孢杆菌具有抗逆性强,能产生大量抗菌活性物质,产量高、货架期长等良好特性,其产品已被广泛应用于植物病害的生物防治[11-12]。解淀粉芽孢杆菌 (Bacillus amyloliquefaciens) 能够产生多种抑制植物病原菌的酶类活性物质,包括蛋白酶、纤维素酶等,并且通过产生吲哚乙酸(IAA)、铁载体、碱性磷酸酶等活性物质来促进植物生长[13],能有效防治辣椒、西瓜、花生、黄瓜等作物的根腐病、枯萎病、白绢病等[14-16]。高同国等筛选了1株对马铃薯疮痂病病原菌具有较强拮抗作用的解淀粉芽孢杆菌12-82,其抑菌圈直径达26.2 mm[17]。说明解淀粉芽孢杆菌在马铃薯疮痂病的防治方面具有潜在的应用前景。
本研究通过梯度稀释法从黄瓜地土壤样品中,分离出一株具有广谱拮抗活性的菌株Ba0002。结合生理生化反应和系统发育分析,确定了Ba0002为解淀粉芽孢杆菌,再通过盆栽和大田试验,测试其对马铃薯疮痂病的防治效果,旨在为该菌株防治马铃薯疮痂病提供可参考的依据。
1 材料与方法
1.1 材料
1.1.1 试验菌株 试验菌株主要有立枯丝核菌(Rhizoctonia solani)、烟草疫霉菌(Phytophthora nicotianae)、链格孢(Alternaria alternata)、尖孢镰刀菌(Fusarium oxysporum)、葡萄座腔菌(Botryosphaeria dothidea)、灰葡萄孢(Botrytis cinerea)、稻瘟病原菌(Pyricutaria oryzae)、桑细菌性疫病菌(Pseudomonas syringae pv. mori)、马铃薯疮痂病(Streptomyces scabiei)、解淀粉芽孢杆菌Ba0002等菌株,均由上海万力华生物科技有限公司分离与保藏。
1.1.2 培养基 试验培养基主要有马铃薯葡萄糖琼脂(PDA)培养基:200 g马铃薯切成小块,加水煮烂,用纱布过滤掉土豆渣,滤液中加入20 g葡萄糖和20 g琼脂,溶解后补足水至1 000 mL。于1×105 Pa 灭菌20 min。冷却后倒平板[18]。营养琼脂(NA)培养基:10 g蛋白胨、3 g牛肉粉、5 g NaCl、20 g 琼脂,pH值为7.0~7.2。Ba0002发酵培养基:28 g玉米淀粉、2.5 g酵母粉、0.5 g MgSO4、2 g K2HPO4、1 L去离子水。高氏一号培养基:20 g可溶性淀粉、1 g KNO3、0.5 g K2HPO4、0.5 g MgSO4· 7H2O、0.5 g NaCl、0.01 g FeSO4· 7H2O、20 g琼脂、1 000 mL去离子水,pH值为7.4~7.6。
1.1.3 所用仪器 试验仪器主要有高压蒸汽灭菌锅(上海申安医疗器械厂,LDZX-50KBS)、恒温培养箱(上海一恒科技仪器有限公司,MCG450BP)、超净工作台(苏净集团苏州安泰空气技术有限公司,SW-CJ-1CU)、恒温水浴锅(上海一恒科技仪器有限公司,HWS26)、恒温摇床(SUKUN SKY-2112B)、PCR仪(杭州柏桓科技有限公司,GT9612)、凝胶成像系统(Gnosens 1550)、分析天平(上海舜宇恒平科学仪器有限公司,JA2003)、高速离心机(湖南湘仪实验室仪器开发有限公司,H1650)、涡旋振荡器(VISION,KMC-1300V)、生物显微镜(奥林巴斯,CX21型)等。
1.1.4 所用试剂 试验主要试剂有PCR mix、细菌基因组DNA抽提试剂盒均购自生工生物工程(上海)股份有限公司;Ba0002悬浮剂(Ba0002-SC),由上海万力华生物科技有限公司研制,有效活菌数为2×109个/mL;多菌灵为辽宁营口雷克农药有限公司生产的可湿性粉剂;其他化学试剂为国产分析纯,购自上海润捷化学试剂有限公司。
1.1.5 马铃薯品种 马铃薯品种为室内盆栽试验:中薯3号。大田试验:麦肯7号。
1.2 试验方法
1.2.1 Ba0002菌株的分离与纯化 土样采集:从上海市浦东新区孙桥黄瓜地的土壤耕作层15 cm处取样200~500 g,采集59份土壤样本。将土壤在空气中干燥7 d后进行菌株分离[18]:先将土壤样本放在灭菌的研钵中,用研磨棒研磨至土壤颗粒均一,放置在80 ℃烘箱烘30 min后,称取1 g土样放入含9 mL无菌水的试管中,在涡旋振荡器上充分振荡,并取1 mL加入到另一个含9 mL无菌水的试管中,在涡旋振荡器上混匀后形成10-2的土壤稀释液,以此类推至10-3、10-4、10-5。吸取10-2、10-3、10-4、10-5土壤稀释液100 μL,分别加入到NA培养基上,用涂布棒将稀释液均匀涂布。将平板放置在37 ℃恒温培养箱中恒温培养24 h至培养皿中长出单菌落。采用划线分离法进行纯化并转入37 ℃恒温中培养,再将纯化培养后的单菌落转接至NA培养基的试管斜面上,37 ℃培养24 h。
1.2.2 Ba0002菌株对植物病原的拮抗效果 对多个真菌病原的拮抗测试采用平板对峙法[19],测定解淀粉芽孢杆菌对这些病原菌的拮抗效果。在直径90 mm的培养皿中加入20 mL PDA培养基。用活化了5 d的病原菌平板,取直径为5 mm的菌块置于PDA平皿中央,在距离病原菌块20 mm处滴加5 μL Ba0002菌液。以只接病原菌块的处理为对照(CK),每组3个重复。将平板放置在28 ℃的培养箱中培养7 d,测量病原菌的菌落直径并计算抑菌率。抑菌率=(CK连心线上菌落直径-处理连心线上菌落直径)/(CK连心线上菌落直径-菌块直径)×100%。
对细菌病原的拮抗采用平板抑菌法[20],测定解淀粉芽孢杆菌对细菌病原的拮抗效果。将细菌病原菌液与45 ℃左右的NA培养基混合均匀,加入 20 mL 至90 mm培养皿中,待培养基凝固后,在距离平板中央20 mm处做对称标记,并在标记处滴入5 μL Ba0002菌液,置于30 ℃培养箱中培养7 d。测量抑菌圈的直径。抑菌效果=抑菌圈直径/菌落直径,比值大于1.5时说明抑菌效果较好。
1.2.3 Ba0002菌株的鉴定 通过形态学、生理生化特征[21]及分子生物学鉴定方法对筛选的Ba0002菌株进行种属鉴定。
菌落形态观察:将菌种Ba0002接种在NA培养基上,于37 ℃恒温培养箱中培养48 h,观察菌落特征。
生理生化特征鉴定:菌株Ba0002的氧化酶、接触酶等生理生化项目测定参照《常见细菌系统鉴定手册》[21] 《伯杰细菌鉴定手册》的方法。
分子生物学鉴定[22]:利用生工生物工程(上海)股份有限公司的细菌基因组DNA抽提试剂盒提取Ba0002菌株的基因组DNA。以基因组DNA为模板,利用16S rDNA通用引物(27F、1492R)及gyrB基因引物(g-F、g-R)扩增Ba0002的基因组。引物序列为:27F(5′-AGAGTTTGATCMTGGCTCAG-3′)、1492R(5′-GGTTACCTTGTTACGACTT-3′)、g-F(5′-ATCATGACCGTTCTCCACGC-3′)、g-R(5′-CGTTATGCCGTCTTTCTCGC-3′),PCR反应体系为:PCR mix 10 μL,上游引物:27F 1 μL,下游引物:1492R 1μL,1 μL DNA模板,双蒸水12 μL。PCR扩增条件为:95 ℃ 5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,33个循环;72 ℃ 10 min 。PCR产物送至生工生物工程(上海)股份有限公司进行测序。测序结果于NCBI数据库(https://www.ncbi.nlm.nih.gov/)进行BLAST比对分析,用 MEGA 6.0软件的 Neighbor-Joining 法构建系统发育树。
1.2.4 大棚盆栽试验 于2018年12月至2019年5月,在上海市浦东新区孙桥镇卉绿农场开展大棚盆栽试验。将马铃薯切块,将每块留有1~2个芽眼薯块栽种到盛有500 g基质的花盆(25 cm×30 cm)中,置于25~28 ℃ 的大棚中生长15 d后,挑取长势一致的幼苗用于下一步试验。采用灌根法[17]将疮痂病原2×108个/mL浇灌接种至马铃薯苗的根围,每株250 mL,以清水浇灌250 mL作为空白对照。间隔10 d后,将稀释至100倍、200倍、400倍的Ba0002-SC(2×109 CFU/mL)以及多菌灵(500倍稀释液,化药对照),采用同样的灌根法,每株浇灌250 mL,每个处理重复6次。120 d后马铃薯收获时,调查块莖的发病情况,按下列分级标准记录,并计算发病率、病情指数和防效。0级:薯皮健康,无病斑;1级:薯皮基本健康,有零星病斑;3级:病斑所占面积为薯皮表面积1/3以下;5级:病斑所占面积为薯皮表面积的1/3~1/2;7级:病斑面积超过薯皮表面积的1/2;9级:薯皮全部被病斑覆盖。发病率=发病马铃薯块茎数/收获总马铃薯块茎数×100%。病情指数=∑(各病级块茎数×该病级代表值)/(调查个体总和×最高病级数)×100。相对防效=(对照组病情指数-处理组病情指数)×100%/对照组病情指数。
1.2.5 大田试验 2020年在内蒙古自治区呼伦贝尔市海拉尔区海拉尔农业发展园区,开展大田试验。试验用药剂为多菌灵、Ba0002-SC(2×109 CFU/mL),清水为空白对照。采用完全随机区组设计,每个试验小区面积为266 m2,行距为 90 cm,株距为20 cm,各试验小区重复3次,各小区随机排列。4月20日播种,将马铃薯切块,每块留有1~2个芽眼,用播种机进行播种。多菌灵和Ba0002-SC分别按照500倍稀释和100倍稀释浓度进行稀释,在播种时对播种的厢沟土壤进行浇灌,开花期采用同样的稀释浓度,对马铃薯植株根围再进行一次浇灌。8月28日采收、测产并调查块茎的发病情况,按“1.2.4”节中的分级标准记录,计算发病率、病情指数和防效。测产按照各个试验小区每个重复取3个采样点,每个取样点挖出1垄土豆,长度为2 m,称取所有土豆的质量。薯块平均亩产=商品薯平均亩产+非商品薯亩产。商品薯平均亩产=∑(单点商品薯质量)/∑(单点面积)×667×(1-杂质率)。非商品薯平均亩产=∑(单点非商品薯质量)/∑(单点面积)×667×(1-杂质率)。其中1 hm2=15亩。非商品薯指质量小于 50 g 的小薯以及病薯、烂薯和绿皮薯等薯块。杂质率:一般情况下,扣除收获薯块总质量的1.5%作为杂质、含土量。
1.3 数据分析
试验数据采用 Microsoft Office Excel 2019整理,采用SPSS 22分析试验数据,用Duncans新复极差法进行数据差异显著性分析。
2 结果与分析
2.1 菌株分离结果
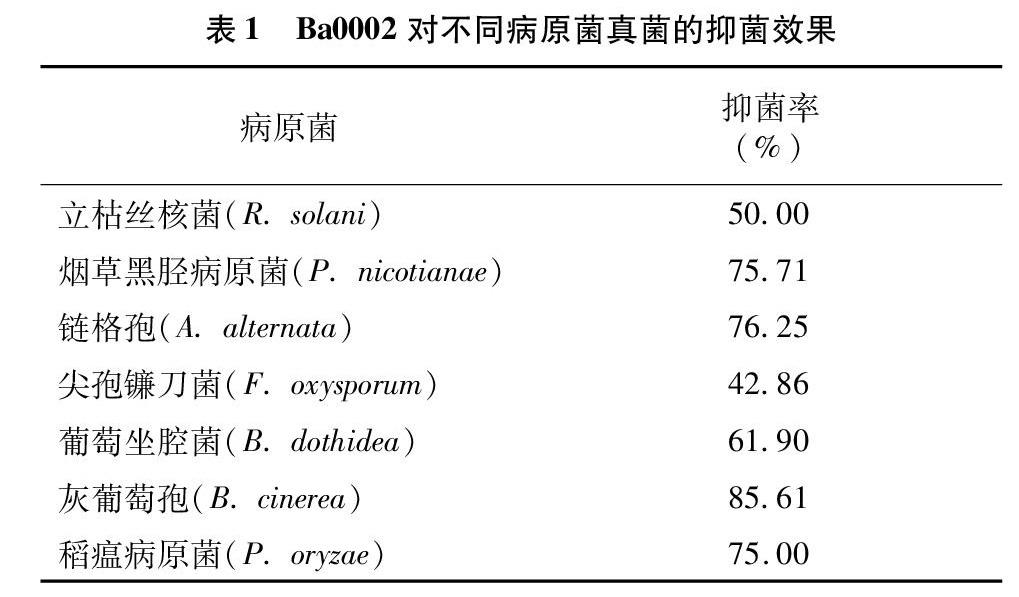
按“1.2.1”节中所述的方法,从59份土样中共分离得到81株细菌。再按“1.2.2”节的方法,将分离得到的菌株分别与马铃薯疮痂病原原菌进行平板对峙拮抗测试,81株细菌中有13株有抑菌活性,其中有1株细菌的抑菌效果显著(表1),将其编号为Ba0002。
2.2 Ba0002菌株对植物病原的拮抗效果
2.2.1 Ba0002菌株对真菌病原的抑菌谱 为确定Ba0002菌株的抑菌活性,采用平皿对峙法测定Ba0002菌株对以下病原真菌(R. solani、P. nicotianae、 A. alternata、F. oxysporum、B. dothidea、B. cinerea、P. oryzae)的拮抗效果。结果(表1)表明,除了对F. oxysporum的抑菌率为42.86%,对其他病原菌的抑菌率均大于等于50%,其中对B. cinerea A. alternata、P. nicotianae、P. oryzae等病原菌的抑菌率≥75%。说明Ba0002菌株对大多数病原真菌有抑菌作用。
2.2.2 Ba0002菌株对细菌病原的抑菌效果 在活体抑菌试验中,Ba0002菌株对马铃薯疮痂病病原(S. scabiei)的抑菌直径达到22 mm(图1)。
2.3 菌株Ba0002的鉴定
2.3.1 Ba0002菌株的形态特征 由图1可知,Ba0002菌株菌落呈圆形,乳白色,边缘不整齐,扁平,中间有褶皱,不透明;在光学显微镜下观察,菌体呈杆状,两端钝圆,宽度为0.6~0.8 μm,长度为2.0~4.5 μm;革兰氏染色为阳性菌。
2.3.2 Ba0002菌株生理生化特征 Ba0002菌株能够利用葡萄糖、甘露醇、山梨醇、水苏糖、蔗糖、龙胆二糖作为唯一碳营养,能够产生β-半乳糖苷酶、鸟氨酸脱羧酶、精氨酸双水解酶、氧化酶、接触酶。明胶水解阳性反应,VP反应呈阳性,在pH值为5.0和8%NaCl的NA培养基上都能生长(表2)。
2.3.3 Ba0002菌株16S rDNA序列的分子系统学分析 通过Ba0002菌株的16s rDNA 序列在NCBI BLAST比对,可以看出Ba0002菌株与解淀粉芽孢杆菌(GeneBank登录号MN585518.1)的相似性高达99.93%。Ba0002菌株的gyrB基因序列系统发育(图2)分析显示,Ba0002菌株与B. amyloliquefaciens处于同一个进化分支,同源性高达100%,说明Ba0002菌株与B. amyloliquefaciens亲缘关系较近。综合系统发育树(图2)及生理生化反应(表2)分析,鉴定Ba0002菌株为解淀粉芽孢杆菌(B. amyloliquefaciens)。
2.4 大棚盆栽试验结果
使用Ba0002-SC防治马铃薯疮痂病的大棚盆栽试验结果见表3、图3。由表3可知,随着Ba0002-SC稀释浓度的增加,Ba0002-SC对马铃薯疮痂病的防治效果也逐渐降低。经Ba0002-SC 100倍稀释处理的植株,对马铃薯疮痂病的防治效果显著高于(P<0.05)经200倍、400倍稀释液以及多菌灵(500倍)的处理;而经多菌灵500倍液以及Ba0002-SC 200倍液、400倍液处理的植株之间,防治效果无显著性差异,但均显著高于(P<0.05)病原菌处理。
2.5 大田试验结果
由表4可知,经Ba0002-SC 100倍稀释液处理的植株,对马铃薯疮痂病的防效(62.44%)显著高于经多菌灵稀释500倍(12.59%)以及空白对照处理。由表5可知, 经Ba0002-SC稀释100倍植株所收获块茎的平均质量(5 846 g)显著高于经多菌灵稀释500倍和空白处理植株所收获的块茎平均质量(5 552、5 512 g)。
3 结论与讨论
芽孢杆菌作为一种重要的生防菌,已广泛应用于对马铃薯疮痂病和其他植物病害的生物防治中。Li等利用高地芽孢杆菌(B. altitudinis)菌株AMCC 101304在大田测试防治马铃薯疮痂病,春、秋2季防效分别达到76.34% 、65.81%[23]。Cui等从马铃薯中分离出了内生贝莱斯芽孢杆菌(B.velezensis)菌株8-4,对马铃薯疮痂病防治效果达到了 (51.83±8.53)%,同时该处理马铃薯的产量比其他处理高出(19.91±3.56)%[24]。Lin等在盆栽试验中发现,使用解淀粉芽孢杆菌Ba01可使马铃薯疮痂病的发病率降低(51.4±11.1)%[25]。 本研究使用解淀粉芽孢杆菌 Ba0002-SC 對马铃薯疮痂病的防治效果达到了62.44%,其总产量较空白处理增加了6.06%。与Lin等报道的解淀粉芽孢杆菌具有防病、增产的效果[25]相符。
在农业生产中运用解淀粉芽孢杆菌,不但具有防病的作用,同时还有促进作物生长的功效。解淀粉芽孢杆菌在根际土壤中能分泌大量次级代谢产物。Yan等从解淀粉芽孢杆菌的发酵液中分离得到对植物病原有灭杀作用的脂肽类抗生素iturin A,iturin A可以使病原真菌的膜通透性增加,从而抑制病原菌的生长和孢子萌发[26]。Arrebola等通过色谱分析发现,解淀粉芽孢杆菌的抑菌物质成分主要为伊枯草菌素A[27]。本研究的拮抗测试结果表明,Ba0002菌株不仅对马铃薯疮痂病有较好的防治效果,同时对R. solani、P. nicotianae、A. alternata、B. dothidea、B. cinerea、P. oryzae等多种病原菌有较强的拮抗作用,说明Ba0002菌株在生长过程中能产生类似的抑菌活性物质。在后续的研究中,将进一步探讨Ba0002菌株对马铃薯疮痂病的防治机制和Ba0002菌株在生长过程中所产生的有拮抗作用的抑菌活性物质,并拓宽其在其他植物病害上的防治功效。
参考文献:
[1]黑龙江省农业委员会.马铃薯[M]. 北京:中国农业出版社,2006:55-60.
[2]张千友. 中国马铃薯主粮化战略研究[M]. 北京:中国农业出版社,2016:51-53.
[3]杨艳丽,刘 霞. 马铃薯病害[M]. 北京:科学出版社,2019.
[4]拱国庆,任希平,赵周洲,等. 马铃薯主要病害症状及防治方法[J]. 农村科学实验,2016(11):18-19.
[5]刘希栋. 马铃薯块茎病害的诊断和防治[J]. 农民致富之友,2013(13):37.
[6]杨姗琳. 马铃薯疮痂病的分離和检测体系构建[D]. 武汉:华中农业大学,2018.
[7]牛旭东,刘小娟,莫 娟,等. 几种新型杀菌剂对马铃薯疮痂病的田间防效[J]. 农业科技与信息,2020(14):26-28.
[8]王 涛. 农药的危害及绿色植保技术[J]. 农业与技术,2019,39(14):30-31.
[9]徐丽华. 微生物资源学[M]. 2版.北京:科学出版社,2010:387-414.
[10]李俊州,文才艺. 植物病害生防细菌研究进展[J]. 河南农业科学,2015,44(10):1-7.
[11]Fira D,Dimkic' I,Beric' T,et al. Biological control of plant pathogens by Bacillus species[J]. Journal of Biotechnology,2018,285(10):44-55.
[12]叶旻硕,俞键烽,马 艳,等. 不同微生物菌剂对辣椒疫病的防控效果及对土壤性状的影响[J]. 江苏农业学报,2019,35(4):811-817.
[13]张晓冰,杨星勇,杨永柱,等. 芽孢杆菌促进植物生长机制研究进展[J]. 江苏农业科学,2020,48(3):73-80.
[14]王夏雯,孟佳丽,刘永锋,等. 解淀粉芽孢杆菌B1619对连作西瓜生长及枯萎病发生的影响[J]. 福建农业学报,2019,34(11):1302-1308.
[15]陆 燕,李 澄,陈志德,等. 解淀粉芽孢杆菌41B-1对花生白绢病的生防效果[J]. 中国油料作物学报,2016,38(4):487-494.
[16]柴庆凯,张 斌,常若葵,等. 解淀粉芽孢杆菌LJ02对黄瓜抗灰霉病菌的生防效果及其诱导抗性机理的初步研究[J]. 植物病理学报,2019,49(6):828-835.
[17]高同国,姜军坡,郭晓军,等. 马铃薯疮痂病高效拮抗菌的筛选及鉴定[J]. 江苏农业科学,2016,44(12):157-159.
[18]方中达. 植病研究法[M]. 3版.北京:中国农业出版社,2007:62-65.
[19]吴紫燕,沈少力,糜 芳,等. 作物根围土壤木霉菌物种多样性及其体外拮抗病原菌效应[J]. 菌物研究,2017,15(3):177-182,187.
[20]王 超,李宏伟,王 翠,等. 防治大白菜软腐病细菌菌株的筛选与鉴定[J]. 江苏农业科学,2013,41(12):114-117.
[21]东秀珠,蔡妙英.常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:370-410.
[22]傅 奇,林俊杰,冯亚栋,等. 16S与gyrB基因联合建树快速鉴定一株解淀粉芽孢杆菌[J]. 食品与发酵工业,2020,46(12):116-120.
[23]Li B Y,Wang B,Pan P,et al. Bacillus altitudinis strain AMCC 101304:a novel potential biocontrol agent for potato common scab [J]. 2019,29(10):1009-1022.
[24]Cui L X,Yang C D,Wei L J,et al. Isolation and identification of an endophytic bacteria Bacillus velezensis 8-4 exhibiting biocontrol activity against potato scab [J]. 2020,141
[25]Lin C,Tsai C H,Chen P Y,et al. Biological control of potato common scab by Bacillus amyloliquefaciens Ba01[J]. PLoS One,2018,13(4):e0196520.
[26]Yan F,Li C H,Ye X L,et al. Antifungal activity of lipopeptides from Bacillus amyloliquefaciens MG3 against Colletotrichum gloeosporioides in loquat fruits [J]. Biological Control,2020,146:104281.
[27]Arrebola E,Jacobs R,Korsten L. Iturin A is the principal inhibitor in the biocontrol activity of Bacillus amyloliquefaciens PPCB004 against postharvest fungal pathogens[J]. Journal of Applied Microbiology,2010,108(2):386-395.

