参附注射液联合小剂量氢化可的松治疗脓毒性休克的效果探讨
杨 丽,谢步东,姜 丽
(绵阳市中心医院,四川 绵阳 621000)
脓毒症是一种由感染引起的全身炎症反应综合征。此病具有较高的发病率和致死率。脓毒性休克是指由脓毒症引起的休克。脓毒性休克具有发病急、进展快及致死率高等特点[1]。此病患者多表现为器官和组织灌注量不足及循环系统功能衰竭。有研究指出,虽然近年来抗感染治疗和器官功能支持技术取得了长足进步,但脓毒性休克患者的病死率仍高达30%~70%[2]。因此,寻找一种能提高脓毒性休克患者生存率的治疗方案至关重要。氢化可的松是一种具有抗休克、抗毒、抗过敏、抗炎及免疫抑制等作用的肾上腺皮质激素类药物。参附注射液是一种由红参、黑附片制成的中药注射剂,具有回阳救逆、益气固脱等功效,主治阳气暴脱的厥脱证。有报道称,用参附注射液治疗重症感染可起到减轻炎症反应、保护器官功能、提高机体免疫力等作用[3]。本文主要是探讨用参附注射液联合小剂量的氢化可的松治疗脓毒性休克的效果。
1 资料与方法
1.1 一般资料
经我院医学伦理委员会的批准,选择我院2018年5月至2020年12月期间收治的96例脓毒性休克患者作为研究对象。其纳入标准是:病情符合《中国严重脓毒症/脓毒性休克治疗指南(2014)》[4]中关于脓毒性休克的诊断标准;肝肾功能正常;临床资料完整;其家属知悉本研究内容,并签署了自愿参与本研究的知情同意书。其排除标准是:对本研究中所用的药物过敏;近期使用过免疫抑制剂、免疫调节剂等可能会对本研究结果造成影响的药物;存在凝血功能异常;合并有血液系统疾病或自身免疫性疾病;处于妊娠期或哺乳期。其脱落与剔除标准是:用药期间出现严重的不良反应;主动要求退出本研究;未签署知情同意书。采用分层随机抽样法将其分为试验组(n=48)与对照组(n=48)。在试验组中,有女22例,男26例;其年龄为23~76岁,平均年龄为(46.73±7.72)岁;其病程为2~8 d,平均病程为(4.05±0.61)d;其中,原发病为败血症、急性腹膜炎、胆道感染、重症肺炎的患者分别有5例、7例、6例、30例。在对照组中,有女23例,男25例;其年龄为25~77岁,平均年龄为(46.28±7.81)岁;其病程为1~8 d,平均病程为(4.09±0.60)d;其中,原发病为败血症、急性腹膜炎、胆道感染、重症肺炎的患者分别有6例、8例、6例、28例。两组患者的一般资料相比,差异无统计学意义(P>0.05)。
1.2 方法
对两组患者均进行常规治疗,包括对其实施吸氧、镇静、营养支持、维持血流动力学指标稳定、抗感染、控制血压和血糖、纠正水电解质紊乱及酸碱失衡、防治应激性溃疡及保护器官功能等治疗。在此基础上,用小剂量的氢化可的松(生产厂家:国药集团容生制药有限公司;批准文号:国药准字H20023068)对对照组患者进行治疗,其用法是:静脉滴注,100 mg/次,1次/d,共治疗2周。用参附注射液联合小剂量的氢化可的松(其药品信息及用法同上)对试验组患者进行治疗。参附注射液(生产厂家:雅安三九药业有限公司;批准文号:国药准字Z20043116)的用法是:静脉滴注,60 mL/次,1次/d,共治疗2周。
1.3 观察指标
1)治疗前后,检测并比较两组患者血清肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interkukin-1β,IL-1β)及 降 钙 素 原(procalcitonin,PCT)的水平。检测方法是:采集患者清晨空腹状态下的外周静脉血,对血液标本进行离心处理(转速为3000 r/min),分离出血清,并将血清置入-80℃的冰箱中保存待检。采用酶联免疫吸附法及相应的试剂盒(由上海沪震实业有限公司提供)测定血清中TNF-α、IL-1β、PCT的水平。2)治疗前后,比较两组患者的平均动脉压(mean arterial pressure,MAP)及中心静脉压(central venous pressure,CVP)。采用多功能监护仪(型号:M-9000E;生产厂家:深圳市艾瑞康医疗设备有限公司)测量患者的MAP和CVP。3)治疗前后,比较两组患者血清白细胞分化抗原4(Cluster of differentiation4,CD4+)T淋巴细胞/白细胞分化抗原8(Cluster of differentiation8,CD8+)T淋巴细胞的比值及血清单核细胞人白细胞抗原DR(human leukocyte antigen-DR,HLA-DR)的水平。采用流式细胞仪(型号:FACSCanto Ⅱ;生产厂家:美国BD公司)测定血清CD4+T淋巴细胞/CD8+T淋巴细胞的比值及血清单核细胞HLA-DR的水平。4)治疗前后,比较两组患者的序贯器官衰竭估计(sequential organ failure assessment,SOFA)评分及急性生理与慢性健康评分表(acute physiology and chronic health evaluation score,APACHE-Ⅱ)的评分。APACHE-Ⅱ包括生理指标、格拉斯哥昏迷指数、有无免疫损害及年龄4个维度,总分为71分,患者的评分越高表示其病情越严重、预后越差。SOFA评分包括肾脏、肝脏、神经、心血管、血流及呼吸6个维度,总分为48分,患者的评分越高表示其发生器官衰竭的风险越高、预后越差。
1.4 统计学方法
用SPSS 20.0软件处理本研究中的数据,计量资料用均数±标准差(±s)表示,用t检验;计数资料用%表示,用χ2检验;检验水准α=0.05,P<0.05表示差异有统计学意义。
2 结果
2.1 对比治疗前后两组患者血清炎症指标的水平
治疗前,两组患者血清TNF-α、IL-1β、PCT的水平相比,差异无统计学意义(P>0.05)。治疗后,两组患者血清TNF-α、IL-1β、PCT的水平均低于治疗前,差异有统计学意义(P<0.05)。治疗后,试验组患者血清TNF-α、IL-1β、PCT的水平均低于对照组患者,差异有统计学意义(P<0.05)。详见表1。
表1 对比治疗前后两组患者血清炎症指标的水平(± s)
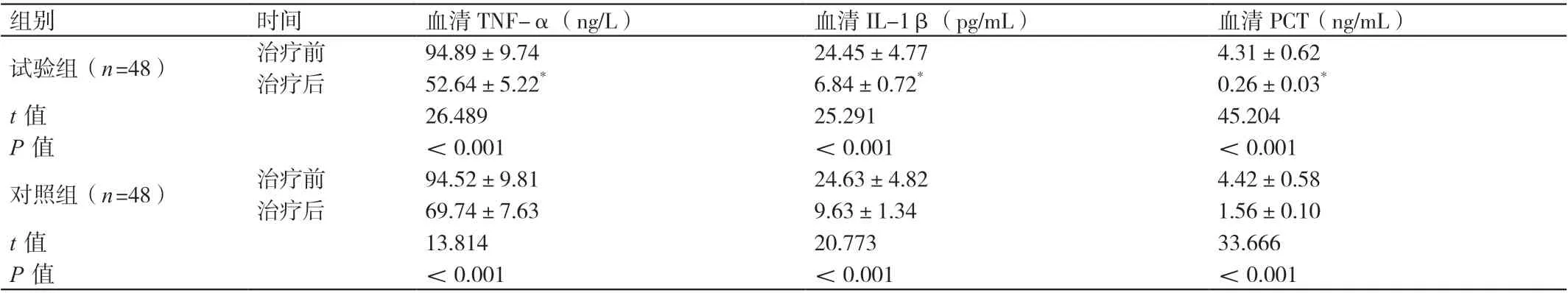
表1 对比治疗前后两组患者血清炎症指标的水平(± s)
注:*与对照组治疗后相比,P<0.05。
组别 时间 血清TNF-α(ng/L) 血清IL-1β(pg/mL) 血清PCT(ng/mL)试验组(n=48) 治疗前 94.89±9.74 24.45±4.77 4.31±0.62治疗后 52.64±5.22* 6.84±0.72* 0.26±0.03*t值 26.489 25.291 45.204 P值 <0.001 <0.001 <0.001对照组(n=48) 治疗前 94.52±9.81 24.63±4.82 4.42±0.58治疗后 69.74±7.63 9.63±1.34 1.56±0.10 t值 13.814 20.773 33.666 P值 <0.001 <0.001 <0.001
2.2 对比治疗前后两组患者的血流动力学指标
治疗前,两组患者的CVP、MAP相比,差异无统计学意义(P>0.05)。治疗后,两组患者的CVP、MAP均高于治疗前,差异有统计学意义(P<0.05)。治疗后,试验组患者的CVP、MAP均高于对照组患者,差异有统计学意义(P<0.05)。详见表2。
表2 对比治疗前后两组患者的血流动力学指标(mmHg,± s)
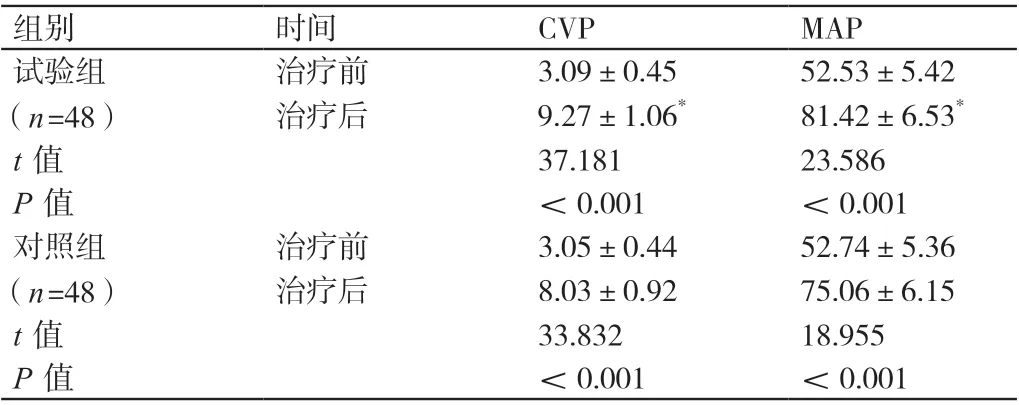
表2 对比治疗前后两组患者的血流动力学指标(mmHg,± s)
注:*与对照组治疗后相比,P<0.05。
组别 时间 CVP MAP试验组(n=48)治疗前 3.09±0.45 52.53±5.42治疗后 9.27±1.06* 81.42±6.53*t值 37.181 23.586 P值 <0.001 <0.001对照组(n=48)治疗前 3.05±0.44 52.74±5.36治疗后 8.03±0.92 75.06±6.15 t值 33.832 18.955 P值 <0.001 <0.001
2.3 对比治疗前后两组患者血清T淋巴细胞亚群、单核细胞HLA-DR的水平
治疗前,两组患者血清CD4+T淋巴细胞/CD8+T淋巴细胞的比值、血清单核细胞HLA-DR的水平相比,差异无统计学意义(P>0.05)。治疗后,两组患者血清CD4+T淋巴细胞/CD8+T淋巴细胞的比值均低于治疗前,其血清单核细胞HLA-DR的水平均高于治疗前,差异有统计学意义(P<0.05)。治疗后,试验组患者血清CD4+T淋巴细胞/CD8+T淋巴细胞的比值低于对照组患者,其血清单核细胞HLA-DR的水平高于对照组患者,差异有统计学意义(P<0.05)。详见表3。
表3 对比治疗前后两组患者血清T淋巴细胞亚群、单核细胞HLA-DR的水平(± s)
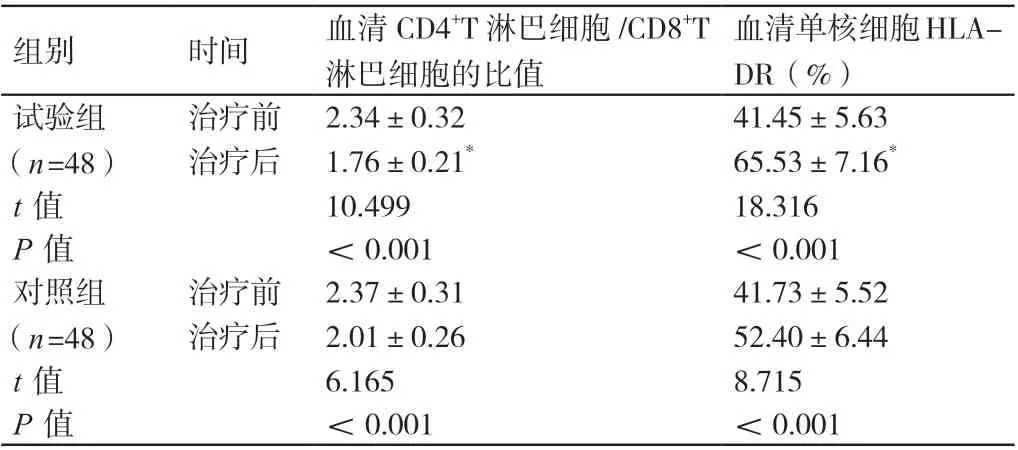
表3 对比治疗前后两组患者血清T淋巴细胞亚群、单核细胞HLA-DR的水平(± s)
注:*与对照组治疗后相比,P<0.05。
组别 时间 血清CD4+T淋巴细胞/CD8+T淋巴细胞的比值血清单核细胞HLADR(%)试验组(n=48)治疗前 2.34±0.32 41.45±5.63治疗后 1.76±0.21* 65.53±7.16*t值 10.499 18.316 P值 <0.001 <0.001对照组(n=48)治疗前 2.37±0.31 41.73±5.52治疗后 2.01±0.26 52.40±6.44 t值 6.165 8.715 P值 <0.001 <0.001
2.4 对比治疗后两组患者的SOFA评分及APACHE-Ⅱ评分
治疗前,两组患者的SOFA评分、APACHE-Ⅱ评分相比,差异无统计学意义(P>0.05)。治疗后,两组患者的SOFA评分、APACHE-Ⅱ评分均低于治疗前,差异有统计学意义(P<0.05)。治疗后,试验组患者的SOFA评分、APACHE-Ⅱ评分均低于对照组患者,差异有统计学意义(P<0.05)。详见表4。
表4 对比治疗后两组患者的SOFA评分及APACHE-Ⅱ评分(分,± s)
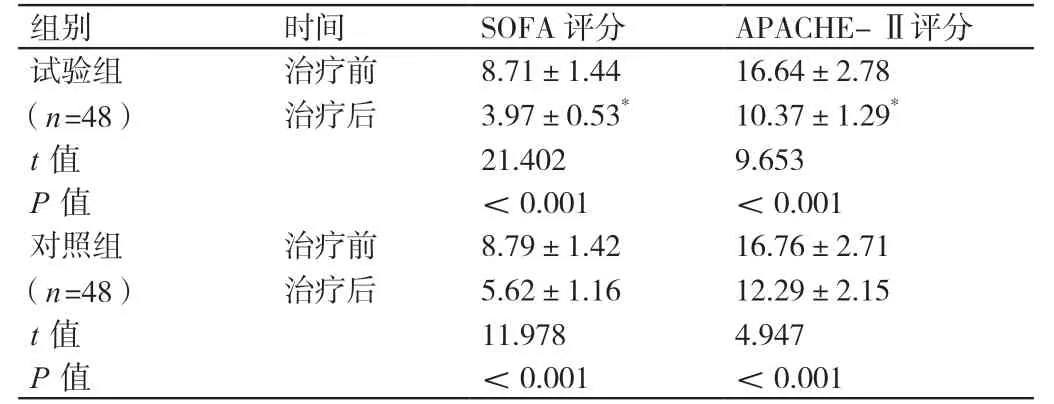
表4 对比治疗后两组患者的SOFA评分及APACHE-Ⅱ评分(分,± s)
注:*与对照组治疗后相比,P<0.05。
组别 时间 SOFA评分 APACHE-Ⅱ评分试验组(n=48)治疗前 8.71±1.44 16.64±2.78治疗后 3.97±0.53* 10.37±1.29*t值 21.402 9.653 P值 <0.001 <0.001对照组(n=48)治疗前 8.79±1.42 16.76±2.71治疗后 5.62±1.16 12.29±2.15 t值 11.978 4.947 P值 <0.001 <0.001
3 讨论
脓毒症的发病机制较为复杂。有研究指出,脓毒症是一种由病原微生物及其毒素或胞壁产物激活机体的体液应答(激肽、补体及细胞因子等)和细胞应答(巨噬细胞、单核细胞及中性粒细胞等),引起复杂的炎症反应和免疫调节失衡所导致的炎症反应综合征[5]。患者在发生脓毒症后可出现机体组织缺氧、缺血,引起细胞代谢紊乱,进而可造成多器官功能障碍。据统计,脓毒症在全球范围内的年发病率约为3‰[6]。由脓毒症致死的人数已超过由胰腺癌、结肠癌、直肠癌等常见恶性肿瘤致死的人数。脓毒性休克是指由脓毒症引起的休克。目前,临床上对脓毒性休克患者主要是进行呼吸支持、抗感染、维持血流动力学稳定、预防器官功能衰竭等治疗。有研究指出,脓毒性休克的病理基础为炎症反应,炎症反应会导致机体的神经体液系统发生改变,进而可减少机体分泌能够维持内环境稳定及抑制炎症反应的肾上腺皮质激素[7]。氢化可的松是一种肾上腺皮质激素类药物,可抑制脓毒性休克患者体内的炎症反应,改善其肺功能,逆转其休克现象[8]。此药的治疗机制是:1)可增强内皮素、血管紧张素及血管加压素收缩血管的作用,避免患者的血管处于麻痹状态。2)可减轻肺间质水肿,抑制炎症反应,维持患者体内炎性因子的平衡状态。3)可起到免疫调节的作用,改善患者的免疫功能紊乱。有研究指出,用小剂量的氢化可的松治疗脓毒性克虽然可改善患者的组织灌注及血流动力学指标,但并不能改善其预后[9-10]。中医学认为,脓毒性休克属于“厥证”、“脱证”等范畴,其病机主要为正衰邪盛、毒热内蕴、瘀血阻滞、腑气不通等。中医主张以扶正祛邪、活血化瘀、清热解毒为主要原则治疗此病[11]。参附注射液是一种由黑附片、红参制成的纯中药制剂。其中黑附片可滋补脾肾、回阳救逆,红参可复脉固脱、补充元气。二者合用,可共奏回阳救逆、益气固脱之功。现代药理学研究发现,参附注射液具有维持抗炎/促炎平衡及清除细菌内毒素的作用[12]。TNF-α是一种主要由活化的单核/巨噬细胞产生,能杀伤和抑制肿瘤细胞、增强中性粒细胞的吞噬功能、诱导肝细胞合成急性期反应蛋白的一种炎性因子。TNF-α可促使炎性细胞的活化、聚集。IL-1β是一种主要由活化单核-巨噬细胞产生的炎性因子,可参与机体组织的破坏。PCT是一种可对感染性疾病严重程度进行评估的新型炎症标记物。本研究的结果显示,治疗后,试验组患者血清TNF-α、IL-1β、PCT的水平均低于对照组患者,差异有统计学意义(P<0.05)。这说明,用参附注射液联合小剂量的氢化可的松治疗脓毒性休克能显著减轻患者体内的炎症反应。脓毒性休克患者在发病的早期会出现心律失常、低血压等心肌损伤的表现,其组织血液灌注不足,易引起多器官功能衰竭[13]。本研究的结果显示,治疗后,试验组患者的CVP、MAP均高于对照组患者,差异有统计学意义(P<0.05)。这说明,用参附注射液联合小剂量的氢化可的松治疗脓毒性休克能显著改善患者的血流动力学指标。究其原因主要是,参附注射液中黑附子所含的去甲乌头碱能促进心肌的收缩,增加房室的兴奋性;人参中的人参皂苷可促进心肌的收缩,扩张血管,改善心脏的泵血功能。CD4+T淋巴细胞/CD8+T淋巴细胞的比值可反映机体细胞的免疫状态。单核细胞HLA-DR是一种能够反映严重感染状态下机体免疫应答受抑制状况的组织相容性Ⅱ类抗原。有研究认为,血液中单核细胞HLA-DR水平的动态变化与脓毒性休克患者的免疫功能存在相关性[14]。本研究的结果显示,治疗后,试验组患者血清CD4+T淋巴细胞/CD8+T淋巴细胞的比值低于对照组患者,其血清单核细胞HLA-DR的水平高于对照组患者,差异有统计学意义(P<0.05)。这与宁易平等[15]的研究结果相近。这说明,用参附注射液联合小剂量的氢化可的松治疗脓毒性休克可起到良好的免疫调节作用。
综上所述,在对脓毒性休克患者进行常规治疗的基础上,用参附注射液联合小剂量的氢化可的松对其进行治疗能显著减轻其机体的炎症反应,改善其血流动力学指标及免疫功能,提高其预后质量。

