Beclin-1基因shRNA慢病毒载体的构建及其对B16F10细胞自噬及活力的影响
贾艳艳,赵莹莹,余祖华,何 雷,廖成水,李 静,郁 川,张春杰*,李银聚
(1.河南科技大学动物疫病与公共卫生重点实验室,洛阳 471000;2.洛阳市活载体生物材料与动物疫病防控重点实验室,洛阳 471000)
自噬(autophagy)是一种高度保守性的细胞内在机制[1]。当细胞处于低氧、低营养、低能量等恶劣条件时,细胞自动激活自噬机制,通过调控多种自噬相关蛋白ATG和溶酶体产生消化级联反应,消化自身内部衰老、病变的细胞器,以此维持细胞稳态[2-3]。研究表明,在正常细胞中,自噬能够通过对线粒体的稳态性转变和蛋白聚合物的清除来实现其抗肿瘤功能,而自噬基因的缺失会导致线粒体功能障碍,增加细胞的氧化性应激,最终破坏染色体的稳定性而导致肿瘤发生[4-5]。因此在肿瘤细胞发生发展过程中,自噬具有促进和抑制肿瘤的双重作用,已成为生物医学界研究的热点[6]。
自噬蛋白Beclin-1是酵母ATG6的同源基因,主要包含BH3(Bcl-2-homology-3)、卷曲螺旋域(CCD)和保守进化域(ECD)等结构域,其与Ⅲ型磷脂酰肌醇-3-磷酸酯酶(PIK3C3)形成催化核心区,调节其他蛋白在自噬前体结构中的定位,从而调控自噬活性[7-8]。Beclin-1除了作为自噬核心复合物关键蛋白,且在多种肿瘤组织低表达,被认为可能是潜在的抑癌基因[9]。但也有报道Beclin-1基因敲除可抑制骨肉瘤细胞的自噬活性,并降低骨肉瘤细胞的增殖、侵袭和迁移,可作为一个提高抗癌药物疗效的潜在靶点[10],提示Beclin-1基因在肿瘤生物学中有着复杂且重要的作用。目前,国内没有关于敲除Beclin-1基因的小鼠黑色素瘤细胞B16F10株的报道,因此,本研究以小鼠黑色素瘤细胞B16F10为研究对象,利用RNAi技术构建沉默Beclin-1基因的肿瘤细胞系,为分析Beclin-1基因、自噬与肿瘤三者关系奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 生物材料及试剂 pMD2G、pSPAX2和穿梭质粒[携带目的基因或者shRNA(short hairpin RNA, shRNA)]购自汉恒生物;大肠杆菌DH5α、293T细胞由河南科技大学动物疫病与公共卫生实验室保存;B16F10细胞系购自中国科学院肿瘤细胞库。
DMEM高糖培养基、胎牛血清、LipofiterTM购自Gibco公司,限制性内切酶、T4连接酶购自Fermentas公司,puromycin购自Sigma公司,SYBR Green Master Mix购自TaKaRa公司,LC3多抗、RFP标记Beclin-1兔单克隆抗体和HRP标记羊抗兔IgG购自Proteintech公司。
1.1.2 主要仪器 PCR仪、蛋白质电泳仪和凝胶成像系统购自Bio-Rad生命医学产品有限公司,台式冷冻小离心机FRESCO 21购自Thermo公司,超声波裂解仪购自Sonics & Materials公司,转印仪购自Amer Sham公司。荧光定量PCR仪购自Roche公司,倒置荧光显微镜购自德国徕卡公司。
1.2 shRNA的设计与合成
针对m-Beclin-1参考序列,根据RNAi序列的设计原则,设计并合成m-Beclin-1基因特异性siRNA靶点,序列如表1所示,以上shRNA由北京六合华大基因科技有限公司合成。

表1 shRNA序列
1.3 m-Beclin-1-shRNA慢病毒载体的构建、包装和滴度测定
经预试验发现shRNA1的干扰效果最好,将合成的shRNA1 DNA单链退火形成双链,连接到慢病毒表达载体,转化至感受态细胞DH5α,挑取阳性克隆测序。提取测序正确的阳性克隆质粒,与pSPAX2和pMD2G共转染293T细胞,于转染后48 h收集细胞培养上清,利用超速离心机纯化浓缩病毒,并进行滴度测定。
1.4 Beclin-1干扰稳转细胞系的构建与筛选
将慢病毒以MOI值为1、3、10感染B16F10细胞,感染48 h后观察细胞荧光情况,摸索慢病毒的最佳MOI值。
将B16F10细胞培养于24孔板,待细胞汇合率约为60%,更换含puromycin的培养基,设定puromycin浓度梯度为0.2、0.4、0.6、0.8、1.0、1.5、2.0、2.5、3.0 μg·mL-1,每个浓度设3个复孔。2~3 d更换培养基,并保持puromycin浓度不变,观察细胞的死亡情况,选取能够杀死全部细胞的最低浓度为最佳细胞筛选浓度。
将过夜培养的B16F10细胞弃去细胞培养基,添加5 μg·mL-1的助感染试剂polybrene(hexadimethrine bromide,聚凝胺)后,将慢病毒以最佳MOI值感染B16F10细胞,用最佳细胞筛选浓度的 puromycin进行筛选培养,每48 h更换含puromycin培养基,待长出单克隆细胞,挑出细胞团,采用有限稀释法对阳性孔细胞进行亚克隆,重复筛选3~5次,直至获得稳定沉默Beclin-1基因的小鼠黑色素瘤细胞株B16F10-Beclin-1-shRNA1。
1.5 qPCR检测稳转细胞系的干扰效果
抽提稳转细胞系的总RNA,进行cDNA的合成及纯化,最后进行Real-time PCR分析,具体的反应条件:95 ℃预变性15 s,95 ℃变性5 s,58 ℃退火10 s,72 ℃延伸15 s,39个循环,反应结束后分析Beclin-1 mRNA水平的变化。m-Beclin-1基因的PCR引物序列见表2。

表2 引物序列
1.6 荧光显微镜观察稳转细胞系Beclin-1蛋白的表达情况
取生长状态良好的稳转细胞系,消化后制备成单细胞悬液,将细胞悬液滴加至12孔板内爬片,待细胞贴壁后,固定爬片、RFP标记Beclin-1兔单抗和HRP标记羊抗兔IgG孵育,DAPI避光孵育,封片后在荧光显微镜下采集图像。
1.7 稳转细胞系自噬标志物LC3蛋白表达情况的测定
提取稳转细胞系总蛋白进行SDS-PAGE电泳,转膜后用脱脂牛奶进行封闭过夜,次日与GAPDH一抗(1∶1 000稀释)、LC3一抗(1∶1 000稀释)37 ℃ 孵育2~3 h,HRP标记二抗(1∶3 000稀释)孵育1 h,化学发光显色。
1.8 透射电子显微镜观察细胞内自噬小体的形成
将状态良好的B16F10细胞弃掉培养基,更换含40 nmol·L-1的自噬诱导剂雷帕霉素(RAPA)的完全培养基继续培养3 h,消化收集细胞,加入戊二醛溶液固定过夜。次日,漂洗4次,1%锇酸溶液固定1.5 h。漂洗4次,丙酮梯度脱水,环氧树脂浸透过夜。浸透后的样本放入包埋胶囊的纯环氧树脂中,烤箱聚合。超薄切片,醋酸铀和枸橼酸铅各染色15 min,透射电镜观察并拍照。
1.9 细胞活力的测定
将细胞分别以1.0×104cells·孔-1接种至96孔板,每组细胞重复3次,待长成单层细胞后开始计时,于0、6、12、18、24、36、48、60、72、84、96和120 h后,每组孔内加入10 μL CCK-8溶液,在37 ℃、5% CO2培养箱孵育,2 h后终止显色,利用紫外分光光度记测定450 nm波长下各孔吸光度数值,分析细胞活力状态。
1.10 统计与分析
使用SPSS 20.0软件进行统计分析,根据数据类型选择单因素方差分析或t检验进行组间比较(*.P<0.05,**.P<0.01,***.P<0.001),应用GradPrism5.0软件作图。
2 结 果
2.1 m-Beclin-1-shRNA慢病毒载体的测序鉴定
在含有抗性的LB平板上挑取转化后的重组质粒菌,于37 ℃,250 r·min-1条件下摇菌14 h后,将菌液送公司测序。如图1所示,测序结果(命名为NoName,见图1)与目标序列(Q1897-2)比对后,与预期相符,表明成功构建了慢病毒载体m-Beclin-1-shRNA。

图1 序列比对
2.2 慢病毒包装及病毒滴度的检测
利用瞬时转染法,将构建好的包装载体瞬时共转染293T细胞系而产生重组慢病毒。随后将病毒稀释感染细胞,通过稀释计数法计算出病毒滴度为1×108TU·mL-1。
2.3 Beclin-1干扰稳转细胞系的筛选
经过puromycin浓度梯度摸索,能够杀死B16F10空白细胞的最低puromycin浓度为1.5 μg·mL-1。将慢病毒以不同MOI值感染B16F10细胞,选择感染效率高且细胞状态较好的孔,对应为最佳MOI值,48 h后观察发现MOI值为1、3、10荧光比例分别为20%、40%、70%左右,本次试验中慢病毒最佳MOI值为10。
将慢病毒以MOI为10感染B16F10细胞,在puromycin加压筛选下,利用有限稀释法最终获得干扰Beclin-1表达的稳转细胞系B16F10-m-Beclin-1-shRNA1,荧光显微镜下观察大多数细胞发出绿色荧光,见图2。

A.B16F10细胞;B.B16F10-m-Beclin-1-shRNA1稳转细胞系
2.4 m-Beclin-1基因的mRNA相对表达水平的测定
经TRIzol法提取细胞总RNA,利用qPCR检测mRNA相对表达水平。如图3所示,m-Beclin-1-shRNA1在B16F10细胞中有干扰下调作用,与对照细胞株相比,m-Beclin-1-shRNA1抑制率为75%(P<0.01)。

图3 Real-time PCR检测 Beclin-1基因mRNA的表达
2.5 稳转细胞系Beclin-1蛋白的表达量分析
利用Beclin-1荧光抗体检测稳转细胞系Beclin-1蛋白的表达情况,荧光显微镜观察两组细胞的荧光强度。如图4所示,在同一激发光强度下,B16F10-con-sh细胞内Beclin-1蛋白荧光强度明显高于m-Beclin-1-shRNA1细胞,结果表明稳定沉默Beclin-1 B16F10细胞系的Beclin-1蛋白表达水平明显降低。

图4 免疫荧光分析Beclin-1蛋白的表达(40×)
2.6 Beclin-1沉默对自噬标志物蛋白LC3表达情况的影响
提取B16F10-m-Beclin-1-shRNA1和B16F10-con-sh细胞总蛋白,利用Western blot方法分析B16F10细胞内自噬蛋白LC3的表达情况。如图5所示,与对照组细胞相比,B16F10-m-Beclin-1-shRNA1细胞系中LC3-Ⅱ的蛋白表达水平显著降低,降低了61.34%(P<0.01),LC3-Ⅱ/LC3Ⅰ比值显著降低,降低比例为117.93%(P<0.01),结果表明沉默Beclin-1基因后B16F10细胞自噬被显著抑制。
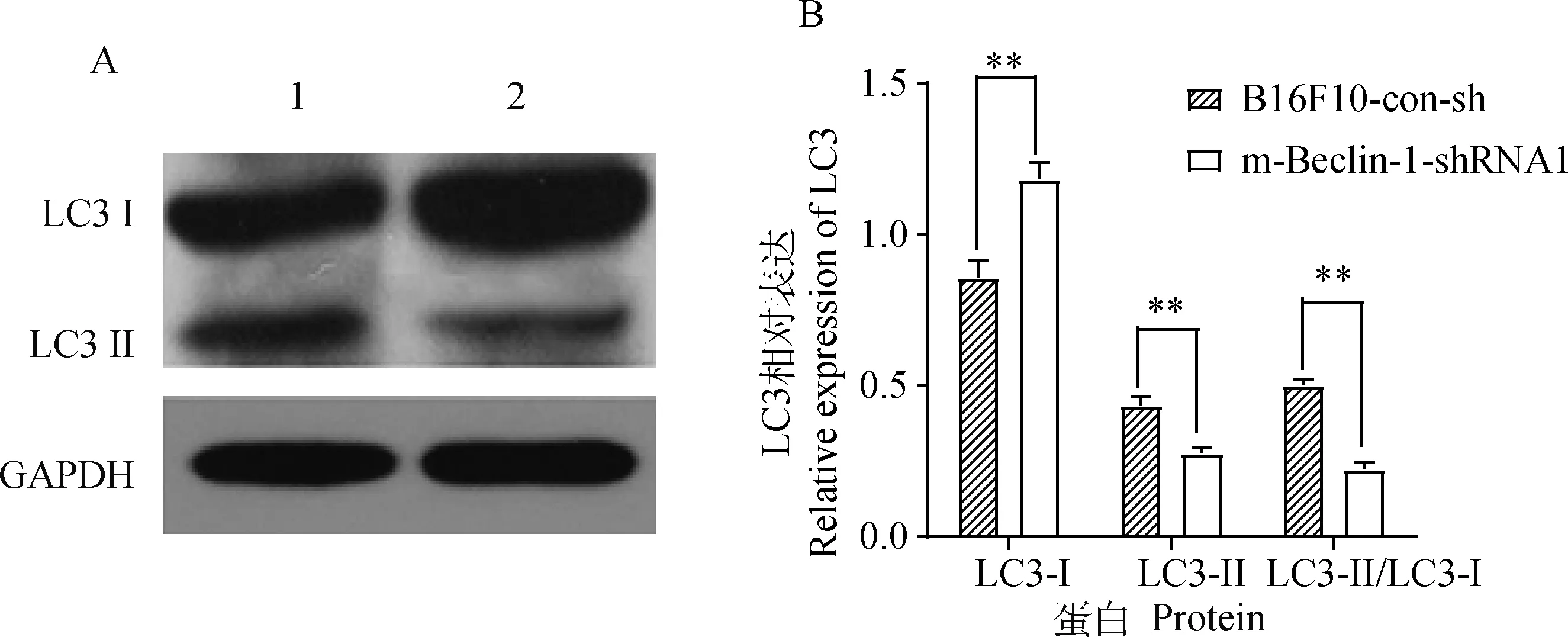
A.蛋白电泳图(1.正常对照细胞 B16F10-con-sh;2.稳转细胞系B16F10-m-Beclin-1-shRNA1);B.LC3蛋白相对表达量
2.7 透射电镜观察B16F10细胞内的自噬现象
收集细胞、固定、制样后在透射电镜下观察,RAPA刺激后的B16F10-con-sh对照细胞内细胞质中可见多个散在的双层膜结构的自噬小体及内含细胞器的空泡状自噬溶酶体,细胞超微结构正常,细胞膜清晰可见,然而RAPA刺激后的B16F10-m-Beclin-1-shRNA1细胞中自噬小体较少。

A.正常对照细胞B16F10-con-sh;B.稳转细胞系B16F10-m-Beclin-1-shRNA1;N.细胞核;M.线粒体;Ass.自噬溶酶体
2.8 Beclin-1沉默对细胞活力的影响
利用CCK-8方法测定B16F10-m-Beclin-1-shRNA1和B16F10-con-sh细胞在不同培养时间点的OD值,通过公式计算出细胞活力。如图7所示,B16F10-m-Beclin-1-shRNA1组细胞活力显著低于对照组,具有统计学意义。

图7 CCK-8法测定细胞活力
3 讨 论
自噬是一种进化上保守的溶酶体降解途径,不仅负责细胞质成分的更新,还能够对抗各种病原微生物的感染[11]。Beclin-1是自噬相关基因,其表达水平与自噬水平息息相关,且研究证实其在肿瘤的发生发展中扮演着重要角色[12-13]。本研究通过RNAi技术成功构建了稳定沉默Beclin-l的B16F10细胞系,结果显示该细胞系Beclin-l基因的 mRNA和蛋白表达得到有效抑制,并且干预Beclin-1基因表达能够抑制B16F10细胞自噬的发生,加速B16F10细胞死亡,提示自噬活性与B16F10肿瘤细胞增殖有关。
RNAi能够特异性沉默靶基因,主要是通过短双链结构诱导靶基因mRNA特异性降解[14-15]。shRNA(short hairpin RNA, shRNA)是一段具有紧密发卡环(tight hairpin turn)的RNA序列,常被用于RNAi沉默靶基因的表达[16]。本研究根据shRNA设计原则,同时设计了针对小鼠Beclin-1基因的3个慢病毒shRNA,根据敲低效果,选取沉默效率最高的一组用于后续试验,提高了试验效率。利用RNAi技术,选择慢病毒作为载体转染宿主细胞,慢病毒比腺病毒或逆转录病毒有较多优势,它能够将自身基因整合到宿主基因组中,且整合位点处于转录相对活跃的区域,从而获得更加高效表达或抑制外源基因的稳转细胞系[17]。且本研究所用的穿梭质粒携带有GFP报告基因,便于观察转染效率。本研究将Beclin-1干扰载体转染293T细胞,在荧光显微镜下观察到大量的绿色荧光,显示慢病毒包装成功,病毒滴度为1×108TU·mL-1。本试验为促进病毒的感染效率,在感染过程中降低培养基中血清的浓度,同时添加5 μg·mL-1的助感染试剂polybrene,polybrene相当于破膜剂,只有细胞膜破了,病毒才有机会进入细胞,研究报道polybrene显著提高重组腺病毒感染细胞的效率,且在一定浓度范围内呈剂量依赖性[18]。以上研究为下一步筛选稳转细胞系奠定基础。
构建稳转细胞系时常采用一些抗生素进行筛选,如G418、潮霉素B或puromycin,在筛选前需要先通过抗生素浓度梯度试验,选择杀死全部细胞的最低浓度为适合该类细胞的最佳筛选浓度。用G418或潮霉素B,选用在5 d左右出现细胞大批死亡,2周全部死亡的浓度作为筛选浓度。对于puromycin,通常采用在3~4 d杀死全部细胞的浓度。本试验中慢病毒载体上带有puromycin抗性基因,细胞感染病毒后则会成功获得puromycin抗性,因此,本研究在稳转细胞系筛选前,将puromycin浓度梯度设置为0.2、0.4、0.6、0.8、1.0、1.5、2.0、2.5、3.0 μg·mL-1处理B16F10细胞,72 h后观察细胞的死亡情况,最后确定能够杀死B16F10空白细胞的最低puromycin浓度为1.5 μg·mL-1。经过puromycin加压筛选成功获得干扰Beclin-1表达的B16F10稳转细胞系。
Beclin-1是第1个被发现的哺乳动物自噬相关基因,主要通过与PI3K中的亚基VPS34及其调控成分VPS15型组成Ⅲ型磷脂酰肌醇三磷酸激酶复合物,诱导吞噬泡形成,在自噬体的形成与成熟两个阶段发挥作用[19-20]。Western blot结果表明,与对照组细胞相比,B16F10-m-Beclin-1-shRNA1细胞组中LC3-Ⅱ/LC3Ⅰ比值显著降低;电镜结果显示,即使在自噬诱导剂RAPA刺激下B16F10-m-Beclin-1-shRNA1细胞内自噬小体形成较少,以上结果充分说明沉默Beclin-1表达能够有效抑制B16F10细胞自噬的发生。这与张松[21]报道沉默Beclin-1基因可以降低前列腺增生上皮细胞BPH-1的自噬活性相一致。以上结果为研究Beclin-l基因功能与自噬关系提供重要试验材料。
越来越多研究表明,除调控自噬外,Beclin-1还可通过非自噬依赖性通路影响肿瘤的发生和进展[22]。本研究中CCK-8试验结果显示,随着时间的延长,干预Beclin-1表达后的B16F10细胞活力与对照细胞相比显著下降,说明Beclin-1表达下降能够促进B16F10细胞死亡。Ye等[23]发现,Beclin-1基因敲除能通过抑制基质金属蛋白酶家族MMP-9蛋白抑制尤文肉瘤细胞SK-ES-1的增殖、侵袭和迁移。然而一些学者研究表明Beclin-1在肝癌等大多数肿瘤组织中表达量降低,且Beclin-1表达下降直接促进肿瘤细胞增殖活性[24],以上结果的不一致推测可能与Beclin-1在调控肿瘤作用中存在阶段性有关。
本研究利用慢病毒介导的RNAi技术构建了稳定沉默Beclin-1基因B16F10细胞系,不仅可以有效沉默自噬基因Beclin-1的表达,而且能够降低B16F10细胞自噬活性,加速B16F10肿瘤细胞死亡。由于自噬的复杂性和阶段性,至于沉默Beclin-1基因激活哪些信号通路,从而促进B16F10肿瘤细胞死亡,这需要在后续试验中进行探索。以上研究为探讨Beclin-1基因在抗小鼠黑色素瘤中的作用机制奠定重要物质基础。
4 结 论
利用RNA干扰技术构建稳定沉默Beclin-l基因的B16F10小鼠黑色素瘤细胞系,结果显示,该细胞系Beclin-l基因的 mRNA和蛋白表达得到有效抑制,并且干预Beclin-1基因表达能够抑制B16F10细胞自噬的发生,加速B16F10细胞死亡,提示自噬活性与B16F10肿瘤细胞增殖密切相关,这为探讨Beclin-1基因功能及自噬在抗肿瘤中的作用奠定重要基础。

