根际耐盐真菌分离筛选及溶磷促生性能分析
谭海霞 李丽艳 杜迎辉 孙杉杉 王连龙 董 雪 王玉玺 张 颖
(1河北环境工程学院,066000,河北秦皇岛;2领先生物农业股份有限公司,066000,河北秦皇岛;3河北省农业生物技术技术创新中心,066000,河北秦皇岛)
我国沿海地区土壤盐碱化问题较为严重,改良修复盐渍化土壤可为滨海地区环境保护及农业经济发展提供保障。近年来,微生物对土壤的修复作用成为研究的热点[1-2],张燕等[3]在2019年提出并验证了“微生物+复合型盐碱土壤修复技术”的作用机理。可溶磷在植物生长发育中起重要作用,为了提高土壤中磷的可利用性,一些学者对溶磷真菌的分离筛选及溶磷特性进行了相关研究[4-12],但筛选的菌株在盐渍化土壤中应用的潜力非常有限。目前,关于筛选耐较高盐浓度解磷真菌的报道较少,范延辉等[13]筛选出1株草酸青霉,耐受的盐浓度可达12.5%。盐生植物根际有丰富的耐盐微生物资源,本研究以北戴河湿地和曹妃甸湿地中优势盐生植物的根际土壤为研究对象,筛选出耐高盐浓度的解磷真菌,并综合评价其溶磷促生能力,以期筛选出具有优良生物效能的解磷菌株,为盐碱土生物菌肥的研制提供优质菌种资源。
1 材料与方法
1.1 供试材料
1.1.1 供试土壤 土壤样品采自于河北省秦皇岛北戴河湿地(119°30′51′~119°31′2′E,39°50′28′~39°50′46′N)和唐山曹妃甸湿地(39°11′35′~39°22′37′N,118°23′27′~118°35′20′E),采样区属于典型的滨海湿地,属温带大陆性季风气候。土壤类型为滨海盐土。基本理化性状见表1,碱解氮和有效磷含量适中,有机质含量不足,pH和水溶性盐含量偏高,为滨海中度盐碱土,土壤采自盐地碱蓬(Suaeda salsa)、盐角草(Salicornia europaea)和碱蓬(Suaeda glauca)植物根际。

表1 采样地土壤理化性状Table 1 Physical and chemical properties of the soil in the sampling sites
1.1.2 供试培养基 PDA培养基(马铃薯琼脂培养基):用于真菌分离,NaCl浓度为10%、马铃薯200.0g、葡萄糖20.0g、NaCl 100g、氯霉素0.03g和琼脂粉20.0g,加水定容至1000mL,pH为9.0。
耐盐培养基:按上述方法,分别配制NaCl含量为0%、5.0%、10.0%和15.0%的PDA固体培养基。
无机磷固体培养基:用于解磷菌初筛,葡萄糖10.0g、(NH4)2SO40.5g、酵母浸粉0.5g、NaCl 0.3g、MgSO40.3g、KCl 0.3g、FeSO40.03g、MnSO40.03g、Ca3(PO4)25.0g、琼脂 15.0g、pH 7.0~7.5。
有机磷固体培养基:用于解磷菌初筛,葡萄糖10.0g、(NH4)2SO40.5g、酵母浸粉0.5g、NaCl 0.3g、KCl 0.3g、MgSO40.3g、FeSO40.03g、MnSO40.03g、卵磷脂 0.2g、CaCO31.0g和琼脂15.0g、pH值7.0~7.5。
无机磷液体培养基和有机磷液体培养基:用于解磷菌复筛,配方同固体培养基,不加琼脂即可,pH 值 7.0~7.5。
1.2 试验方法
1.2.1 耐盐真菌分离 于北戴河湿地和曹妃甸湿地采集植物根际土壤样品,采用5点取样法分别采集盐角草、盐地碱蓬和碱蓬健康植株,切取植株根部装入无菌袋中,带回实验室。植物根际土壤样品制备参考白文娟等[14]的方法。将10g根际土壤样品放入无菌三角瓶中,加入90mL生理盐水震荡20min,静置5min,待土壤均匀分散开,按10倍递减稀释法稀释后,于10%NaCl盐浓度的PDA培养基上涂布,恒温培养5d后,挑取典型的不同形态的单菌落,经纯化后于4℃斜面保存。
1.2.2 平板法初筛解磷菌 根据是否产生溶磷圈初筛解磷菌。挑选纯化菌株分别点接于无机磷及有机磷固体平板,每个处理3次重复,培养5d,挑选具有溶磷圈的真菌,测量溶磷圈直径(D)和菌落直径(d),在PDA平板上纯化培养,作为复筛菌株。
1.2.3 摇瓶法复筛解磷菌 通过摇瓶法研究初筛解磷菌对难溶磷源的溶解能力。耐盐真菌孢子悬液的制备参考李豆豆等[4]的方法。将上述耐盐解磷真菌孢子悬液按照1%的接种量分别接入无机磷液体培养基和有机磷液体培养基中,于28℃、180转/min摇床培养7d。将培养液于6000转/min、4℃离心10min,取上清液2.5mL,采用钼锑抗比色法测定发酵液中有效磷的含量,同时设不接菌为空白对照CK1和CK2,每个处理3次重复,对比各菌株培养液中可溶性磷浓度的大小,筛选出高效解磷菌。
1.2.4 分泌IAA菌株筛选 定性初筛:参考陈越等[15]和崔月贞等[16]的方法并做适当调整。向灭菌后的PDA液体培养基加入过滤除菌的L-色氨酸溶液,终浓度为100mg/L。挑取菌株接入上述培养液中,于30℃、180转/min摇床培养3d,8000转/min离心10min,吸取2mL上清液加入等体积的Salkowski比色液,避光静置30min,观察其颜色变化,以50mg/L的标准IAA作对照,变粉红色为具有分泌IAA能力的菌株。
定量复筛:采用Salkowski比色法[17],将初筛具有分泌IAA能力的菌株接种于PDA液体培养基中振荡培养5d后,调节发酵液OD600值为0.8,备用。发酵液于8000转/min离心10min,吸取3mL上清液加入等体积Salkowski比色液,静置30min,测定530nm处的吸光值,以未接菌的PDA液体培养基为空白对照,以IAA浓度为横坐标、OD530为纵坐标制作IAA标准曲线,通过标准曲线计算IAAf分泌量[18-19]。
1.2.5 解磷菌的鉴定 观察菌落、菌体形态和产孢特征,参照《真菌鉴定手册》[20]初步鉴定。对有较强降解能力的真菌进行rDNA-ITS序列分析:由北京三博远志生物技术有限公司测序,利用真菌通用引物ITS1和ITS4对提取的DNA进行PCR扩增。将获得的DNA序列输入GenBank,与数据库中的所有序列进行Blast比对,选取同源性95%以上的菌株序列,并利用MEGA 5.0构建系统发育树。
1.3 数据分析
采用Excel 2010、DPS V12.01、Origin 8.0和MEGA5.0软件进行数据统计与分析。
2 结果与分析
2.1 耐盐真菌的分离筛选及其耐盐性
以10%NaCl为筛选条件,采用传统平板法分离筛选盐地碱蓬、碱蓬和盐角草3种植物根际土壤耐盐真菌。如表2所示,不同植物根际土壤耐盐真菌的菌落形成单位为4.00~61.25×103cfu/g,不同植物根际土壤真菌数量差异显著,其中以曹妃甸湿地盐地碱蓬根际土壤中耐盐真菌的数量最高。依据菌落形态、大小和颜色等特点分别挑取优势菌株,从3种盐生植物根际土壤中共分离到16株耐盐真菌,将其分别接种于0%、5%、10%和15%NaCl浓度的PDA培养基,培养5d,结果表明,16株菌在盐浓度0~10%均能生长,在盐浓度15%均未生长。

表2 不同植物根际土壤耐盐真菌的数量Table 2 Quantitative characteristics of halotolerant fungi in different plant root soils
2.2 耐盐解磷真菌的筛选及溶磷能力
初筛共分离得到具有解磷功能的耐盐菌株8株,其中1株来自北戴河湿地,菌株编号为G1,7株来自曹妃甸湿地,菌株编号依次为C1-C7,其中解无机磷5株(C1、C2、C3、C4、G1),解有机磷3株(C5、C6、C7)。溶磷能力的大小可根据溶磷圈与菌落直径的比例大小进行初步确定。由表3和表4可知,D/d值在1.05~1.92之间,根据D/d的比值初步认为降解无机磷,菌株中C1和G1溶磷效果较好,D/d均值分别为1.60、1.58;对有机磷的降解能力为菌株C7>C6>C5。初筛的无机磷降解菌和有机磷降解菌,其溶磷量与D/d有一定的相关性(图1),表明D/d在一定程度上代表了溶磷能力的高低,但相关研究表明溶磷圈的大小并不能准确反映菌株的溶磷能力,只能作为确定菌株是否具有解磷能力的基本依据,还需进一步定量评价解磷能力。

表3 不同菌株降解无机磷能力Table 3 Phosphate-solubilizing capacity of inorganic phosphate solubilizing fungi
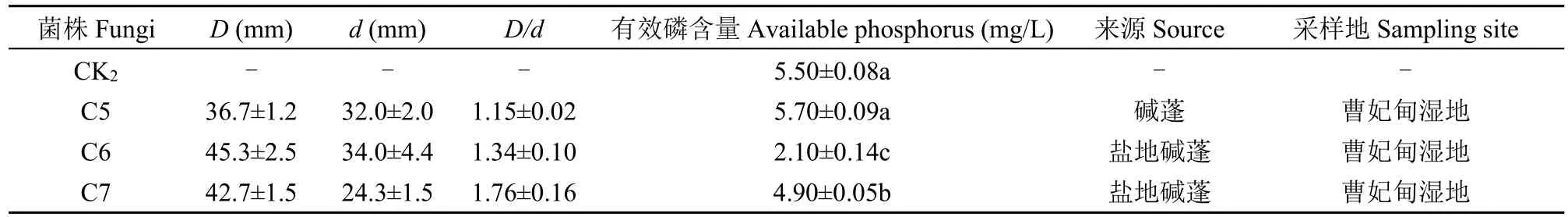
表4 不同菌株降解有机磷能力Table 4 Phosphate-solubilizing capacity of organic phosphate solubilizing fungi
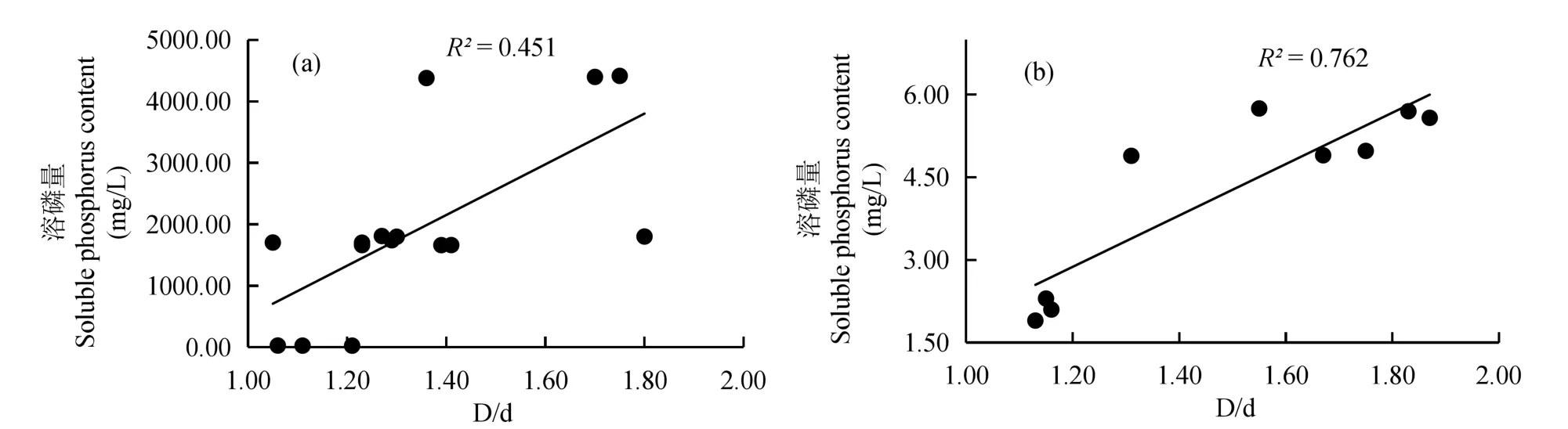
图1 无机磷(a)和有机磷(b)降解菌D/d与溶磷量的相关性Fig.1 The correlation between D/d of inorganic phosphorus fungi(a)and organic phosphate fungi(b)and soluble phosphorus content
利用钼锑抗比色法测定溶磷菌株的溶磷能力,结果(表3和表4)表明,所有菌株在液体培养条件下均具有解磷能力,但解磷能力与平板透明圈法测定的结果不完全相同,不同菌株间解磷能力差异显著。无机磷降解菌中,溶磷量分布在26.61~4415.30mg/L,与CK1相比,有效磷增量位0.80~4371.10mg/L,5种菌株的溶磷能力大小为C1>C4>C3>G1>C2,其中C1菌株的溶磷量最高,达4397.70mg/L,有效磷含量是CK1(26.60mg/L)的165倍,可以考虑作为微生物肥料开发的重点菌种。有机磷降解菌解磷量分布在1.96~5.79mg/L,有效磷增量在-3.4~0.2mg/L,解磷能力均较弱,菌株C5解磷量(5.7mg/L)仅为CK2(5.5mg/L)的1.04倍,菌株C6和C7有效磷含量均低于CK2,有效磷增量为负值,产生这种现象可能是菌株解有机磷能力很弱,溶解出来的磷在其生长过程中被菌体吸收利用。
2.3 产IAA菌株筛选
结果(表5)表明,有6株具有显色反应,说明其具有产IAA的能力,IAA分泌量为6.64~33.07mg/L,其中菌株C1的IAA分泌量最高,为33.07mg/L,与其他菌株差异显著(P<0.05)。

表5 耐盐真菌IAA分泌量Table 5 IAA secretion of halotolerant fungi
2.4 耐盐解磷真菌C1菌株鉴定
2.4.1 菌株培养性状和形态特征 菌株C1在PDA培养基上菌丝生长迅速,初期(1~2d)为白色菌丝,3d后产生大量分生孢子,呈灰绿色至暗绿色。分生孢子梗有隔膜,呈扫帚状,分生孢子灰绿色,圆形或椭圆形,根据《真菌鉴定手册》[20]初步确定为青霉属的一种(Penicilliumsp.)。
2.4.2 分子鉴定 以菌株C1的DNA为模板进行ITS序列的PCR扩增,测序获得长度为595bp的ITS rDNA片段。测序结果与NCBI数据库进行BLAST比对,得出该菌株与相关青霉属菌株序列相似性达到99%。为进一步确定菌株C1的分类学地位,利用MEGA 5.1的Neighbor-Joining法构建系统发育树(图3),结果表明菌株C1与一株青霉属菌株(KF680775.1)的亲缘关系更近,提交序列后获得的登录号为MT557034。综合形态学特征与分子系统学分析确定菌株C1为草酸青霉(Penicillium oxalicum)。

图3 基于ITS基因序列相似性构建的菌株C1的系统发育树Fig.3 Phylogenetic tree of strain C1 based on ITS gene sequences similarity
3 讨论
目前已从多种植物根际分离到真菌,但种类有限,主要分布于青霉属(Penicilliumsp.)、曲霉属(Aspergillussp.)和镰刀菌属(Fusariumsp.)等。研究表明,解磷微生物通过产生有机酸为植物提供有效磷,但已筛选的解磷真菌盐浓度多为0.03%[10,15],解磷真菌耐盐的能力有限,不能在高盐环境中生存,溶磷能力受到抑制,李学平等[9]筛选的解磷菌在盐浓度为10%时菌体生长受到明显抑制。本研究从3种盐生植物根际土壤中共筛选到16株优势真菌,均能耐受10%盐浓度,且生长良好,这表明16株真菌能适应盐渍化土壤环境,具有提高盐碱土壤有效磷含量的潜力。但3种植物根际耐盐真菌数量差异显著,这可能是由于采样区土壤理化环境及植被类型的不同,导致土壤中微生物数量及种类有较大差异。采用溶磷圈法和液体培养法综合评价耐盐真菌的溶磷能力,不同菌株的溶磷能力有很大差异,现有研究报道,溶磷菌在以磷酸钙为磷源的培养基中D/d为1.10~2.07[10,12,21],本研究中菌株C1的D/d值为1.6±0.21,其解磷量可达4397.70mg/L,比目前已筛选到草酸青霉菌的有效磷含量[13,21]高4~25倍,IAA分泌量为33.07mg/L,与已有报道菌株产IAA含量5~20mg/L[22]略高一些,与已有研究相比菌株C1溶磷效果较好;研究发现溶磷圈法并不能直接反映溶磷能力大小,在液体培养条件下,D/d值较大的菌株却具有较低的溶磷量,这与姜焕焕等[10]研究结果一致。有机磷降解菌株在液体培养条件下的溶磷量分布在1.90~5.75mg/L之间,有效磷增量为-3.4~0.2mg/L,解磷能力较弱,原因可能是因为该菌株将溶解出来的有效磷用于自身菌体生长,导致有效磷增量为负值。无机磷降解菌在液体培养条件下的溶磷量分布在 26.61~4415.30mg/L之间,有效磷增量为0.80~4371.10mg/L,这主要受菌株类型或自身遗传特性的影响[3]。不同菌株的解磷能力差异显著,相关研究表明溶磷微生物通过产生有机酸或者分泌磷酸酶增加土壤中有效磷含量[12,23],其解磷机理有待进一步研究。
4 结论
从碱蓬根际土壤中筛选出一株高效耐盐解磷菌株C1,依据形态特征和ITS基因序列同源性分析鉴定其为草酸青霉(Penicillium oxalicum),其解磷量可达4397.70mg/L,比目前已筛选到草酸青霉菌的有效磷含量[13,21]高4~25倍,可耐受10%盐浓度,IAA分泌量33.07mg/L,高于已有报道菌株产IAA含量(5~20mg/L)[22],说明菌株C1的耐盐解磷能力较好,且兼具一定的促生作用,可以考虑作为盐碱地改良微生物菌肥开发的重点菌种,为研制微生物菌肥提供优质种质资源,与植物协同修复改良重度盐碱土,可有效提高盐碱地土壤肥力,有更好的应用潜力。

