二代分子测序在软组织肉瘤中的应用价值分析*
张路 刘佳勇 白楚杰 薛瑞峰 李舒 高天 谭智超 王新宇 方志伟 樊征夫
软组织肉瘤(soft tissue sarcomas, STS)是一类起源于间叶组织的少见肿瘤,包括70 多种不同亚型,每年在世界范围内大约有20 万新发病例[1]。虽然STS各组织学亚型的生物学特性不尽相同,但是既往治疗方法却基本一致:扩大切除手术辅以放疗的局部治疗以及蒽环类为基础的化疗,是近年来STS 系统治疗的基石。经过治疗后仍有高达40%的STS 患者发生转移。尽管诸多研究在探索更好的药物及治疗方案,但是已发生转移的STS 患者中位总生存时间(median overall survival,mOS)仅略有改善,约为12~18 个月[2]。
近年来,STS 的个体化治疗逐步被接受,而分子检测技术的发展和靶向药物的进步为STS 的个性化诊断和治疗提供了新的思路。二代基因测序(nextgeneration sequencing,NGS),又称为高通量测序技术,可以分析基因变异、肿瘤突变负荷(tumor mutational burden,TMB)及微卫星不稳定(microsatellite instability,MSI)状态等特征,不仅可以提示与化疗、靶向和免疫治疗的相关信息,还能根据患者基因检测结果寻找匹配的美国食品药品监督管理总局(FDA)批准药物和临床试验药物,从而辅助临床制定治疗方案。
目前大规模的分子检测主要集中在上皮性和血液系统恶性疾病。尽管美国国立综合癌症网络(NCCN)或中国临床肿瘤学会(CSCO)指南针对STS均有相关的分子检测推荐[3-4],但是仅少量肉瘤亚型存在具有治疗意义的基因变异,且大部分证据级别不足。因此,考虑到STS 基因组的复杂性和异质性,拥有足够数量的样本进行研究,对于明确驱动基因及新疗法的研发至关重要。在本研究中,报告了108 例STS 患者的NGS 检测数据,分析了中国人群STS 常见的基因变异,为患者的个体化治疗提供了参考。
1 材料与方法
1.1 病例资料
收集2018年1月至2019年12月北京大学肿瘤医院收治的STS 患者。所有患者的组织标本均经过病理科专家的审核并确诊为STS,且纳入本研究的STS 患者均接受了NGS 检测。
1.2 方法
1.2.1 分子检测方法 应用NGS 技术对与108 例患者组织样本进行高通量测序:提取DNA/RNA 后,将原始测序数据进行单核苷酸变异、移码突变、插入/缺失、拷贝数变异、基因融合等所有基因组变异类型的生物信息学分析,同时对基因变异类型进行筛选和注释,分析检测结果。提供基因检测服务的公司有上海思路迪生物技术有限公司、北京泛生子基因科技有限公司和广州燃石医学检验所有限公司。
1.2.2 观察指标 108 例STS 患者组织学亚型及基因变异概况:包括各组织学亚型例数以及基因变异数≥1 的患者分布情况。
1.2.3 TMB 肿瘤细胞基因组编码区中平均1 Mb(100 万个碱基)范围内所包含的体细胞变异数量(非同义突变、插入/缺失)为基因水平的突变检测。根据TMB 值分为高(≥10 muts/Mb)、中(5~10 muts/Mb)和低(<5 muts/Mb)3 类。
1.2.4 MSI 状态 指与正常组织相比,在肿瘤中某一微卫星由于重复单位的插入或缺失而造成的微卫星长度的任何改变,出现新的微卫星等位基因现象。MSI状态分为3 类:微卫星高度不稳定(MSI-H),低度微卫星不稳定(MSI-L),微卫星稳定(MSS)。本次检测使用NGS 技术结合生物信息学算法,计算该样本在患者样本中的MSI score,其中MSI score≤0.05 为MSS;0.05
1.3 统计学分析
统计存在临床治疗意义的基因变异情况:1)临床指南建议:符合NCCN[3]或CSCO[4]中STS 指南的治疗建议;2)超适应证治疗:超出药品说明书所标明的适应证范围用药。药品的超适应证使用通常有2 种类型:超出美国FDA 批准的适应证,或超出批准的使用人群。将本研究中所有检出的78 个基因名称于FDA 官方数据库进行全瘤种检索,查询其获批药物信息,检索截止日期为2021年3月26日;3)临床试验招募:指存在正在招募中的针对特定变异基因的STS临床试验。利用关键词“Soft tissue sarcomas”和本实验所有检出的78 个基因名称,对PubMed、Clinical Trials 及中国药物临床试验等级与信息共识平台等数据库进行了检索。检索的时间范围为2015~2020年,仅针对状态为“招募中”的临床研究进行筛选。
2 结果
2.1 108 例STS 患者组织学亚型及基因变异概况
本研究共纳入108 例STS 患者,常见的组织学亚型为平滑肌肉瘤19 例,脂肪肉瘤13 例,滑膜肉瘤11 例。比例最高的组织学亚型为纤维肉瘤85.7%(6/7),脂肪肉瘤84.6%(11/13),和原始神经外胚层肿瘤(primitive neuroectodermal tumor,PNET)/Ewing 肉瘤83.3%(5/6),见表1。全组共发现78 种变异基因,基因变异检出频次排名前10 位的基因由高到低分别为TP53 12.3%(22/179)、MDM2 7.3%(13/179)、CDK4 5.6%(10/179)、CDKNB 3.9%(7/179),RB1 3.9%(7/179),ALK 2.8%(5/179),ATRX 2.8%(5/179),MCL1 2.8%(5/179),FGFR1 2.2%(4/179),PIK3CA 2.2%(4/179),见图1。

表1 108 例STS 各组织学亚型基因变异及临床治疗意义概况
2.2 统计存在治疗意义的基因变异情况:
78 种基因变异中,共39 种对患者存在临床治疗指导意义。其中,有3 种符合临床指南建议,包括:ALK、CDK4 和CDK6;有23 种符合超适应证治疗,包括:ALK、ATM、ATRX、BARD1、BRCA、CCND1、CCND2、CCND3 、CDK4 、CDK6 、CDKN2A、EWSR1-ATF1、EWSR1-DDIT3 、EZH2 、FANCA、KIT、MET 、NRAS 、PDGFRA 、PIK3CA 、RET、ROS1 和TSC2;有27 种符合临床试验招募,包括:ALK、ATM、ATRX、BARD1、BRCA、CDK4、CDK6、EPHA2、EWSR1-ATF1 、FGFR1 、FGFR2 、FGFR3、HRAS、IGF1R、KDR、KIT、MDM2、MYC、NBN、NF1、PDGFRA、PTEN、RET、ROS1、TP53、VEGFA和VHL。见表2,图1。

图1 108 例STS 患者NGS 基因变异次数及临床治疗意义
108 例患者中,7 例(6.5%)患者的基因突变符合临床指南建议,受益率最高的组织学亚型为脂肪肉瘤46.2%(6/13);31 例(28.7%)符合超适应证治疗,受益率最高的组织学亚型为恶性外周神经鞘肿瘤66.7%(2/3)和透明细胞肉瘤66.7%(2/3);56 例(51.9%)符合临床试验招募,受益率最高的组织学亚型为纤维肉瘤85.7%(6/7)。62 例(57.4%)符合临床指南建议、超适应证治疗或临床试验招募,受益率最高的组织学亚型为纤维肉瘤85.7%(6/7),见表1,图2。
2.3 TMB
108 例STS 患者的TMB 中位值为2.42(0~60)muts/Mb,其中10 例(9.3%)TMB 值≥10 muts/Mb,24例(22.2%)TMB 值5 ~10 muts/Mb,74 例(68.5%)TMB 值<5 muts/Mb。其中,TMB 值≥10 muts/Mb 发生率前3 位的组织学亚型为上皮样肉瘤33.3%(1/3)、炎性肌纤维母细胞瘤33.3%(1/3)和滑膜肉瘤15.8%(3/19),见表3。
2.4 MSI 状态
89 例患者接受了MSI 状态检测,其中MSI-H 1例(1.1%),组织学亚型为透明细胞肉瘤,MSI=0.133;MSI-L 3 例(3.4%),包括2 例横纹肌肉瘤(MSI=0.091,MSI=0.051)和1 例未确定亚型的软组织肉瘤(MSI=0.067);其余85 例均为MSS。
3 讨论
本研究发现,软组织肉瘤常见的基因变异与既往文献报道基本一致。Lucchesi 等[5]通过NGS 对584例成人STS 患者的基因型进行分析发现,按基因突变的检出频次排序,发生改变最多的20 个基因为TP53、MDM2、CDK4 、RB1 、ATRX 、CDKN2A 、PTEN、NF1、CDKN2B 、KMT2D 、GLI1 、ATM 、TERT、PI3KCA、NOTCH1 、MAP2K4 、ERBB4 、ARID1A、TSC2 和TNFAIP3。不同中心的检测结果存在一定差异,分析原因可能与入选的肉瘤亚型相关。本研究发现TP53 的突变检出频次最高。TP53 突变尤其好发于平滑肌肉瘤、血管肉瘤和多形性脂肪肉瘤等复杂核型的肉瘤,但是在滑膜肉瘤、透明细胞肉瘤及腺泡状软组织肉瘤等具有明确融合型驱动基因的肉瘤中并不常见。其他基因变异部分好发于特定亚型中,并与肿瘤的发生发展及预后密切相关。
2018年纪念斯隆凯特琳癌症中心(MSKCC)使用NGS 技术检测对来自世界各地5 635 例STS 患者进行了回顾性分析,其中在542 例(9.6%)患者的已知和新发现的基因中观察到可疑的胚系缺陷突变。其中16%的患者可以对应到美国FDA 已批准的药物,7%的患者可以对应到临床试验研究阶段的药物。42%的患者符合临床试验招募条件[6]。本研究中57.4%的患者符合临床指南建议、超适应证治疗或临床试验招募,高于文献报道。分析原因可能是因为本研究数据大多来源于近几年,随着基础研究的深入和临床试验的快速跟进,患者实际获益率更高。但本研究中仅有6.5%的患者基因突变符合临床指南建议而获得了指导性治疗,此数值低于文献报道。其中,使用帕博西尼治疗CDK4 或CDK6 基因突变的脂肪肉瘤患者属于指南建议,但是其他瘤种在CDK4 或CDK6基因突变的情况下却属于超适应证用药。这可能也是本研究中符合临床指南建议获益较低的原因。
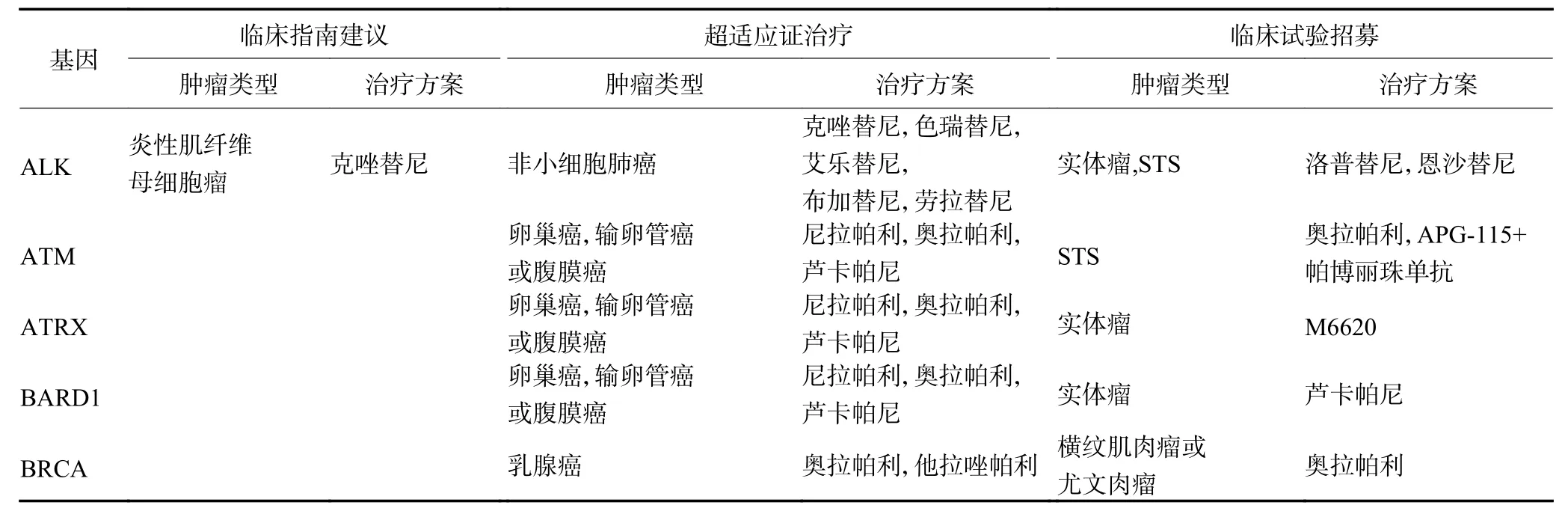
表2 存在临床治疗意义的基因变异概况

表2 存在临床治疗意义的基因变异概况 (续表2)

表2 存在临床治疗意义的基因变异概况 (续表2)

图2 存在临床治疗意义的基因变异在62 例STS 患者中的分布情况
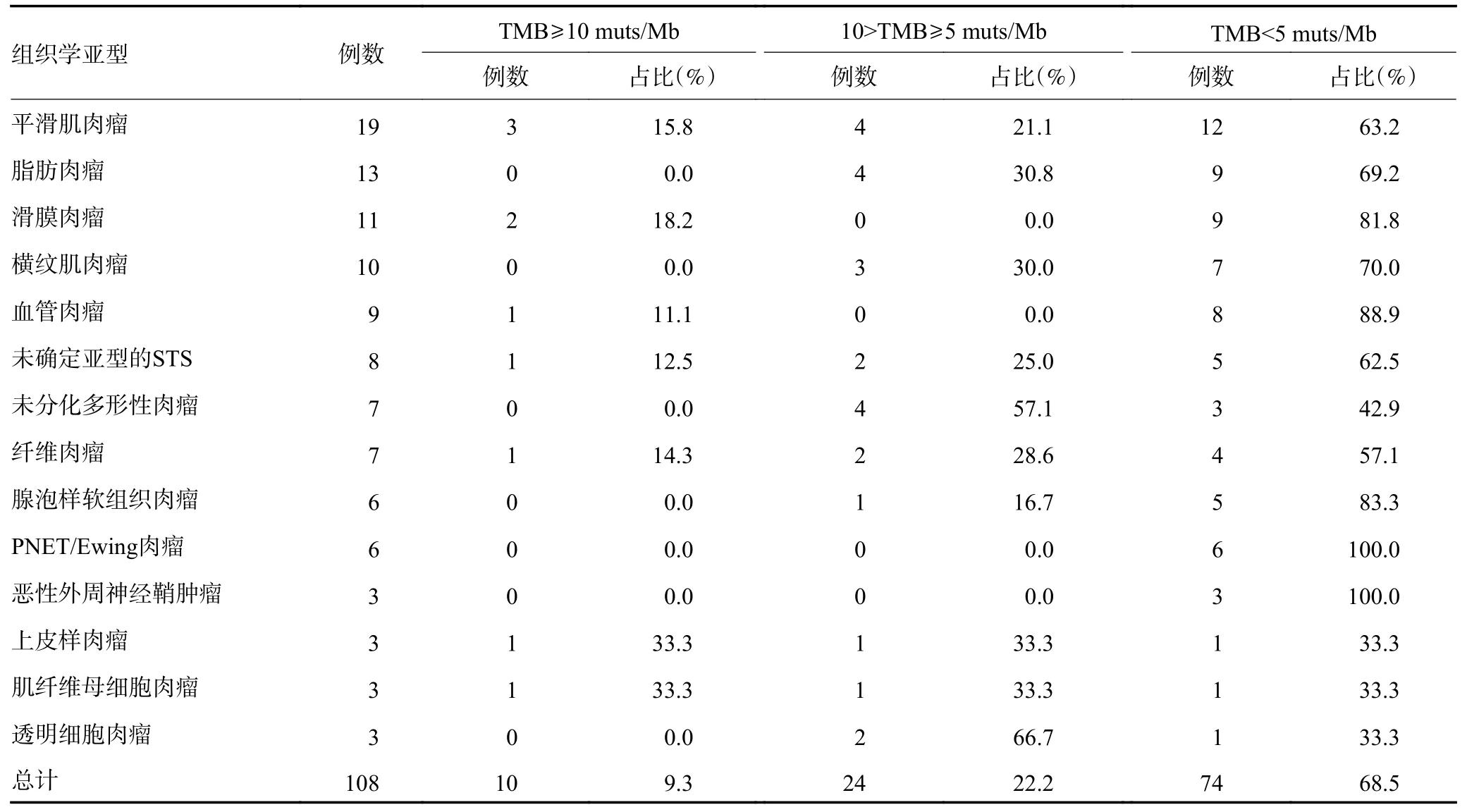
表3 108 例STS 患者各亚型TMB 值
超适应证治疗指超出药品的使用说明书所表明的适应证、给药路径和剂量。有研究提示[7],美国大约20%超适应证使用在规范的临床研究之后,可以推动临床治疗方案。如帕唑帕尼作为多靶点小分子受体酪氨酸激酶抑制剂,早期的适应证为晚期肾细胞癌患者,被美国FDA 批准为首个治疗晚期软组织肉瘤(非脂肪肉瘤)的靶向药物[8]。本研究发现有28.7%患者通过NGS 检测后符合药物超适应证治疗,其中受益率最高的组织学亚型为恶性外周神经鞘瘤和透明细胞肉瘤。目前,晚期恶性外周神经鞘瘤一线治疗方案仍是蒽环类为主的化疗,而透明细胞肉瘤无明确有效的药物。二者除了广谱的血管生成抑制剂,尚无明确专门针对此组织学亚型的靶向药物。因此,建议这类亚型患者进行NGS 检测,可能获取更多的临床治疗提示。值得关注的是,医生在超适应证用药前应该与患者充分沟通药物的有效性、安全性、存在的风险和没有适应证等情况,获得患者的书面知情同意。
临床试验方面,受试者的获益是指研究对受试者具有诊断、治疗或预防的直接益处。本研究中有51.9%的患者符合临床试验招募,受益率最高的组织学亚型为纤维肉瘤。虽然现阶段针对STS 的指南并没有明确推荐多线治疗失败的患者参加临床试验,但是很多其它瘤种指南都肯定了临床试验的治疗意义,如黑色素瘤临床指南中建议Ⅱ期以上的恶性黑色素瘤患者可以选择参加临床试验作为辅助治疗策略[9]。需要提及的是,临床试验存在一定风险,患者有可能受益,但也有可能受损,患者本身也要承受药物研究失败的风险。
伴随着DNA 测序技术的发展,TMB 检测已成为一种常见的技术,TMB 作为生物标志物对免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)疗效预测的作用在多项临床研究中得到证实。TMB 值越高,患者接受ICIs 治疗后的整体生存率越高[10]。但是,不同类型恶性肿瘤的TMB 值水平差别很大,而且对于高TMB 的定义并无统一的阈值。Chalmers 等[11]通过100 000 个人类基因组描述了TMB 在不同恶性肿瘤病例中的分布,结果发现STS 的TMB 水平在所有恶性肿瘤中处于较低水平,中位TMB 为2.5 muts/Mb,仅高于胰腺癌。本次研究发现全组108 例STS 患者的TMB 值为2.42(0~60)muts/Mb,这与既往报道结果一致。但是针对STS 目前尚无高级别的研究证据表明免疫治疗的治疗效果与TMB 水平相关[12],而已知的对ICIs 反应率较高的腺泡状软组织肉瘤反而是TMB 最低的亚型之一。因此,对于晚期STS 是否接受ICIs 治疗,TMB 值仅能做为参考指标之一,需要结合肉瘤亚型及PD-L1 表达水平等其他因素综合评估。
MSI-H 癌细胞相比于MSS 正常癌细胞更易累积突变,产生大量异源抗原,可能更容易被免疫T 细胞识别。近年来,随着免疫检查点抑制剂的使用,发现MSI-H 的多种实体瘤对程序性死亡受体-1(programmed death-1,PD-1)及其配体(PD-L1)单抗效果比较好。帕博丽珠单抗获美国FDA 批准用于治疗MSI-H/错配修复缺陷(different mismatch repair,dMMR)的实体瘤患者,是美国FDA 首次不依照癌种而是依照生物标志物核批的抗肿瘤疗法[13]。本研究发现,MSI-H 发生率很低,仅为1.1%,与国外文献报道结果相似(0.78%)[14]。目前,暂无大宗的病例报道MSI 状态与PD-1 单抗治疗STS 疗效的关系。因此,MSI 检测的意义还需进一步研究证实。
本研究存在一定局限性。首先,由于STS 的亚型众多,部分罕见肉瘤亚型的样本量相对比较小,因此很难统计出相对特异的高频变异,需要通过综合多中心、多平台的检测数据才可能发现一定的规律。其次,部分STS 存在特征性的染色体易位,例如滑膜肉瘤的SS18-SSX,Ewing 肉瘤的EWSR1-FLI1、透明细胞肉瘤的EWSR1-ATF1 等,这些变异通过常规的DNA 高通量测序一般都很难被发现。为了解决这一问题,部分检测平台已经添加了针对这些融合基因的RNA 转录组测序技术(RNA-seq),可敏感地发现肿瘤组织中存在的融合基因,从而为STS 的诊断与鉴别诊断提供重要信息。但是,由于针对这些融合基因目前并没有特异性的靶向药物,RNA-seq 技术在治疗方面的价值还有待商榷。其次,由于统计数据有限,本研究发现的这些基因变异位点是错义突变还是无义突变未予列出。最后,本研究列出的基因变异未按分子通路形式予以归纳,其相关性仍需进一步探究。既往文献报道STS 患者中TP53-MDM2/MDM4-CDKN2A 通路、CDKN2A/CDK4/RB1 通路以及RAS/NF1/PTEN/PI3K 通路变异频率最高,这些STS 患者存在潜在用药靶点[15]。
综上所述,虽然通过NGS 检测仅能在部分STS患者中找到有临床治疗意义的基因变异靶点,但是由于晚期STS 患者的治疗手段非常有限,NGS 检测仍然具有一定的临床应用价值。随着医学研究的进步和NGS 检测平台的完善,将来有可能使更多的患者获益。

