部分脾动脉栓塞术对肝功能和肝硬化的影响
张雪平, 潘文秋, 赵 卫, 翟 越, 陆 孜, 马元锦, 谭 斌, 胡继红
研究表明病理性脾脏参与肝纤维化进展[1]。有学者发现外科脾切除可缓解肝纤维化[2]。但脾切除创伤大、风险大、费用高,术后并发症多,如门静脉血栓形成、免疫功能低下所致暴发性感染等。近年临床上广泛应用部分脾动脉栓塞术(partial splenic arterial embolization,PSE)治疗脾功能亢进,其创伤小、安全,可达到外科脾切除相似效果[3]。本研究收集36例肝炎后肝硬化脾功能亢进患者,观察其接受PSE治疗后肝纤维化和肝功能变化。现报道如下。
1 材料与方法
1.1 病例资料
收集2018年10月至2019年12月在昆明医科大学第一附属医院因肝硬化伴脾功能亢进接受PSE术治疗患者50例。入组标准:①符合脾功能亢进诊断标准[4];②肝功能Child-Pugh分级A、B级;③栓塞体积为50%~70%。排除标准:①Child-Pugh分级C级;②骨髓穿刺检查结果提示骨髓抑制;③伴有恶性肿瘤;④心脏或肾功能衰竭。共纳入符合入组标准患者36例(实验组)。其中男20例,女16例,中位年龄43.6岁;乙型肝炎21例,丙型肝炎9例,乙醇性肝炎6例;肝功能Child-Pugh分级A级19例,B级17例。选择30例经检查明确无肝纤维化健康人作为对照组。
1.2 PSE术
实验组患者术前口服庆大霉素(8万U/次,3次/d)、诺氟沙星(0.3 g/次,2次/d)3 d。术前30 min预防性静脉滴注抗菌药物,术中脾动脉内灌注抗菌药物。采用Seldinger技术穿刺股动脉,导丝导引下将5 F Yashiro导管(日本Terumo公司)送至脾动脉主干近端作造影(注意避开重要血管分支如胰背动脉、胃短动脉等);8Spheres聚乙烯醇(PVA)微球(粒径500~700 μm)与碘佛醇(苏州恒瑞迦俐生生物医药科技公司)配制成微球混悬液,采用量化栓塞法[5],以低压流控技术将微球混悬液注入脾内动脉,栓塞面积控制在50%~70%。术后常规抗感染、保肝、护胃、止痛等对症支持处理。
1.3 酶联免疫吸附试验检测
实验组患者于术前、术后7 d、术后1个月、术后3个月分别抽取凌晨空腹血约5 mL,对照组抽取凌晨空腹血约5 mL。静置30 min后,离心处理(3 000 r/min,15 min),取上清液血清标本于小样管内,置于-20℃冰箱备用。按照酶联免疫吸附试验(ELISA)试剂盒(武汉基因美生物科技公司)说明书操作步骤(标准品稀释,加样,温育,配液,洗涤,加酶,温育,洗涤,显色,终止,测定)[6],检测血小板衍生生长因子(PDGF)、转化生长因子(TGF)-β1,肝纤维化4项指标透明质酸(HA)、三型前胶原(PCⅢ)、层粘连蛋白(LN)、四型胶原(CⅣ)。
1.4 肝脏超声影像和瞬时弹性成像检测
采用FibroScan 502 Touch肝病诊断仪(法国Echosens公司)检测实验组患者肝脏硬度值(LSM)变化:仰卧位,暴露胸部,双手抱头,选取右腋前线至腋中线7~9肋间作为检测部位,操作者保持探头与检测部位垂直和固定,同时避开脉管系统肝实质,嘱患者保持平静呼吸,有效检测至少10次,取中位数为最终测定结果,以F值(kPa)表示。上述操作均由同一位经验丰富医师完成。
1.5 肝功能和血常规检测
术前、术后7 d、术后1个月、术后3个月分别抽取实验组患者外周血,检测丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TBil)、凝血酶原时间(PT)、白细胞(WBC)计数、血小板(PLT)计数。
1.6 统计学方法
采用SPSS 25.0软件对数据进行处理,计数资料以均数±标准差(±s)表示,术前、术后数据用配对样本t检验,相关性检测用Pearson检验,P<0.05为差异具有统计学意义。
2 结果
外周血清PDGF、TGF-β1检测显示,对照组平均值分别为(98.26±10.12)ng/L、(180.36±12.38)ng/L;实验组PSE术前PDGF、TGF-β1明显高于对照组,术后PDGF呈下降趋势,术后7 d、1个月、3个月与术前差异均有统计学意义(P<0.05),TGF-β1术后7 d、1个月、3个月呈下降趋势,但与术前差异均无统计学意义(P>0.05),见表1。
表1 实验组PSE术前后PDGF、TGF-β1变化ng/L,±s

表1 实验组PSE术前后PDGF、TGF-β1变化ng/L,±s
*与术前相比,P<0.05
?
肝纤维化4项指标检测显示,对照组HA、PCⅢ、LN、CⅣ平均值分别为(119.65±9.35)ng/L、(4.58±1.20)μg/L、(107.38±13.67)μg/L、(7.45±1.18)μg/L。实验组术前HA、PCⅢ、LN、CⅣ明显高于对照组,术后7 d、1个月、3个月较术前均明显下降,术后1个月降至最低,术后3个月较术后1个月出现升高;LSM术后7 d、1个月、3个月出现下降,但术后1周与术前差异无统计学意义,术后3个月较术后1个月出现升高,见表2。
表2 实验组PSE术前后肝纤维化4项指标和LSM变化±s
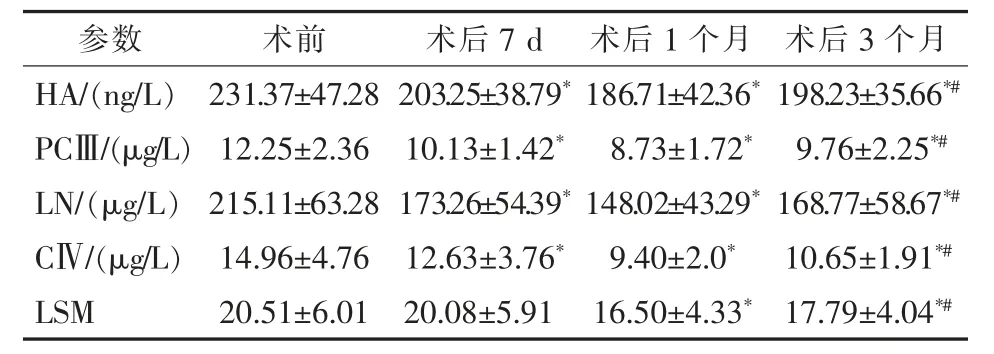
表2 实验组PSE术前后肝纤维化4项指标和LSM变化±s
*与术前相比,P<0.05;#与术后1个月相比,P>0.05
?
血常规指标检测显示,实验组术后7 d WBC迅速升至最高后开始下降,术后3个月后降至正常值以下;术后PLT迅速升高,术后7 d至正常范围,术后1个月达峰值,随后缓慢下降,见表3。
表3 实验组PSE术前后血常规指标变化 ×109/L,

表3 实验组PSE术前后血常规指标变化 ×109/L,
**与术前相比,P<0.05;#与术后1个月相比,P<0.05
?
Pearson相关性分析显示,实验组患者术前TGFβ1、PDGF与PLT计数呈负相关(r=-0.672,P<0.05;r=-0.542,P<0.05),即PLT计 数 越 低,TGF-β1、PDGF水平水平越高。肝功能检测显示,实验组术后3 d、7 d、1个月、3个月ALT与术前相比变化不明显(P>0.05);术后3 d、7 d AST较术前明显升高(P<0.05),术后7 d较术后3 d有所下降(P<0.05),术后1个月恢复至术前水平(P<0.05),术后3个月与术前相比无明显变化(P>0.05);术后3 d、7 d PT、TBil明显升高,术后7 d较术后3 d有所下降,术后1个月恢复至术前水平,术后3个月明显下降,见表4。
表4 实验组PSE术前后肝功能变化 ±s
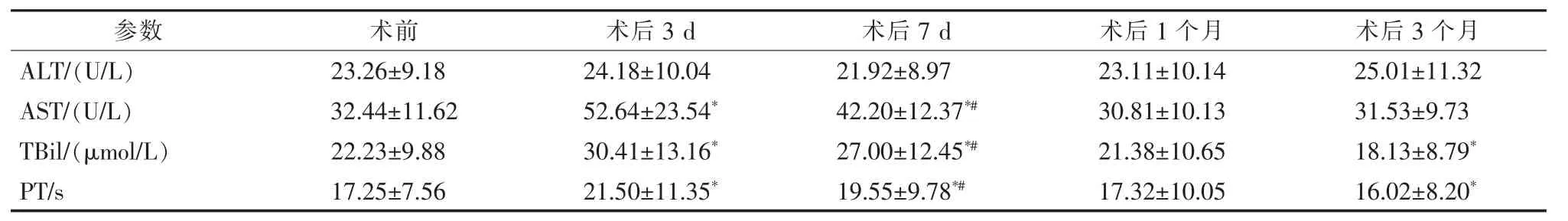
表4 实验组PSE术前后肝功能变化 ±s
*与术前相比,P<0.05;#与术后3 d相比,P<0.05
?
3 讨论
3.1 脾功能亢进与肝纤维化
既往研究发现ALT与肝纤维化存在一定的联系[7]。Takahashi等[7]在实验中分别给予重度免疫缺陷小鼠四氯化碳(CCl4)和磷酸缓冲液(PBS组),人ALT(hPLT组),比较两组肝细胞生长因子(HGF)、基质金属蛋白酶(MMP)-9和TGF-β浓度,结果发现人ALT抑制小鼠肝纤维化,肝脏中HGF浓度升高,抑制肝星状细胞(HSC)活化,增强MMP功能,抑制肝细胞凋亡。ALT细胞质内存在α颗粒、致密颗粒和溶酶体颗粒等3种分泌颗粒,均含有PDGF、TGF-β1、三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、5-羟色胺(5-HT)[8-9]。其中PDGF、TGF-β1被认为是促进肝纤维化进展非常重要的因子。本研究对肝炎后肝硬化脾功能亢进患者PSE术前ALT和PDGF、TGF-β1进行相关性分析,发现ALT水平与PDGF、TGF-β1呈负相关(r=-0.672,P<0.05;r=-0.542,P<0.05),即ALT水平越低,相应PDGF、TGF-β1值越高,术后7 d、1个月、3个月ALT水平均较术前明显升高(P<0.05);术后1个月、3个月PDGF较术前明显下降,TGF-β1下降不明显考虑与样本量小和栓塞体积不足有关,但总体呈下降趋势;术后7 d、1个月、3个月LSM和肝纤维化4项指标水平较术前下降。综上推测,由于脾脏和肝脏解剖结构相连,脾功能亢进时ALT在脾脏大量破坏,ALT中分泌颗粒释放各种活性物质如PDGF、TGF-β1等,促进了肝纤维化发生和发展。PSE术可使ALT水平得以提升,其释放的活性物质减少,肝纤维化得到改善。
3.2 PSE术与肝纤维化
本研究发现PSE术前肝纤维化4项指标和LSM明显高于正常人群,术后7 d、1个月、3个月HA、PCⅢ、LN、CⅣ及肝脏弹性测量值均出现下降,术后1个月降至最低,而术后3个月与之相比轻度升高。分析原因可能是:①PSE术后ALT提升,ALT破坏减少,源于ALT促纤维化物质PDGF、TGF-β1下降,肝脏HSC激活和增殖减少;②术后肝功能改善,肝纤维化得到一定程度缓解;③术后3个月肝纤维化4项指标升高;④术后肝总动脉获得血液增多,肝脏灌注增加,门静脉血流和压力下降,肝脏淤血得到一定缓解[10]。
PDGF被认为是目前作用最强的促有丝分裂原,可促进HSC增殖、分化。PDGF主要促纤维化机制[11]:①促进HSC增殖分化;②促进肌成纤维细胞(myofibroblast,MF)过多分泌Ⅰ、Ⅲ型胶原;③上调基质金属蛋白酶组织抑制剂(TIMP)。PDGF促进HSC增殖与分化依赖于多条信号转导通路。本研究术后7 d、1个月、3个月外周血中PDGF明显下降,而术后3个月与术后1个月相比出现升高,考虑与脾功能亢进复发有关。因此,PSE术有利于延缓肝硬化进展。TGF-β1主要来源ALT和HSC,是目前已知促纤维化作用最强的细胞因子。其促肝纤维化作用机制[12-13]:①促进HSC转变为MF,同时伴细胞外基质(ECM)大量合成;②通过TGF-β1/Smad信号转导通路促使ECM基因激活转录,增加ECM在肝内沉积;③通过降低MMP活性及增强TIMP,促进ECM在损伤肝组织内沉积。Morinaga等[14]研究显示,小鼠脾切除术后门静脉血中TGF-β1明显下降,且肝再生增强和肝功能指标ALT、TBil改善;认为TGF-β1下降可改善小鼠肝纤维化。本研究中PSE术后7 d、1个月、3个月TGF-β1较术前变化不明显,但总体呈现下降的趋势,考虑可能与样本量不足及栓塞面积不足有关。
3.3 PSE术与肝功能
本研究中PSE术后3 d、7 d AST、TBil、PT均较术前明显升高,与既往研究结果[15]基本一致,表明PSE术后可出现一过性肝功能受损。可能原因:PSE术后脾脏破坏血细胞能力下降,导致多余红细胞得以在肝脏中破坏,引起TBil升高,以间接胆红素值升高为主要表现[16]。术后1个月AST、PT、TBil均恢复至术前水平,术后3个月PT、TBil均较术前明显下降(P<0.05),AST变化不明显(P>0.05),肝功能得到一定改善,这表明PSE术可改善患者肝功能,与既往研究结论相符。PSE术后患者肝功能改善除了与本组PSE术后肝纤维化改善有关,还可能有下述原因:①有研究显示肝脏再生过程中ALT发挥了重要作用,PSE术后患者ALT计数上升,肝再生功能增强,同时ALT破坏减少,促纤维化因子减少[17];②PSE术后脾脏盗取腹腔干血液减少,肝动脉和肠系膜上动脉血流随之增多,肝细胞氧供和营养均得到改善。
本研究不足之处:脾脏栓塞面积50%~70%,然而不同脾脏栓塞体积可能对疗效产生影响。其他混杂因素如乙型肝炎肝硬化患者全程抗病毒治疗、ALT外细胞同样产生TGF-β1和PDGF,可能也会影响研究结果。本研究近期疗效可,有待进一步远期随访观察,同时应加大样本进行分析。
综上,PSE术后患者血清PDGF、TGF-β1、LSM、肝纤维化4项指标及肝功能均有不同程度改善,提示PSE可延缓肝硬化,改善肝功能。

