布-加综合征患者尿碘指标临床分析
李 琳, 顾玉明, 祖茂衡, 徐 浩
随着介入诊疗技术日趋普及和对布-加综合征(Budd-Chiari syndrome,BCS)认知不断提高[1-2],BCS在黄河、淮河流域,包括江苏、安徽、山东及河南等省已成为临床较为常见的疾病[3]。国内流行病学研究发现,这些地区是水源性高碘地区,居民常年饮用浅层地下水造成碘摄入量过高。放射性核素示踪研究表明摄入的碘剂在体内有广泛分布,可分布至甲状腺组织和全身性组织如视网膜、肝脏、血液等[4]。研究表明BCS与水碘间存在相关性[5]。本研究旨在通过分析BCS患者尿碘水平,探索高碘与BCS发生相关性。
1 材料与方法
1.1 患者选择
选择2018年期间收治的BCS患者115例作为实验组,均经彩色多普勒超声、螺旋CT/MRI和血管造影确诊,其中男65例(56.5%),平均年龄47.7(13~68)岁,女50例(43.5%),平均年龄50.7(18~78)岁;选取年龄、性别与实验组相近的健康体检者120例作为对照组,其中男63例(52.5%),平均年龄40.3(18~64)岁,女57例(47.5%),平均年龄42.1(16~67)岁。两组性别和年龄差异无统计学意义(P>0.05)。排除有血栓史,消化、循环系统疾病史,手术史人群。实验组患者入组前1个月均未接受治疗。
1.2 样品采集和尿碘检测
收集实验组患者入院第1日晨尿(尿样采集前1 d未进食高碘食物及服用含碘药物,排除检查、手术等摄入碘对比剂对结果的影响),同时收集对照组健康者晨尿。采用碘元素测定试剂盒(化学法)和碘元素检测仪进行尿碘检测。采用氧化还原原理,在样品中碘元素作用下发生催化反应,专用指示剂指示终点;根据碘含量不同、反应时间不同,用计时器计时,以回归方式计算出碘含量。
1.3 统计学处理
采用微软Excel软件建立数据库,SPSS 18.0软件进行数据处理。计量资料以均数±标准差(±s)描述,组间比较用t检验,多组间比较用单因素方差分析;计数资料用χ2检验。P<0.05表示差异有统计学意义。
2 结果
实验组患者年龄分布见表1。实验组共收集患者晨尿115份(男65份,女50份),尿碘检测显示平均值为(456.9±257.4)μg/L,尿碘中位值(median of urinary iodine,MUI)为225.8 μg/L,处于碘量适中水平,尿碘水平异常检出率达到40.9%;实验组尿碘水平与对照组相比显著升高(P=0.012),实验组尿碘水平在性别、年龄间差异均无统计学意义(P>0.05)(表2)。两组尿碘频数分布见表3。

表1 实验组患者年龄分布情况
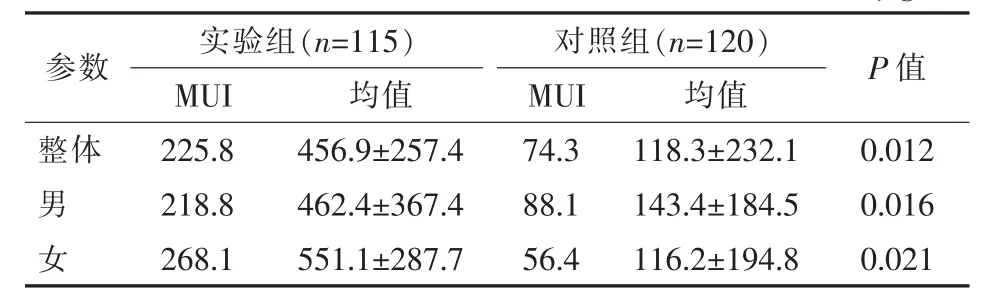
表2 实验组和对照组尿碘水平 μg/L
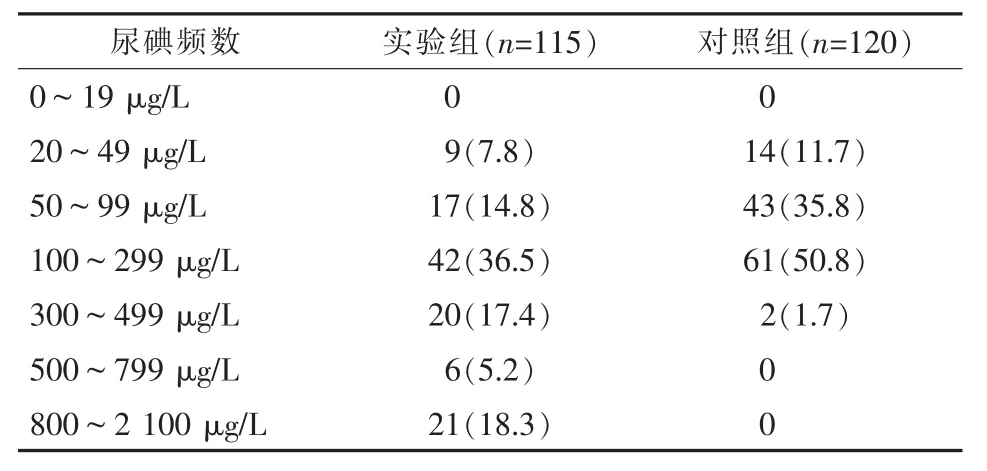
表3 实验组和对照组尿碘频数分布 n(%)
根据2017年发布的BCS亚型分型专家共识,将实验组BCS患者分为肝静脉(HV)型、下腔静脉(IVC)型和混合型,结果显示IVC型、HV型、混合型患者尿碘水平分别与对照组相比,差异均有统计学意义(P=0.031);实验组IVC型分别与HV型、混合型尿碘水平相比,差异均有统计学意义(P<0.05),HV型与混合型间差异无统计学意义(P>0.05),见表4。基于病理解剖,将实验组BCS患者分为隔膜型、血栓型和管腔狭窄型,结果显示隔膜型、血栓型、管腔狭窄型患者尿碘水平分别与对照组相比,差异均有统计学意义(P=0.029);实验组隔膜型分别与血栓型、管腔型尿碘水平相比,差异均有统计学意义(P<0.05),且隔膜型尿碘水平最高,见表5。

表4 实验组BCS亚型分型尿碘水平与对照组比较μg/L

表5 实验组基于病理解剖尿碘水平与对照组比较μg/L
3 讨论
由于人体大部分碘从尿排出,尿碘在碘平衡状态下近似于碘摄入量,因此尿碘排泄量可以反映饮食碘摄入量,尿碘水平是综合评估人群碘营养状况的良好指标。尿碘浓度评价采用世界卫生组织推荐的人群碘营养状况指标——MUI<20 μg/L为碘严重缺乏,20~49 μg/L为中等缺乏,50~99 μg/L为轻微缺乏,100~299 μg/L为适中,≥300 μg/L为过量[6-7]。本研究通过对对照组健康体检者统计分析发现,尿碘平均值为118.3 μg/L,表明碘营养水平达标。
BCS病因复杂、病理改变多样,是一困扰世界医学的难题。近年随着相关基础学科取得的成就,其病因研究也有一些突破,出现了血栓形成学说、机械性损伤学说、感染学说等。欧美国家BCS患者多见于HV型,以凝血功能异常引起的继发性血栓为主;我国BCS患者凝血功能尚未发现明显异常,以HV开口以上IVC膜性闭塞所致原发性BCS(IVC膜性闭塞型)最为常见[8-11],其病理学基础是纤维结缔组织隔膜阻塞、血栓形成及其继发改变。国内流行病学研究表明BCS与水碘间存在相关性[5]。本研究期望通过分析不同亚型BCS患者尿碘水平,探索高碘与BCS发生相关性。
国内对局部地区人群研究显示,BCS患者发病区域水碘含量较其他区域高,饮食中高碘可引起血浆和组织中碘浓度升高。国外研究报道称长期高碘饮食引起小鼠脑组织中超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活力降低、抗氧化能力丧失,导致自由基损伤,影响脑组织、血液、甲状腺及肝脏的抗氧化能力。国内研究发现碘离子刺激体外培养的血管内皮细胞,不同碘离子浓度对血管内皮细胞增殖具有双向调节作用[12-13]。此外,碘可刺激B细胞产生免疫球蛋白,诱发和加重自身免疫性甲状腺;可促进转化生长因子(TGF)-β mRNA和蛋白表达[14-16]。本研究发现,BCS患者尿碘含量明显超过国家流行病学普查的含量,男女间和不同年龄段BCS患者尿碘含量并无明显差异,说明碘在机体挥发作用与性别和年龄无关。
本研究发现BCS患者尿碘高于普通人群,且IVC型患者尿碘高于HV型和混合型患者,隔膜型患者尿碘高于血栓型和管腔狭窄型患者,表明IVC型和隔膜型BCS患者体内尿碘含量最高。这与我国常见BCS患者类型下腔静脉膜性阻塞型(MOVC)相吻合。MOVC典型特征为下腔静脉隔膜存在,病理分析显示该隔膜表面为内皮细胞,下层为疏松的纤维结缔组织,最下层是致密的结缔组织和弹性纤维[17]。IVC是体内最大的静脉干,双侧髂静脉、肾静脉等各种静脉丛于下腔静脉汇合。本研究前期通过建立MOVC三维模型分析IVC狭窄部位血流动力学参数变化,发现IVC狭窄部位因横截面减小,血流速度增加、切应力较高、壁面切应力自远心端、狭窄部位至近心端逐渐减小,造成了上、下游区域血流快、壁面切应力增大,汇合开口处的血流切应力的改变可能产生机械损伤,导致开口处血管壁损伤[18]。IVC造影和血管成像也证实肝后段IVC在入心房这一段有自后右转向前左的生理弯曲存在,血流冲刷也会加重血管壁损伤,暴露出内皮下层的血管内皮细胞、成纤维细胞。文献报道高碘因子可提高成纤维细胞生长因子受体(FGFR)2蛋白表达,促进成纤维细胞增殖[19],而BCS患者体内的高碘因素诱发损伤处血管内皮细胞、成纤维细胞增殖以及血管内皮细胞向管腔内迁移,局部炎症和局部细胞增生同时血液生理生化环境改变的多重作用,形成隔膜样组织[20]。
本研究发现IVC隔膜型BCS患者尿碘高于其他类型患者,符合前期的隔膜形成学说,人体高碘环境与隔膜形成存在相关性。由于不同类型BCS发病机制不同、早期诊断困难,多数患者就诊时肝功能已受损严重。因此,积极寻找BCS可能存在的相关致病原因,早期诊断、尽早治疗,可避免肝功能进一步损害,获得长期生存。
本研究与之前研究所示血碘在BCS分型中无差异有所不同[21],原因可能在于碘在不同介质、不同条件下具有多种形态,同时血液成分对血管的直接影响使得静脉血液样品检测与机体排泄的尿液样品有所出入[22]。因此,正确处理待测样品及合理选择介质体系,是准确测定全碘含量的关键。

