西安BC、PM2.5与气温协同对心脑血管疾病死亡的影响
欧奕含,张小玲,3*,张 莹,康 平
西安BC、PM2.5与气温协同对心脑血管疾病死亡的影响
欧奕含1,2,张小玲1,2,3*,张 莹1,2,康 平1,2
(1.成都信息工程大学大气科学学院,四川 成都 610225;2.高原大气与环境四川省重点实验室,四川 成都 610225;3.成都平原城市气象与环境四川省野外科学观测研究站,四川 成都 610225)
利用西安市2014~2015年BC、PM2.5和气温及心脑血管疾病每日死亡人数等资料,基于时间序列的广义相加模型中的主效应模型、非参数二元响应模型和温度分层模型对其进行研究.结果表明,BC、PM2.5对心脑血管疾病死亡人数的影响存在滞后效应,最佳滞后时间下,BC、PM2.5浓度每增加1个IQR(BC:5.31µg/m3,PM2.5:40.30µg/m3),心脑血管疾病每日死亡人数ER(95%CI)分别为3.53%(95%CI:1.86,5.23)、2.01%(95%CI:1.06,2.97).气温与心脑血管疾病每日死亡人数的暴露反应关系呈“V”型分布特征,最适温度为26℃.低温和高污染物浓度对心脑血管疾病的影响存在协同放大效应,当气温低于26℃时,BC对人群健康风险比PM2.5更大.对于心脑血管疾病而言,不同人群的易感程度不同,女性群体对BC、PM2.5暴露更为敏感.当BC、PM2.5同时纳入其它一种或几种气态污染物时,对ER值无较大影响.BC仅占PM2.5浓度的一小部分,但健康影响不容忽视,BC可作为评估大气污染物健康风险的重要空气质量指标.
黑碳;PM2.5;气温;协同效应;心脑血管系统疾病;超额死亡风险
西安市属于西北地区的典型工业城市和商贸交通中心.随着城市化进程的加快,汽车尾气、工业燃煤等污染物排放增加,以细颗粒物(PM2.5)为主要特征的区域持续性大气复合污染频发,致使西安市大气污染问题越发严峻[1-4].空气污染日益影响居民健康,已经备受公众关注[5].
现有的流行病和毒理学研究指出,颗粒物污染的人群不良健康效应最为显著,且粒径越小引起的不良效应越强,相对于可吸入颗粒物(PM10),PM2.5粒径小、比表面积大,易于富集空气中的细菌、病毒、有机物等有毒有害物质,对健康产生的威胁大,更易诱发呼吸系统、心脑血管系统等疾病[6-12].
黑碳(BC)是PM2.5的重要组分,由生物质或化石燃料不完全燃烧产生,它具有吸光性强易扩散的特性,其空气动力学直径主要分布在0.01~1.0µm的超细粒子区,高浓度的BC气溶胶会加重雾霾严重程度,增加空气污染的复杂性[13].大气中BC以链条状、球体形态而聚合在一起,因其不规则的物理结构会大大吸附空气中其他致癌物质,从而影响人体健康状况,国际癌症机构已经将BC归类为 2B 类致癌物质[14].BC会严重地影响人体健康,引起病症的病理机制与PM2.5相同,它直接进入人体肺部的深处并进入肺泡[15],伴随血液循环到达人体全身,对人体心脑血管系统、神经系统等人体系统产生不利影响.一项对BC与日死亡率的时间序列研究的Meta分析[16]表明,BC与心肺死亡率之间呈显著的正相关关系,该结果在其他几项研究中得到证实[17-18].
流行病学研究发现,BC的健康影响可能与PM2.5有所不同,某些方面可能略强于PM2.5[19-23].世界卫生组织评估黑碳的健康效应报告中指出,BC浓度每增加1µg/m3引起的心脑血管疾病死亡率增加1.77%,PM2.5浓度每增加1µg/m3引起的心脑血管疾病死亡率增加0.19%.我国对BC与健康的影响研究起步较晚,研究较少,主要集中在北京[24-27]、上海[13-28],所以相关研究还需深入.
与污染物相比,不良气象条件也是影响人群健康的危险因素.大量研究表明,气温是影响人体健康最重要的因素之一[29-32],气温过高或过低均易诱发相关疾病.气温和颗粒物都与疾病有关,但以往研究对所谓的排除混杂因素的数学处理具有一定的片面性,当探究气温对疾病的影响时,往往把污染物作为混杂因子排除;而在研究污染物对疾病的影响时,把气温作为混杂因素来考虑[33].
国外对污染物与气温的交互作用影响做了相关研究,发现温度会改变颗粒物对死亡率的影响程度[34],例如高温条件能使PM10带来更多不利的健康影响[35].一项气温与O3对美国60个东部城市的死亡影响研究中也发现高温能增加O3的死亡风险[36].国内学者[37-38]研究发现高温条件能增加颗粒物的心血管疾病、呼吸系统风险,高浓度颗粒物在该种气温条件下会对人群健康的负面影响产生协同加强效应[26,39].与国外相比,国内在该方面的研究还比较少.
基于此,本研究采用近年来国际上通用的危险度评价方法—基于时间序列的广义相加模型(GAMs),以心脑血管疾病死亡数据为暴露效应指标,选取人口密度大、颗粒物污染重的西安市作为代表城市,探讨该市气温和BC、PM2.5浓度和气温对人群对心脑血管疾病死亡的影响,以及两者协同作用的影响,为西安市大气污染防治措施和政策制定提供科学参考.
1 资料与方法
1.1 资料来源
所用疾病资料:2014年1月1日~2015年12月31日心脑血管疾病死亡资料来自于中国疾病预防控制中心(CDC)全国疾病监测死因监测数据集.根据国际疾病分类标准第10版本(ICD-10)对死因进行分类,整理得到的心脑血管疾病资料(ICD-10 编码:I00-I99)共45544例,其中男性24497l例,女性21047例.
大气环境监测资料:本研究所用同期的日均污染数据包括BC、PM2.5、SO2、NO2共4种.除BC外其他3种污染物数据来源于全国城市空气质量实时发布平台(http://113.108.142.147:20035/),按照《环境空气质量标准》(GB 3095—2012)[40]计算日平均浓度(去除清洁对照站),同时为了保证数据的可靠性,将由于不可抗(停电、仪器校准)因素出现的缺测情况剔除;BC数据来源于中国气象局西安泾河观测站点(108°58¢N,34°26¢E),该站为国家级大气成分观测站,观测仪器为美国MAGEE公司的7波段Aethalometer黑碳仪器(AE31),利用黑碳对光的吸收特性进行测量,数据采集频率均为5min,选择波长为880nm的BC浓度,数据经过质量控制后处理成1h平均值和日平均值.
气象资料:本研究所用到的气象资料来源于中国气象局西安泾河站,该站为基本气象站,是西安市的气象代表站,由国家气象信息中心提供,包括日均气温、相对湿度、风速、气压.所有获取的数据均经过国家气象信息中心严格的质量控制和检查.
1.2 研究方法
1.2.1 半参数广义相加模型的建立 采用SPSS19.0软件进行统计描述,采用R4.3.2统计分析方法软件中的“mgcv”包和“dlnm”程序包进行半参数广义相加模型(GAM)及分布滞后非线性模型(DLNM)建模定量分析.GAM模型可处理因变量和众多解释变量间过度复杂非线性的关系,可用以调整死亡的长期和季节趋势、气象因素等潜在的混杂因素,近年来被广泛引入定量评价大气污染健康效应的时间序列研究中.DLNM模型可以通过建立交叉基函数描述因变量在自变量维度与滞后维度的分布,同时还可以以暴露—滞后—反应关系三维空间分布图给出暴露因素的滞后效应和非线性效应[41].相对于西安市总人数来说,因变量心脑血管疾病日门诊量相对较少,其分布近似于服从Possion分布,因此本研究将回归模型(Possion)引入GAM中,拟合疾病死亡人数与各影响因素之间的暴露-响应关系.
首先建立单污染物模型,选取心脑血管疾病实际死亡人数作为响应变量,再利用非参数平滑样条函数拟合非线性自变量,包括时间(time, time= 1...,731)、气温、相对湿度,用来控制气象因素对污染物与疾病死亡人数的混杂影响.选择赤池信息准则(AIC)最小原则,确定非参数样条平滑函数的自由度取值,选择使得AIC见效的气象要素引入模型,同时需引入周日亚元变量(DOW, DOW=1~7),假日指示变量.最终时间平滑函数的自由度采用11,温度、相对湿度、风速、气压的自由度分别为6,5,5,5.核心模型建立后,再将污染物日均浓度作为线性变量引入模型,同心脑血管疾病每日死亡人数建立泊松广义相加模型.考虑到大气颗粒物对心脑血管疾病每日死亡人数有滞后和累积效应,将污染物当日(Lag0)、1~6d(Lag1~ Lag6)和01~07d(Lag01~Lag07)前浓度引入模型,同样采用AIC准则对模型进行检验.在确定最佳滞后天数后,选择最优模型进行暴露反应分析,并按照性别进行分层建模.具体模型如下:
log[(Y)](time,)+(Z,)+basis.Z+×X+
as.factor(DOW)+as.factor(Holiday)+(1)
式中:Y是指第日的西安市心脑血管疾病实际死亡人数;E(Y)是指第日的疾病死亡人数的期望值;为非参数样条平滑函数,排除长期趋势、季节性、日历效应、气象等混杂因素;time为日历时间;为自由度;Z为第日的气象要素;Z表示由DLNM模型构建的“交叉基”;为回归系数,即暴露—反应关系系数;X为第日的污染物浓度;DOW是指处理“星期几效应”的虚拟函数;Holiday是指控制假日的变量;为截距[42].
多污染物模型的建立:在确定最优单污染物模型后,在该基础上引入多种污染物,建立多污染物模型,并把两者对比分析,目的是检验单污染物模型敏感性的同时,分析多种污染物协同作用下大气污染物对居民健康造成的影响,由此确定出研究期间影响心脑血管疾病每日死亡人数的主要危险因子.
1.2.2 平均气温与污染物协同作用的研究方法 因平均气温与污染物的共同作用引发相关疾病,所以选择非参数二元响应模型[43]拟合两者共同作用对相关疾病人数影响三维空间图,通过描述平均气温与污染物对疾病作用的空间分布特征,直观展示两者共同作用对疾病的影响.模型如下:
log[E(Y/X)](temperature,PM)COVs (2)
式中:(temperature,PM)为平均气温与污染物PM对心脑血管疾病的协同作用项;PM表示BC或PM2.5中的一种,COVs代表所有混杂因素.
1.2.3 危险度评估 根据GAM模型估算得到的暴露—反应关系系数,去定量评价污染物的健康效应.当污染物浓度每变化单位Δc浓度时,每日死亡人数相对危险度(RR):
RR=exp(Δ×) (3)
根据RR计算当污染物增加Δ时,对疾病日死亡人数造成的超额死亡风险(ER)及其95%置信区间(CI):
ER%=(RR-1)×100% (4)
ER%(95%CI)=[exp(Δ×(±1.95SE)-1)×100% (5)
式中:为模型中污染物的回归系数;SE为污染物的标准误差;Δ为浓度的变化范围.
2 结果分析
2.1 统计分析
表1为西安市区2014~2015年主要气象因子、4种大气污染物日均浓度和心脑血管疾病每日死亡人数的描述性统计结果,由表1可以看出,心脑血管疾病平均每天死亡人数为62.39例,25、50、75分别为50,61,72例/d,男性和女性分别为33.56和28.83例/d.西安市年均温度为15.27℃,日均温度幅度为-3~33.8℃,年平均相对湿度为61.48%,日均相对湿度幅度为19%~97%.BC和PM2.5年平均浓度分别为6.98和66.97µg/m3,PM2.5年均浓度已经明显超过国家GB0395-2012标准[40]中规定的二级空气质量标准(35µg/m3),研究时段内(730d)PM2.5超标天数为564d(77%),PM2.5为西安市的主要污染物.目前国家空气质量监测标准无BC污染物,但我国BC年均浓度相比北美、南美和中东等地区偏高[44-45].
2.2 大气污染物与气象要素之间Spearman相关分析
Spearman相关性分析结果见表2,BC和PM2.5均存在显著的正相关,且具有统计学意义.气温、风速与污染物之间存在明显负相关关系,相对湿度与污染物呈现负相关关系,气压与污染物呈明显正相关关系.大气污染物与气象要素间较强的关联,表明二者之间存在固有的理化特征,且对人体健康的影响并不是单因素的,提示气象要素是研究大气污染物对人群健康影响的重要混杂因素或效应修饰因素.
2.3 大气污染物对心脑血管疾病超额死亡风险的影响
2.3.1 单污染物模型 控制气象因素、季节性和长期趋势、星期几效应等混杂因素后,利用单污染物模型分别探讨不同滞后时间条件下BC和PM2.5对心脑血管疾病日死亡人数的超额危险度(ER)(图1).可以看出BC、PM2.5对心脑血管疾病的影响均存在滞后效应和累积效应,随着滞后天数的增加,两种污染物对疾病的影响减弱,这种滞后效应在其他研究中也有表现[46-50].
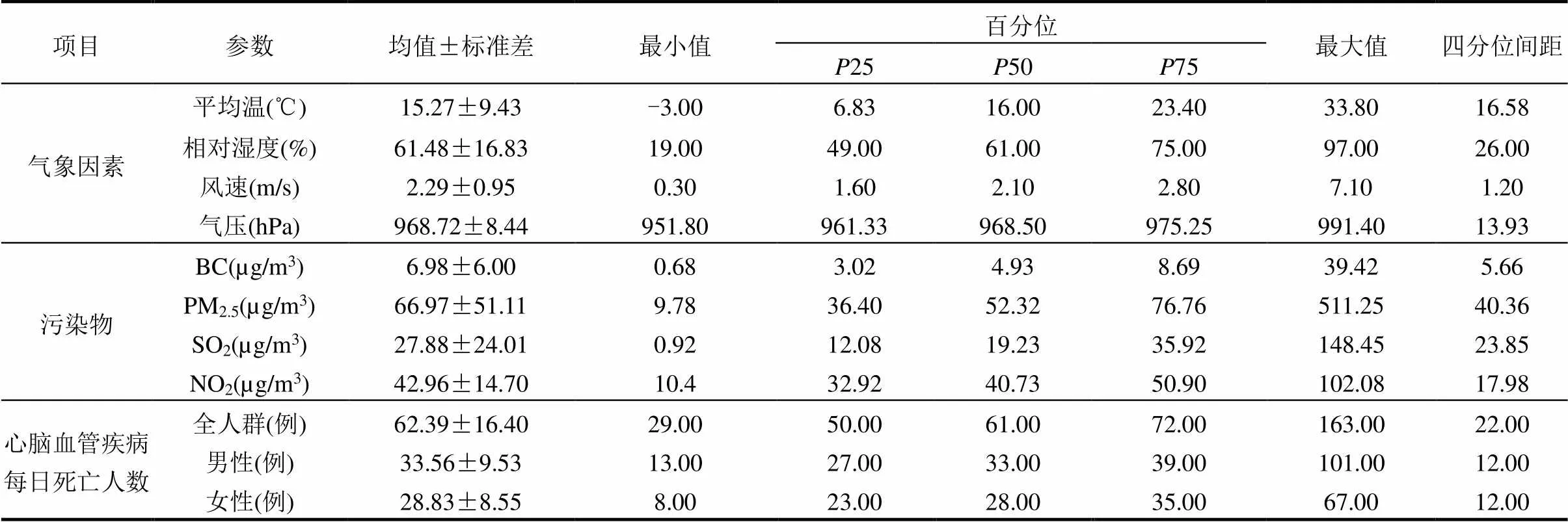
表1 心脑血管疾病每日死亡人数、气象要素及污染物的描述性分析
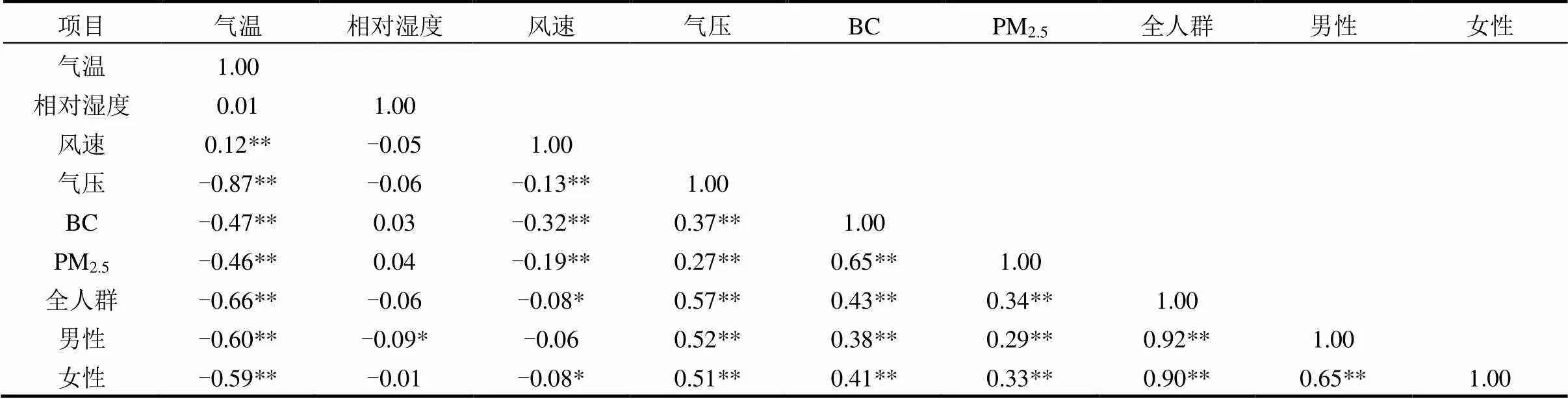
表2 心脑血管疾病每日死亡人数与气象要素和大气污染物的相关关系
注:**<0.01,*<0.05.
如图1所示,BC和PM2.5在心脑血管疾病模拟部分的Lag0-Lag3,Lag01-Lag04具有统计学意义(<0.01),各自的滞后结构表现出较强的一致性.BC在累积滞后3d(Lag03),PM2.5在滞后2d(Lag2)与心脑血管疾病每日死亡人数关联的ER最大.最佳滞后时间下,BC、PM2.5每增加一个IQR单位浓度(BC为5.31µg/m3,PM2.5为40.30µg/m3)对应的心脑血管疾病日死亡人数ER值为3.53% (95%CI:1.86,5.23)、2.01% (1.06,2.97),其ER值均通过=0.001显著性检验,均具有统计学意义.最佳滞后时间下,BC、PM2.5每增加一个1µg/m3对应的心脑血管疾病日死亡人数ER为0.66% (95%CI:0.35,0.97)、0.05% (95%CI:0.02,0.08),其ER值均通过=0.001显著性检验,均具有统计学意义.
考虑到男女性别的差异,以性别建立模型探讨BC、PM2.5浓度变化对不同人群下的健康影响.表3是污染物浓度升高对不同性别人群心脑血管疾病日死亡人数变化的影响,在最佳滞后时间下,BC、PM2.5每升高一个IQR,男性群体的心脑血管疾病的超额死亡率为2.83% (95%CI:0.76,4.95), 1.36% (95%CI:0.07,2.67),女性群体的心脑血管疾病的超额死亡率为4.30% (95%CI:1.84,6.82),2.74% (95%CI: 1.34,4.15),说明女性群体对BC、PM2.5暴露更为敏感.
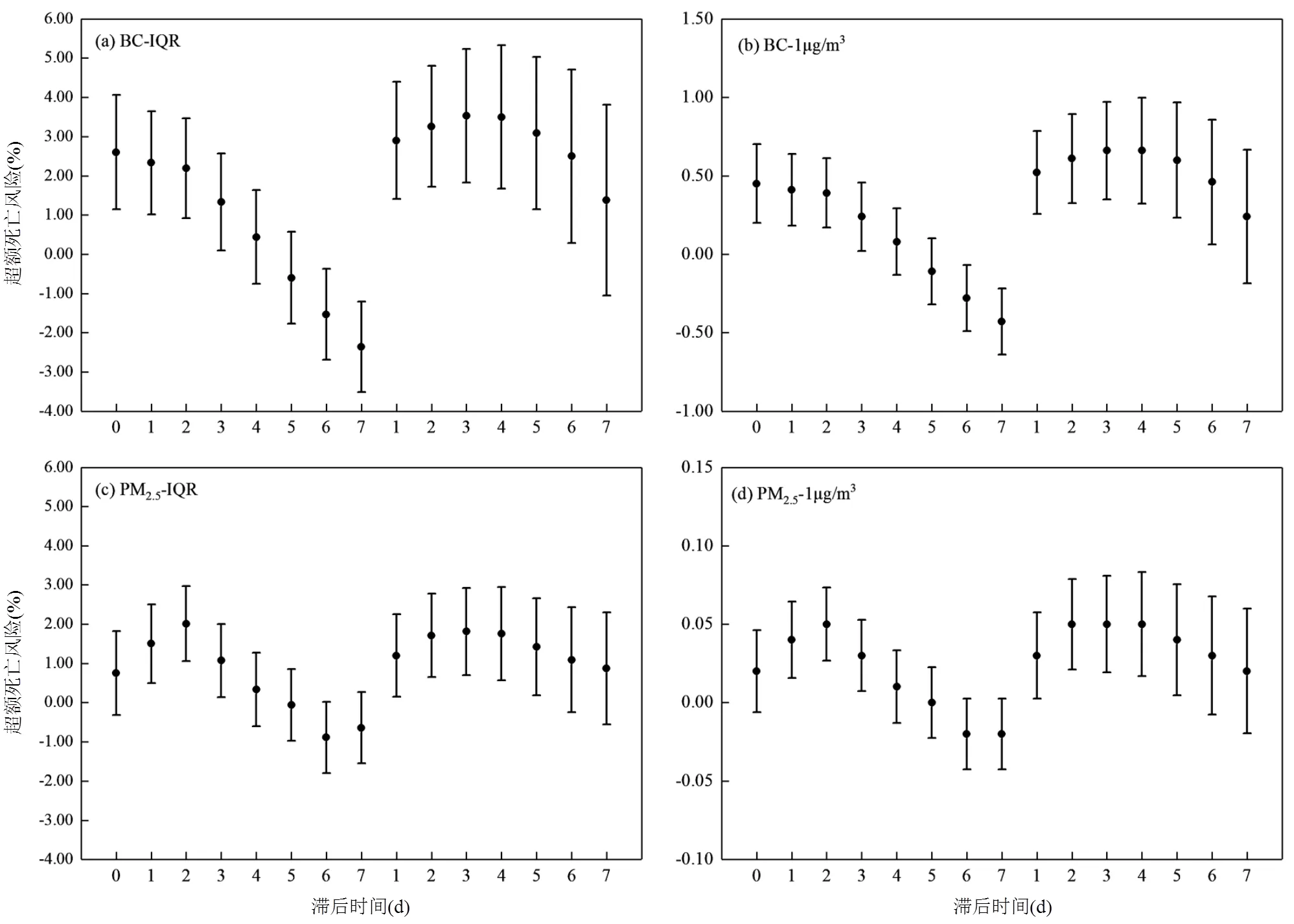
图1 不同时间滞后条件下BC、PM2.5浓度变化对心脑血管疾病每日死亡人数的影响
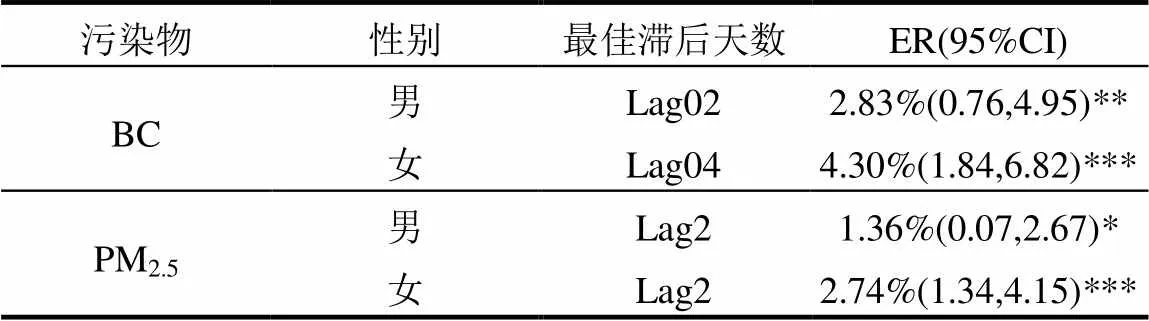
表3 性别分层下BC、PM2.5浓度变化对心脑血管疾病每日死亡人数的影响
注:***<0.001,**<0.01,*<0.05.
2.3.2 多污染物模型 低温与高浓度BC、PM2.5的协同作用对心脑血管疾病死亡均有显著影响.在多污染物模型中,同时引入PM2.5、SO2、NO2、BC中的2种、3种或4种污染物,多种污染物共同作用对西安市心脑血管疾病每日死亡人数的影响见表4.对于BC来说,分别加入SO2、NO2或同时加入这两种污染物后,ER值与BC单污染物模型拟合值相比略有上升,表明SO2、NO2可能存在协同作用,双污染物模型得出BC的健康影响强于BC的单污染物模型,Janssen等[51]在探究BC气溶胶在空气质量管理评估中的作用时也持同样观点;而对于PM2.5来说,分别加入SO2、NO2或同时加入两种污染物后对其ER值影响不大.总体而言,对于心脑血管疾病,当BC、PM2.5同时纳入其它一种或几种污染物时,对ER值无较大影响.
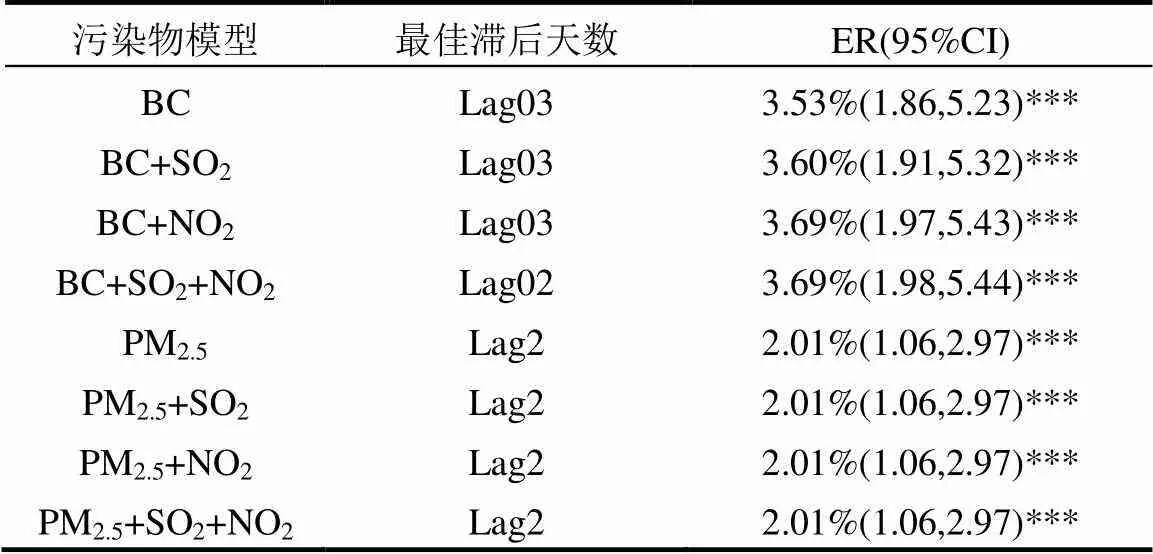
表4 多污染物模型下BC、PM2.5浓度变化对心脑血管疾病每日死亡人数的影响
注:***<0.001.

表5 不同时间自由度下BC、PM2.5浓度变化对心脑血管疾病每日死亡人数的影响
注:***<0.001.
2.3.3 敏感性分析 选取单污染物模型结果确定的BC、PM2.5最佳滞后天数对应的浓度,采用变更时间自由度的方式,对BC、PM2.5和心脑血管疾病死亡的关系进行分析,结果见表5,改变自由度后(df=10、11、12、13),其ER值及对应的95%CI可信度变化不大,说明模型较稳定.
2.4 气温变化对心脑血管疾病每日死亡人数的影响
各气象要素中,气温对心脑血管疾病影响最大,相关系数为-0.66,呈负相关,说明心脑血管疾病每日死亡人数随着温度的降低而升高.为研究温度范围对心脑血管疾病每日死亡人数的影响,利用模型(1)拟合气温与心脑血管疾病每日死亡人数的暴露反应关系,平均气温与疾病每日死亡人数呈近似“V”型分布特征(图2),即气温效应大致分为3个部分:当气温由低到高增加时,死亡风险逐渐减小,超过一定阈值后再次增加,且增幅较大,在气温较适宜阶段25~27℃对心脑血管疾病死亡影响非常小,该阶段为死亡风险最小的最适温度范围(气温阈值范围).各气温段均具有一定的滞后作用,且滞后性的变化趋势各有不同,最大危险度对应的滞后日也有一定区别.

图2 日均气温与心脑血管疾病每日死亡人数的暴露反应关系
图3(a~c)是平均气温对不同性别心血脑疾病死亡的滞后效应等值线图,结合典型滞后日的剖面图(图3(d~g))可以看到,在滞后当天(Lag0)时高温和低温两侧死亡风险较高(RR>1),表现为低温效应、高温效应同时存在的即时效应.不同水平气温的滞后效应变化差异较大,平均气温对心脑血管疾病死亡的影响表现为低温滞后效应为主,25~27℃范围内的整体效应较弱.Lag=1时,高温效应维持,低温效应逐渐消失.Lag=4时,高温效应逐渐消失,低温效应开始凸显,且随着滞后时间的增加,对心脑血管疾病死亡有显著影响的低温效应持续增高,约在Lag=5时达到最强后低温效应逐渐消失,低温效应在14d后再次增加,考虑到较长滞后期内会出现天气叠加效应、人为因素等其他影响因素,加之模型可能出现的过拟合现象,不作为主要结果.另外可以看出,死亡当天女性对低温的敏感性高于男性,而对高温的敏感性低于男性,滞后效应对两类人群的影响与总心脑血管疾病的变化相似.
建立非参数二元响应模型,用以拟合平均气温与不同污染物(BC、PM2.5)协同作用对心脑血管疾病有显著协同作用的三维立体图(图4).BC与低温对心脑血管疾病死亡可能存在交互影响,低温、高浓度BC条件下,形成了心脑血管疾病每日死亡人数的峰值,其原因应该是冬半年气温低且污染物浓度高,二者的协同效应对心脑血管疾病死亡的影响增强,PM2.5对心脑血管疾病的协同作用与BC基本一致.
为定量分析污染物与气温共同作用对疾病每日死亡人数的影响,采用温度分层模型研究气温与BC(PM2.5)交互作用对心脑血管疾病每日死亡人数的影响.本研究选取26℃(图2)为温度临界值,通过温度阈值将气温分为相对高温段(>26℃)、相对低温段(<26℃)两部分来分析不同温度阈值条件下两种污染物浓度变化对心脑血管疾病死亡的影响效应.不同温度水平下BC、PM2.5的最佳滞后时间与温度未分层模型结果一致,分别为Lag03、Lag2.表6结果表明,对于BC、PM2.5而言,低温效应具有统计学意义,高温无统计学意义,表明低温可加剧污染物对人群健康的不利影响.总体来看,低温条件下BC对人群的健康危害大于PM2.5.
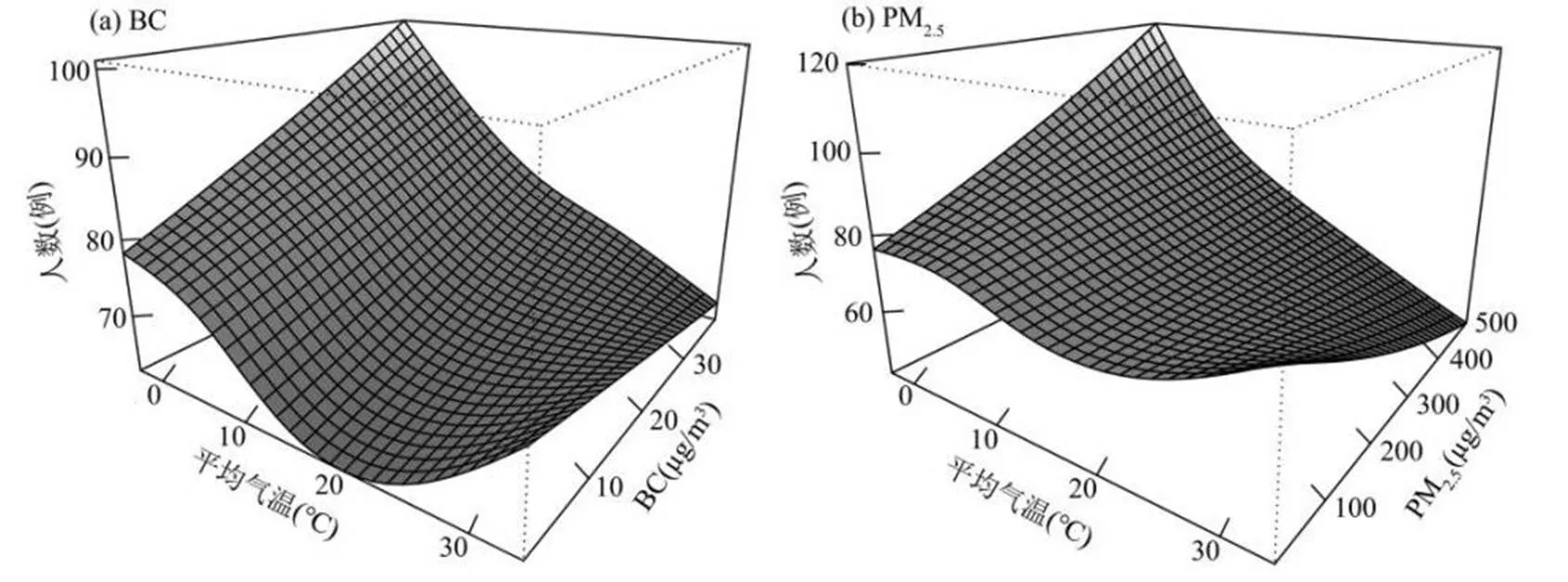
图4 日均气温与BC和PM2.5交互作用对心脑血管疾病每日死亡人数影响的平滑曲面

表6 不同温度水平下BC和PM2.5浓度变化对心脑血管疾病每日死亡人数的影响
注:***<0.001.
3 讨论
3.1 气温、污染物单效应讨论
本文对西安市BC和PM2.5与心脑血管疾病死亡的关联进行研究,发现BC、PM2.5对心脑血管疾病人群存在显著的健康效应,当两种污染物增加相同质量单位浓度时,BC的超额死亡风险远大于PM2.5,这与世界卫生组织的Meta分析结果较为一致[52].但是,一般情况下大气中的 BC浓度比PM2.5浓度大约小1个量级,所以应选择更接近实际情况的IQR计量为变化单位,计算超额死亡风险.目前有限的科学证据表明,两种颗粒物每增加一个IQR得到的健康效应相似[53],这种结果尤其在心脑血管疾病研究方面较为明显,Zanobetti等[54]在波士顿研究发现BC、PM2.5每增加一个IQR单位浓度,对应的急性紧急梗塞发病人数的ER值为8.6%、8.3%,Wang等[55]在上海开展的颗粒物健康效应研究发现,BC、PM2.5每增加一个IQR单位浓度,心脑血管疾病每日死亡人数的ER值为3.2%、3.3%.本文研究得出的西安市BC、PM2.5浓度每升高一个IQR,心脑血管疾病每日死亡人数分别增加3.53%、1.81%,但BC、PM2.5年均浓度分别为7.0,67.0µg/m3,BC仅占PM2.5浓度的一小部分,可见BC与心脑血管疾病每日死亡率的相关性比PM2.5更强,表明BC是评估环境颗粒物健康风险的一个额外有价值的空气质量指标,这种现象可能是由于BC粒径小,比表面积大,可以通过粘附更多的有毒物质[56]表现出比PM2.5更强的毒性,引起内皮细胞反应增加,诱导疾病产生.
从性别分层来看,心脑血管疾病的女性人群健康风险均高于男性,并均具有统计学意义.这种性别差异引起的污染物健康效应结果不同在出血性中风、冠心病死亡和呼吸系统发病等研究中有所体现[11,57].所以女性对这些污染物是易感人群,会受到更多的污染物潜在危险的影响.有研究表明男女群体对污染物的敏感程度不相同,这种差异可能与两性的不同生理学结构、暴露模式有关,与肺功能、皮肤吸收等生理特征指标相关,两性在职业、户外活动时间等方面也存在一定差异[58-59].
气温对人群健康的影响呈现非线性关系,国内外学者们发现气温和人群死亡或发病的关系大多呈现“J”、“U”或“V”型,可以说明气温对相关疾病死亡存在一个温度阈值[60-61],该阈值下的疾病死亡风险最小,若超过该阈值,相关疾病死亡人数将会显著增加.本研究中,相关心脑血管死亡人数与气温显著相关性说明气温是影响相关疾病最主要的气象要素,从气温对西安市心脑血管疾病的影响和滞后性来看,日平均气温与心脑血管疾病每日死亡人数呈现近似“V”型分布的非线性关系,最适温度为26℃,表现为高低温即时效应和低温滞后效应,气温对心脑血管疾病的最大滞后时间为8d.
3.2 气温与污染物协同效应讨论
污染物对人群的健康影响往往存在于特定气象条件下发生,并不是孤立存在的,已有证据指出气象要素和大气污染通过协同作用对人群的健康效应产生不良影响[62-63],本文开展了西安市2014~2015年气温、污染物(BC、PM2.5)及其二者交互作用对心脑血管疾病每日死亡人数的影响研究.结果发现:在低温、高浓度污染物条件下,心脑血管疾病的死亡风险最高,表明低温与BC、PM2.5对人群健康效应存在协同放大效应.值得注意的是,本研究中,低温段BC对人群健康的影响比PM2.5更为显著,这在以往的研究结果中尚未涉及.
3.3 局限性说明
西安作为我国人口密度高、工业发达的典型城市,以细颗粒为主的大气污染问题严重,研究该市BC和PM2.5与气温交互作用对心脑血管疾病死亡的健康效应影响具有典型代表性,可为其他城市提供参考.但存在一定的局限性,首先与发达国家相比,由于我国医疗数据获取的难度较大,收集资料受限,没有对年龄段和其他类别疾病进行更为深入细致地研究,也无法排除个体的混杂因素如抽烟、体重等对于大气污染健康效应影响研究结果的干扰;其次,该资料采用的污染物暴露浓度为该市平均浓度和代表站浓度,对于个体暴露水平可能会造成一定偏差;另外,BC与PM2.5之间的高度相关性限制了分离单个污染物独立效应的能力,这可能导致模拟结果存在一定的偏差,目前该问题尚未得到有效解决,需要进一步深究.
4 结论
4.1 BC、PM2.5对西安市心脑血管疾病每日死亡人数的影响存在滞后效应,在最佳滞后时间下,BC、PM2.5每增加1个IQR(BC为5.31µg/m3,PM2.5为40.30µg/m3),对应的超额死亡风险值(ER)分别为3.55% (95%CI:1.86,5.23),2.01% (95%CI:1.06,2.97).
4.2 在性别属性分类下,相对于男性群体,女性群体对BC、PM2.5暴露更为敏感;在季节分类下,冬半年BC、PM2.5暴露对于人群健康影响作用高于夏半年.
4.3 多污染物模型研究表明,对心脑血管疾病而言,当BC、PM2.5同时纳入其他一种或几种污染物时,对ER值无明显影响.
4.4 在各气象要素中,气温对心脑血管疾病影响最敏感.日平均气温与心脑血管疾病每日死亡人数呈现近似“V”型分布的非线性关系,最适温度范围是为25~27℃,高温对心脑血管系统疾病死亡以即时效应为主,低温主要表现为滞后效应.
4.5 低温与高浓度BC、PM2.5对心脑血管疾病死亡的健康效应均有协同放大效应,低温段BC对人群健康的影响比PM2.5更为显著.
[1] 王 珊,修天阳,孙 扬,等.1960~2012年西安地区雾霾日数与气象因素变化规律分析[J]. 环境科学学报, 2014,34(1):19-26.
Wang S, Xiu T, Sun Y, et al. The changes of mist and haze days and meteorological element during 1960~2012 in Xi'an [J]. Acta Scientiae Circumstantiae, 2014,34(1):19-26.
[2] 李会霞,史兴民.西安市PM2.5时空分布特征及气象成因[J]. 生态环境学报, 2016,25(2):266-271.
Li H X, Shi X M. Temporal and spatial distribution, meteorological factors of PM2.5in Xi’an City [J]. Ecology and Environmental Sciences, 2016,25(2):266-271.
[3] Wang Y, Zhang R Y, Saravanan R. Asian pollution climatically modulates mid-latitude cyclones following hierarchical modelling and observational analysis [J]. Nature Communications, 2014,5(1):3098- 3104.
[4] Huang R J, Zhang Y L, Bozzetti C, et al. High secondary aerosol contribution to particulate pollution during haze events in China [J]. Nature, 2014,514(7521):218-222.
[5] 陈仁杰,陈秉衡,阚海东.我国113个城市大气颗粒物污染的健康经济学评价[J]. 中国环境科学, 2010,30(3):410-415.
Chen R J, Chen B H, Kan H D. Health economic evaluation of air particulate pollution in 113cities in China [J]. China Environmental Science, 2010,30(3):410-415.
[6] Rd P C. Epidemiology of fine particulate air pollution and human health: biologic mechanisms and who's at risk? [J]. Environmental Health Perspectives Supplements, 2000,108:713-723.
[7] Miller M R, Shaw C A, Langrish J P. From particles to patients: oxidative stress and the cardiovascular effects of air pollution [J]. Future cardiology, 2012,8(4):577-602.
[8] Chin M T. Basic mechanisms for adverse cardiovascular events associated with air pollution [J]. Heart, 2015,101(4):253-256.
[9] Thurston G D, Kipen H, Annesi-Maesano I, et al. A joint ERS/ATS policy statement: what constitutes an adverse health effect of air pollution? An analytical framework [J]. The European respiratory journal, 2016,49(1):1600419.
[10] Han L, Sun Z B, He J, et al. Seasonal variation in health impacts associated with visibility in Beijing, China [J]. Science of the Total Environment, 2020,730:139149.
[11] Han L, Sun Z B, Gong T Y, et al. Assessment of the short-term mortality effect of the national action plan on air pollution in Beijing, China [J]. Environmental Research Letters, 2020,15:034052.
[12] Zhang Y, Wang S G, Fan X G, et al. Temperature modulation of the health effects of particulate matter in Beijing, China [J]. Environmental Science and Pollution Research, 2018,25(11):10857.
[13] Hua J, Yin Y, Peng L, et al. Acute effects of black carbon and PM2.5on children asthma admissions: A time-series study in a Chinese city [J]. Science of the Total Environment, 2014,481:433-438.
[14] Urszula M, Stella B P, Szadkowska-Stańczyk I. Worker exposure to ultrafine particles during carbon black treatment [J]. Medycyna Pracy, 2015,66(3):317-326.
[15] Schreiber N, Ströbele M, Kopf J, et al. Lung alterations following single or multiple low-dose carbon black nanoparticle aspirations in mice [J]. Journal of Toxicology & Environmental Health Part A, 2013,76(24):1317-1332.
[16] Smith K R, Jerrett M, Anderson H R, et al. Public health benefits of strategies to reduce greenhouse-gas emissions: health implications of short-lived greenhouse pollutants [J]. The Lancet, 2010,374(9707): 2091-2103.
[17] Gold D R, Litonjua A A, et al. Air pollution and ST-segment depression in elderly subjects [J]. Environmental Health Perspectives, 2005,113(7):883-887.
[18] Henneberger A, Zareba W, Ibald-Mulli A, et al. Repolarization changes induced by air pollution in ischemic heart disease patients [J]. Environmental Health Perspectives, 2005,113(4):440-446.
[19] Ostro B, Tobias A, Karanasiou A, et al. The risks of acute exposure to black carbon in Southern Europe: results from the MED-PARTICLES proiect [J]. Occupational and Environmental Medicine, 2015,72(2): 123-129.
[20] Qiao L P, Cai J, Wang H L, et al. PM2.5constituents and hospital emergency-room visits in Shanghai, China [J]. Environmental Science and Technology, 2014,48(17):10406-10414.
[21] Tolbert P E, Klein M, Metzger K B, et al. Interim results of the study of particulates and health in Atlanta (SOPHIA) [J]. Journal of Exposure Analysis and Environmental Epidemiology, 2000,10(5):446- 460.
[22] Wang Y Y, Shi Z H, Shen F Z, et al. Associations of daily mortality with short-term exposure to PM2.5and its constituents in Shanghai, China [J]. Chemosphere, 2019,233:879-887.
[23] Roger D, Peng, Michelle L, et al. Emergency admissions for cardiovascular and respiratory diseases and the chemical composition of fine particle air pollution [J]. Environmental health perspectives, 2009,117(6):957-963.
[24] Liang F C, Tian L, Guo Q, et al. Associations of PM2.5and black carbon with hospital emergency room visits during heavy haze events: A case study in Beijing, China [J]. International Journal of Environmental Research and Public Health, 2017,14(7):725.
[25] Lin W W, Huang W, Zhu T, et al. Acute respiratory inflammation in children and black carbon in ambient air before and during the 2008Beijing Olympics [J]. Environt Health Perspect, 2011,119(10): 1507-1512.
[26] 张 莹,辛金元,张小玲等.北京市气温与黑碳和PM2.5对疾病死亡影响的交互效应 [J]. 中国环境科学, 2020,40(7):3179-3187.
Zhang Y, Xin J Y, Zhang X L, et al. Interaction effects between ambient temperature and black carbon and PM2.5on mortality in Beijing [J]. China Environmental Science, 2020,40(7):3179-3187.
[27] Gong T Y, Sun Z B, Zhang X L, et al. Associations of black carbon and PM2.5with daily cardiovascular mortality in Beijing, China [J]. Atmospheric Environment, 2019,214:116876
[28] Geng F H, Hua J, Mu Z, et al. Differentiating the associations of black carbon and fine particle with daily mortality in a Chinese city [J]. Environmental Research, 2013,120:27-32..
[29] Zhang R, Dai Y F, Zhang X, et al. Reduced pulmonary function and increased pro-inflame matory cytokines in nanoscale carbon black exposed workers [J]. Particle and Fibre Toxicology, 2014,11(1):73-87.
[30] Lin W W, Dai J J, Liu R, et al. Integrated assessment of health risk and climate effects of black carbon in the Pearl River Delta region, China [J]. Environmental Research, 2019,176.
[31] Han L, Sun Z B, He J, et al. Estimating the mortality burden attributable to temperature and PM2.5from the perspective of atmospheric flow [J]. Environmental Research Letters, 2020,15(12): 124059.
[32] Xing Q, Sun Z B, Tao Y, et al. Impacts of urbanization on the temperature-cardiovascular mortality relationship in Beijing, China [J]. Environmental Research, 2020,191:110234.
[33] Ebi K L, Exuzides K A, Lau E, et al. Weather changes associated with hospitalizations for cardiovascular diseases and stroke in California, 1983-1998 [J]. International Journal of Biometeorology, 2004,49(1): 48-58.
[34] Roberts S. Interactions between particulate air pollution and temperature in air pollution mortality time series studies [J]. Environmental Research, 2004,96(3):328-337.
[35] Ren C, Tong S. Temperature modifies the health effects of particulate matter in Brisbane, Australia [J]. International Journal of Biometeorology, 2006,51(2):87-96.
[36] Ren C, Williams G M, Mengersen K, et al. Does temperature modify short-term effects of ozone on total mortality in 60large eastern US communities? — An assessment using the NMMAPS data [J]. Environment International, 2008,34(4):451-458.
[37] Zhang Y, Wang S G, Zhang X L, et al. Temperature modulation of the adverse consequences on human mortality due to exposure to fine particulates: A study of multiple cities in China [J]. Environmental Research, 2020,185:109353.
[38] Xia M, Zhang Y, Zhao Z, et al. Temperature modifies the acute effect of particulate air pollution on mortality in eight Chinese cities [J]. Science of The Total Environment, 2012,435-436(2012):215-221.
[39] 张 莹,王式功,贾地伟,等.气温与PM2.5协同作用对疾病急诊就诊人数的影响 [J]. 中国环境科学, 2017,37(8):3175-3182.
Zhang Y, Wang S G, Jia D W, et al. Synergetic effect of mean temperature and PM2.5on emergency room visits for different diseases [J]. China Environmental Science, 2017,37(8):3175-3182.
[40] GB 3095-2012 国家环境空气质量标准 [S].
GB 3095-2012 National ambient air quality standard [S].
[41] Gasparrini A, Guo Y, Hashizume M, et al. Mortality risk attributable to high and low ambient temperature: a multicountry observational study [J]. The Lancet, 2015,6736(14):369-375.
[42] Xu Q, Wang S, Guo Y M, et al. Acute exposure to fine particulate matter and cardiovascular hospital emergency room visits in Beijing, China [J]. Environmental Pollution, 2017,220:317-327.
[43] Ren T, Tong S. Temperature modifies the short-term effects of particulate matter on cardiovascular diseases in Brisbane Australia [J]. International Journal of Biometeorology, 2006,51(2):87-96.
[44] Sarnat S E, Winquist A, Schauer J J, et al. Fine particulate matter components and emergency department visits for cardiovascular and respiratory diseases in the St. Louis, Missouri-Illinois, metropolitan area [J]. Environmental health perspectives, 2015,123(5):437-444.
[45] Dockery D W, Muller J E, Peters A, et al. Increased particulate air pollution and the triggering of myocardial infarction [J]. Circulation, 2001,103(23):2810-2815.
[46] Roger D, Peng, Michelle L, et al. Emergency admissions for cardiovascular and respiratory diseases and the chemical composition of fine particle air pollution [J]. Environmental Health Perspectives, 2009,117(6):957-963.
[47] Darrow L A, Klein M, Flanders W D, et al. Air pollution and acute respiratory infections among Children 0-4years of age: an 18-year time-series study [J]. American journal of epidemiology, 2014, 180(10):968 977.
[48] Liang F C, Tian L, Guo Q, et al. Associations of PM2.5and black carbon with hospital emergency room visits during heavy haze events: A case study in Beijing, China [J]. International Journal of Environmental Research and Public Health, 2017,14(7):725-737.
[49] Kim S Y, Peel J L, Hannigan M P, et al. The temporal lag structure of short-term associations of fine particulate matter chemical constituents and cardiovascular and respiratory hospitalizations [J]. Environmental Health Perspectives, 2012,120(8):1094-1099.
[50] Lall R, Thurston I G D. Distributed lag analyses of daily hospital admissions and source-apportioned fine particle air pollution [J]. Environmental Health Perspectives, 2011,119(4):455-460.
[51] Janssen N A H, Hoek G, Simic-Lawson M, et al. Black carbon as an additional indicator of the adverse health effects of airborne particles compared with PM10and PM2.5[J]. Environmental Health Perspectives, 2011,119(12):1691-1699.
[52] WHO Regional Office for Europe. Health effects of black carbon [R/OL]. (2013-1-28) [2018-1-28]. http://www.euro.who.int.data/ assets/pdf file/0004/162535/e96541.pdf.
[53] Thomas J L, Jennifer L N, Steven J D, et al. A systematic review of cardiovascular emergency department visits, hospital admissions and mortality associated with ambient black carbon [J]. Environment International, 2017,107:154-162.
[54] Zanobetti A, Coull B A, Gryparis A, et al. Associations between arrhythmia episodes and temporally and spatially resolved black carbon and particulate matter in elderly patients [J]. Occupational & Environmental Medicine, 2014,71(3):201-207.
[55] Wang X, Chen R, Meng X, et al. Associations between fine particle, coarse particle, black carbon and hospital visits in a Chinese city [J]. Science of The Total Environment, 2013:458-460.
[56] Schwartz J, Spix C, Touloumi G, et al. Methodological issues in studies of air pollution and daily counts of deaths or hospital admissions [J]. Journal of Epidemiology & Community Health, 1996, 50.
[57] Huang W, Cao J J, Tao Y B, et al. Seasonal variation of chemical species associated with short-term mortality effects of PM2.5in Xi'an, a central city in China [J]. American Journal of Epidemiology, 2012,175(6):556-566.
[58] Marco Z, Paolo L, Martin G, et al. Effects of mixing state on optical and radiative properties of black carbon in the European Arctic [J]. Atmospheric Chemistry and Physics, 2018,18(19):1-33.
[59] Clougherty J E, Rossi C A, Lawrence J, et al. Chronic social stress and susceptibility to concentrated ambient fine particles in rats [J]. Environmental Health Perspectives, 2010,118(6):769-775.
[60] Zhang Y, Fan X G, Zhang X L, et al. Moderately cold temperature associates with high cardiovascular disease mortality in China [J]. Air Quality, Atmosphere and Health, 2019,12(10):1225-1235.
[61] Magali Hurtado-Díaz, Cruz J C, José L, et al. Texcalac-Sangrador, et al.Short-term effects of ambient temperature on non-external and cardiovascular mortality among older adults of metropolitan areas of Mexico [J]. International Journal of Biometeorology, 2019,(63):12.
[62] Stafoggia M, Schwartz J, Forastiere F, et al. Perucci the SISTI Group. Does temperature modify the association between air pollution and mortality? A multicity ase-crossover analysis in Italy [J]. American Journal of Epidemiology, 2008,167(12):1476-1485.
[63] Lippmann M, Ito K, Nádas A, et al. Association of particulate matter components with daily mortality and morbidity in urban populations [J]. Research Report, 2000,95(95):73-82.
感谢中国疾病预防控制中心郑灿军老师对疾病数据和本文研究工作提供的帮助!
Influence of BC, PM2.5, temperature and their synergy on mortality of cardiovascular diseases in Xi'an.
OU Yi-han1,2, ZHANG Xiao-ling1,2,3*, ZHANG Ying1, KANG ping1
(1.School of Atmospheric Sciences, Chengdu University of Information Technology, Chengdu 610225, China;2.Key Laboratory of Plateau Atmosphere and Environment of Sichuan Province, Chengdu 610225, China;3.Chengdu Plain Urban Meteorology and Environment Scientific Observation and Research Station of Sichuan Province, Chengdu 610225, China)., 2021,41(9):4415~4425
Daily death data of cardiovascular diseases during 2014~2015, daily average of BC(black carbon) and PM2.5and meteorological data during the same period in Xi’an were collected. Three semi-parametric Generalized Additive Models (GAMs) based on the time series, including an independent model, a non-parametric bivariate response surface model, and a temperature stratification model, were adopted to this study. The results showed that BC and PM2.5had a lag effect on the daily mortality of cardiovascular diseases in Xi 'an. With the optimal lag period, when concentrations of BC and PM2.5increased by interquartile range (IQR), the excess risk of cardiovascular diseases increased by 3.53%(95%CI: 1.86, 5.23) and 2.01% (95%CI: 1.06, 2.97), respectively. The exposure-response relationship between ambient temperature and mortality of cardiovascular diseases both exhibited "V" type and the most comfortable temperature was 26℃. Low temperature and high pollutant concentration had a synergistic strengthening effect on cardiovascular diseases. When the temperature lower 26℃, the modulating effects of temperature on BC-mortality relationship became more pronounced than that on PM2.5-mortality relationships with temperature cutoff increasing. For cardiovascular diseases, different susceptibility showed in different subgroups, and female groups was more sensitive to the health risks of BC and PM2.5. When BC and PM2.5were included in one or more other gaseous pollutants at the same time, the excess risk had no major impact. The adverse effect of BC on human health should not be neglected in the future. BC may be used as an important air quality indicator to assess the health risks of air pollutants.
black carbon;PM2.5;temperature;synergistic effect;cardiovascular diseases;risk of excessive death
X503.1
A
1000-6923(2021)09-4415-11
欧奕含(1996-),女,四川成都人,成都信息工程大学硕士研究生,主要从事大气环境与健康研究.
2021-01-28
国家重点研发计划课题(2016YFA0602004);国家自然科学基金资助项目(42005136);国家重点研发计划课题(2018YFC0214002);成都市科技局技术创新研发项目(2018-YF05-00219-SN)
* 责任作者, 教授, xlzhang@ium.cn

