MET-PET/CT技术诊断MRI疑诊脑胶质瘤及评估恶性增殖行为价值
韦 琳,唐武儒, 廖 云, 韦晶晶, 陆泳梁
河池市人民医院, 广西 河池 547000
脑胶质瘤是成人颅内最常见原发性肿瘤,其发病率约占颅脑肿瘤的35%~60%[1],CT、磁共振成像(MRI)是其主要诊断手段,但受肿瘤血脑屏障损坏程度、细胞外间隙大小、肿瘤浸润范围等因素影响,可能出现分级误判,从而影响治疗手段制定[2,3]。而11C-蛋氨酸正电子发射断层显像术(MET-PET/CT)以11C-MET为示踪剂,有助于反映肿瘤组织生物活性、鉴别诊断颅内良恶性病变、判断肿瘤级别[4,5],但其在诊断脑胶质瘤方面仍需进一步深入分析。另有学者指出[6],细胞增殖是脑胶质瘤的基本特征之一,亦是评估脑胶质瘤预后的重要因素。然而MET-PET/CT技术在评估脑胶质瘤增殖动力、恶性生物学行为方面临床报道较少。本研究探讨MET-PET/CT技术诊断MRI疑诊脑胶质瘤的价值及标准化摄取值(SUV)、肿瘤/正常脑组织值(T/N)与脑胶质瘤增殖动力、恶性生物学行为的关系,旨在为临床诊治、预后评估提供辅助手段。
1 资料和方法
1.1 一般资料
选取2017年5月至2020年10月我院收治的91例经MRI检查后疑诊脑胶质瘤患者作为研究对象,其中女37例、男54例;年龄22~56岁,平均年龄(37.65±5.32)岁。本研究经本院伦理委员会审核同意,研究对象均知情同意。纳入标准:均存在头痛、呕吐等临床症状。排除标准:患有幽闭恐惧症等无法配合MET-PET/CT、MRI检查者;处于妊娠期或哺乳期等特殊时期者;合并其他部位恶性肿瘤或脑血管疾病者;近3个月有放化疗或类固醇治疗史者;失聪、失语、昏迷或精神行为异常者。
1.2 方法
(1)MET-PET/CT检查。采用Discovery elit PET/CT仪(GE公司),仰卧位,建立静脉通道,平静状态下注射555~740 MBq MET,10~15 min后开始实施脑三维显像。PET发射扫描时间为10 min。在11C半衰期衰减校正后采集数据,CT扫描条件:电压/电流140 kV/200 mA、螺距0.75、旋转时间0.8 s/圈,重建PET/CT图像(层厚0.3 cm),利用融合软件帧对帧分析PET/CT融合、PET、CT图像。由2名富含丰富PET/CT诊断经验核医学医生目测判断11C-MET浓聚灶,并根据其部位、形态及CT密度改变等评估病灶性质。其中,周围正常脑组织或对侧相应部位放射性浓聚程度低于病灶为阳性,反之为阴性。同时,于病灶浓聚程度最高处勾画感兴趣区,利用工作站软件自动生成标准化摄取值(SUV)、肿瘤/正常脑组织值(T/N)、肿瘤代谢体积(MTV)。
(2)Ki-67增殖指数测定。采用免疫组化Da-koEnVision法检测Ki-67,严格按照美国Abcam公司的试剂盒说明书进行操作。经手术获取胶质瘤组织标本,甲醛(4%)固定,石蜡包埋,切片,脱蜡、水化、抗原修复,染色。Ki-67抗原染色呈棕褐色即为阳性。通过CCD于高倍镜下随机抽取5个视野照片,Ki-67增殖指数=Ki-67阳性细胞/细胞总数×100%,取最大值。
(3)肿瘤分级采用世界卫生组织(WHO)脑肿瘤分级标准[7]。毛细胞型星形细胞瘤为I级;少突胶质细胞瘤、肥胖细胞型星形细胞瘤、纤维型星形细胞瘤、室管膜瘤为Ⅱ级;间变性多形性黄色星形细胞瘤、间变性星形细胞瘤、间变性室管膜瘤为Ⅲ级;胶质母细胞瘤为Ⅳ级,将I~Ⅱ级纳入低级别胶质瘤,Ⅲ~Ⅳ级纳入高级别胶质瘤。
1.3 统计学分析
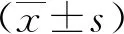
2 结果
2.1 MET-PET/CT技术检出脑胶质瘤情况
病理检查显示,91例中,61例为脑胶质瘤患者,30例为非脑胶质瘤患者;MET-PET/CT技术检出脑胶质瘤60例,非脑胶质瘤31例,见表1。计算得到MET-PET/CT诊断MRI疑诊脑胶质瘤敏感度为96.72%,特异度为96.67%,准确度为96.70%。

表1 MET-PET/CT技术检出脑胶质瘤情况
2.2 不同级别脑胶质瘤患者MET-PET/CT定量参数、Ki-67增殖指数比较
高级别与低级别患者MTV比较,差异无统计学意义(P>0.05);高级别患者SUV、T/N值、Ki-67增殖指数显著高于低级别患者(P<0.05)。见表2。
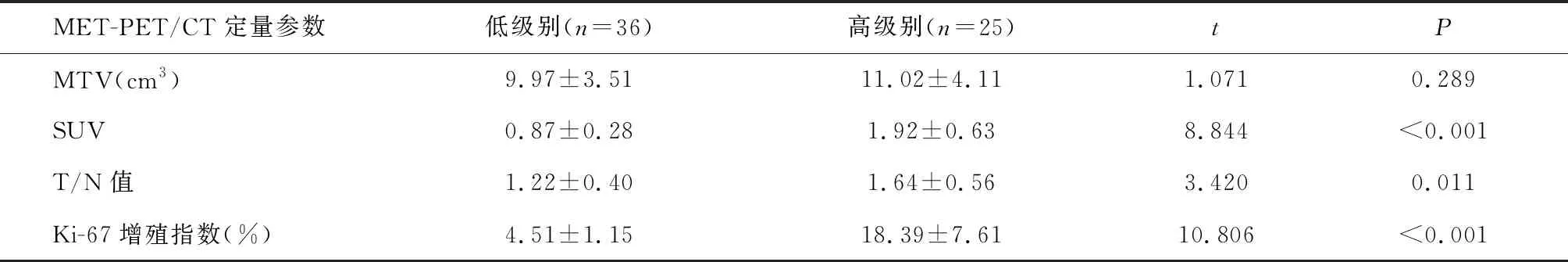
表2 不同级别脑胶质瘤患者MET-PET/CT定量参数、Ki-67增殖指数比较

图1 SUV与WHO脑胶质瘤分级相关性图2 T/N值与WHO脑胶质瘤分级相关性图3 SUV与Ki-67增殖指数相关性图4 T/N值与Ki-67增殖指数相关性
2.3 SUV、T/N值与WHO脑胶质瘤分级相关性
WHO分级Ⅰ级14例、Ⅱ级22例、Ⅲ级16例、Ⅳ级9例。由于MTV组间无差异,故不进行相关性分析。以两组各数据作为源数据,采用Spearman分析SUV、T/N值与WHO脑胶质瘤分级相关性,赋值:Ⅰ级=1,Ⅱ级=2,Ⅲ级=3,Ⅳ级=4)。结果显示,SUV、T/N值与WHO脑胶质瘤分级呈正相关(r=0.755、r=0.774,P<0.001)。见图1和图2。
2.4 SUV、T/N值与Ki-67增殖指数相关性
由于MTV组间无差异,故不进行相关性分析。以两组各数据作为源数据,采用Pearson分析SUV、T/N值与Ki-67增殖指数相关性,结果显示,SUV、T/N值与Ki-67增殖指数呈正相关(r=0.868、r=0.771,P<0.001)。见图3和图4。
3 讨论
目前,MRI仍是诊断颅内病变的常用影像学方法,但常规MRI侧重于解剖影像,在代谢、血管生成等肿瘤生物学特性方面存在一定不足[8,9],MET-PET/CT 可从分子水平方面实现功能影像与解剖形态学影像的同机融合,有效反映肿瘤细胞与正常组织之间代谢的不同[10,11]。本研究结果显示,以病理检查结果为准,MET-PET/CT诊断MRI疑诊脑胶质瘤的准确度可达96.70%,这可能与肿瘤间变坏死区对11C-MET摄取降低、11C-MET脑本底低等一系列因素有关。说明MET-PET/CT有望成为MRI诊断脑胶质瘤的重要补充手段。但龙亚丽等[12]研究显示,MET-PET/CT诊断脑肿瘤的特异度较低,仅为56.5%,与本研究观点存在一定差异,可能与样本量纳入不同有关。
研究证实[13],肿瘤血管增生程度有助于反映肿瘤细胞恶性程度,是判断脑胶质瘤病理分级的重要参数。而肿瘤对11C-MET的摄取程度在评估肿瘤病理分级方面具有一定作用。SUV、T/N值是对MET-PET/CT图像分析判断的主要量化指标,其中SUV可反映组织代谢活跃程度,与细胞增殖速度、分化等均密切相关[14]。本研究通过对比发现,脑胶质瘤高级别患者SUV、T/N值显著高于低级别患者。进一步采用Spearman相关性分析,SUV、T/N值与WHO脑胶质瘤分级呈正相关,与赵晓斌等[15]研究结果基本一致。结合Qiao等[16]研究认为这可能归因于高级别脑胶质瘤中大量新生血管生成一定程度可提高血脑屏障通透性,增加毛细血管表面积,造成微血管渗漏,致使11C-MET大量进入肿瘤内,增强肿瘤对11C-MET的摄取程度,从而上调SUV、T/N值。提示MET-PET/CT技术有可能成为识别脑胶质瘤恶性生物学行为的影像学方法。
另有研究指出[17,18],在脑胶质瘤中,Ki-67增殖指数是反映肿瘤细胞增殖活性的重要生物标志物,其表达越高,表示肿瘤细胞增殖活性越强。本研究中,与低级别患者比较,高级别脑胶质瘤患者Ki-67增殖指数显著升高,与贾中正等[19]研究基本一致。但胶质瘤患者Ki-67增殖指数测量标本需通过手术或定向穿刺获取,易受肿瘤发生部位、患者身体情况等因素影响,出现一定误差。而MET-PET/CT不仅能准确评估肿瘤边界,鉴别肿瘤与周围水肿,还能利用示踪剂浓集程度,有效判断肿瘤细胞增殖状态。进一步经Pearson相关性分析可知,SUV、T/N值与脑胶质瘤患者Ki-67增殖指数存在正相关关系,这可能是由脑胶质瘤肿瘤增殖活性增强,细胞密度加大,细胞分裂增殖能力及细胞膜转换速率加快所致。有力佐证了MET-PET/CT技术有助于指导临床评估脑胶质瘤患者肿瘤细胞增殖动力。
综上,通过MET-PET/CT技术获取SUV、T/N值不仅可无创鉴别诊断脑胶质瘤分级,还能评估脑胶质瘤细胞增殖动力、恶性生物学行为,有望成为MRI诊断脑胶质瘤的重要补充手段。但由于本研究纳入样本量较少,未细化到WHO I级、Ⅱ级、Ⅲ级、Ⅳ级间的统计学分析,今后需扩大样本量做进一步深入分析。

