90Y微球选择性内放射治疗在结直肠癌肝转移中的应用及研究进展
张迎强,林岩松
1.中国医学科学院北京协和医学院北京协和医院核医学科,北京 100730;2.核医学分子靶向诊疗北京市重点实验室,北京 100730
结直肠癌(colorectal cancer,CRC)是全球发病率第3位、死亡率第2位的恶性肿瘤[1]。2015年中国癌症发病约392.9万人,其中9.88%为CRC[2](37万)。15%~25%的CRC在确诊时即合并肝转移,还有15%~25%在CRC根治术后发生肝转移(共30%~50%),而80%~90%的肝转移灶初始无法进行根治术,5年生存率低于5%,成为CRC患者的主要致死原因[3]。此类初始不可手术治疗的肝转移是CRC诊疗中的重点和难点,目前主要采用系统治疗联合局部治疗的模式进行减瘤、降期,以提高生活质量、延长生存期。
放射性核素钇-90(yttrium-90,90Y)微球微球选择性内放射治疗(selective internal radiation therapy,SIRT)在国外已有近20年的临床使用经验,大量临床研究证明了90Y微球SIRT治疗肝脏肿瘤的疗效和安全性。本文从姑息治疗和转化治疗等方面对90Y微球SIRT在CRLM治疗中的应用研究进展予以综述。
1 最新指南推荐
针对不可切除转移性结直肠癌(metastatic colorectal cancer,mCRC)患者的姑息治疗,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)在《结肠癌指南(2020年第4版)》和《直肠癌指南(2020年第6版)》均推荐肝动脉灌注化疗(hepatic artery infusion chemotherapy,HAIC)、经导管动脉内化疗栓塞(transcatheter arterial chemoembolization,TACE)及90Y微球SIRT等动脉介入治疗、消融及外放疗等治疗手段。
欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)于2016年发布的《转移性结直肠癌共识指南》将mCRC分为两大类:寡转移性疾病(oligometastatic disease,OMD)和广泛转移性疾病(metastatic disease)。OMD指“转移部位≤2个”和“总转移数目≤5个”的肿瘤,针对OMD的治疗目标是争取达到无瘤状态(no evidence of disease,NED),建议在系统性治疗的基础上考虑局部毁损性治疗(local ablative treatment,LAT)。LAT手段主要包括热力学和非热力学治疗及SIRT等动脉介入治疗。中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)发布的《结直肠癌诊疗指南(2019)》将局部治疗作为Ⅲ级推荐(图1)。
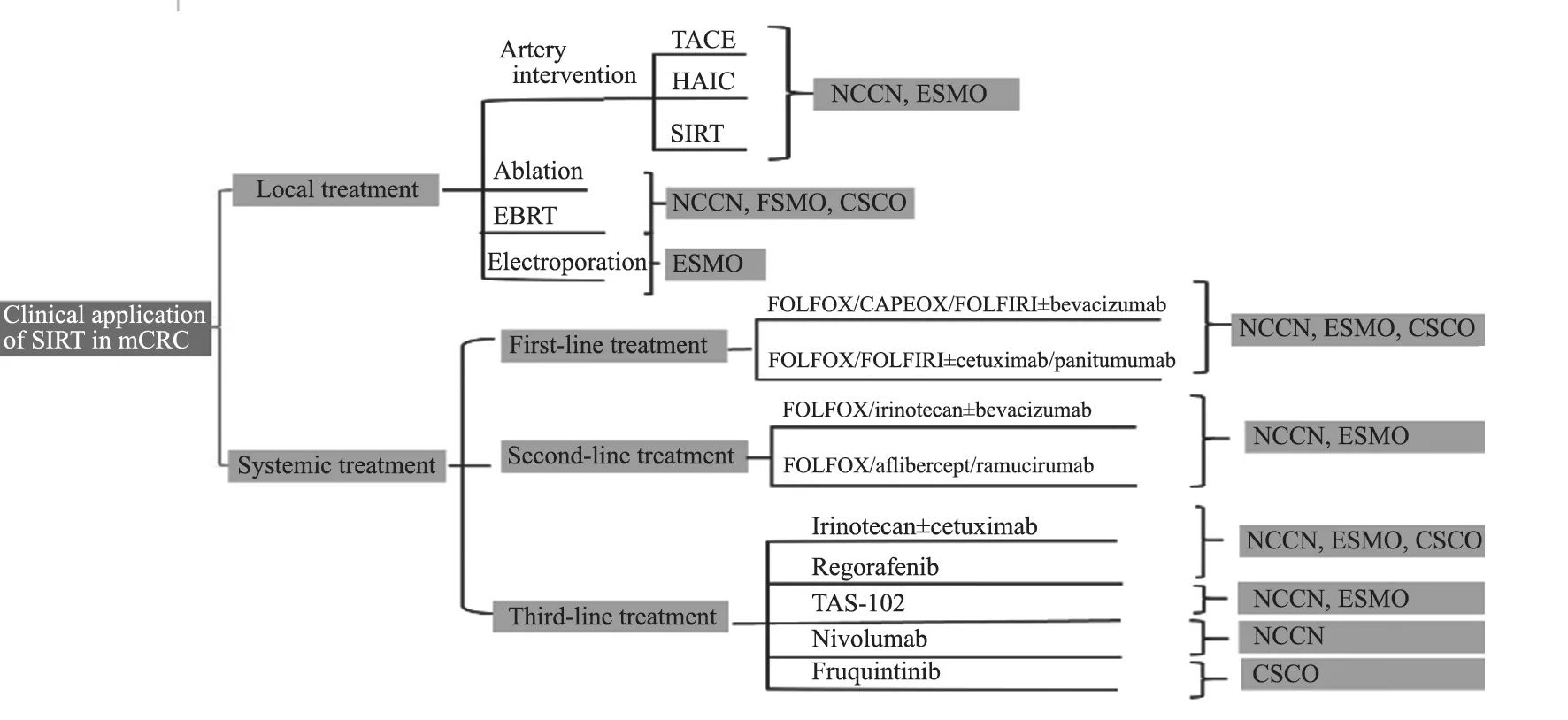
图1 指南推荐的不可手术mCRC治疗方式Fig.1 The treatments of unresectable mCRC the guidelines recommended
针对mCRC的转化治疗,NCCN建议将系统性治疗及HAIC作为不可手术mCRC的转化治疗手段。ESMO建议一线诱导治疗应选择强烈治疗,且在系统性治疗应答后联合局部治疗。CSCO对于潜在可切除组mCRC患者,Ⅰ级和Ⅱ级推荐强烈治疗,Ⅲ级推荐局部治疗。
多项指南显示局部治疗的地位日益突出。SIRT是将载有核素90Y的微球经肝动脉注入肿瘤组织,微球因无法通过肿瘤的毛细血管床而聚集在肿瘤组织,局部电离辐射剂量高达100~ 150 Gy,使瘤细胞内DNA严重受损产生强大的杀瘤效应,因90Y在肝组织中的射程仅2.5 mm,故对正常组织的损伤非常小。90Y具备作为治疗用放射性核素应具备的特性:发射纯β射线、能量高(最高2.270 MeV,平均0.937 MeV)、射程短;半衰期短,杀瘤作用强,2周释放95%的能量;稳定性好,无危害性衰变后产物;生物相容性好,能与载体稳定结合;选择性聚集,肿瘤区与非肿瘤区放射剂量比值高[4]。相比其他核素,90Y穿透距离短,防护简便,因此有报道90Y微球治疗用于门诊手术,治疗当天即可出院[5]。
基于2001年一项Ⅲ期研究[6],美国食品药品管理局(Food and Drug Administration,FDA)于2002年以上市前审批(premarket approval,PMA)方式正式批准了90Y-树脂微球用于结直肠癌肝转移(colorectal liver metastases,CRLM)的SIRT。目前在中国大陆,90Y-树脂微球正处于进口申报阶段,有望2021年获批上市。
2 SIRT在mCRC中的应用研究进展
2.1 90Y微球SIRT用于mCRC的姑息治疗
2.1.1 SIRT联合HAIC
CRLM的局部控制对预后至关重要,然而临床上已应用几十年的HAIC疗效不甚理想,急需更有效的手段。Gray等[6]自1989年起就观察到了SIRT对肝肿瘤局部控制的效果,为获取更充足的临床证据,开展了SIRT与氟脲苷HAIC联用针对mCRC的研究,与单独HAIC治疗组相比,在12 d HAIC治疗基础上联合SIRT组客观缓解率(objective response rate,ORR)显著提高(44.0%vs17.6%,P=0.010);肝脏疾病进展时间(time to progression,TTP)显著更长(15.9个月vs9.7个月,P=0.001);1、2、3、5年生存率明显提高(72.0%vs68.0%;39.0%vs29.0%;17.0%vs6.5%;3.5%vs0.0%);联合组3~4级不良反应无明显增加,患者生活质量无明显降低,证实SIRT可显著增强肿瘤控制效果。正是基于该研究中SIRT局部治疗的优势,美国FDA于2002年正式批准90Y树脂微球用于CRLM的治疗。
2.1.2 SIRT联合系统治疗
系统性治疗是控制mCRC全身疾病进展的首选,但对肝肿瘤的局部控制效果往往不佳,导致患者获益有限。前述试验中SIRT联合HAIC的临床效果显著,提示研究者可用SIRT的局部控制效果弥补系统性治疗的不足。
2.1.2.1 与一线治疗联用
为了验证SIRT在一线治疗中的效果和安全性,Van Hazel等[7]开展了SIRT与联合治疗对比单独5-FU/LV治疗以肝转移为主的不可手术mCRC的Ⅱ期临床试验。联合治疗组中位无进展生存期(progression-free survival,PFS)显著更长(18.6个月vs3.6个月,P<0.000 5),中位生存期(overall survival,OS)显著更长(29.4个月vs12.8个月,P=0.025);ORR显著升高(90.1%vs0.0%,P<0.001);联合组患者在治疗3个月以后生活状况显著改善(P=0.030),这无疑证实了SIRT与mCRC一线化疗联用的有效性。
Van Hazel等[7]的研究引起了研究者对SIRT联合化疗药物的持续关注,Sharma等[8]为明确R-SIRT与FOLFOX联用作为结肠癌肝转移患者的一线治疗的耐受性开展了一项Ⅰ期单臂临床试验。共20例患者在FOLFOX全身化疗方案中,调整奥沙利铂的剂量(30~85 mg/m2)并结合SIRT。在8例接受至60 mg/m2患者中,5例患者有3或4级不良反应,2例由SIRT引起的不良反应(心动过缓加恶心和3级腹痛)在适当处理后均改善,且未观察到由辐射引起的肝部不良反应。此研究证实了FOLFOX与SIRT联用的安全性,对后续研究具有指导意义。
为了进一步探索以FOLFOX为主的一线标准治疗联合SIRT的安全性和有效性,2006—2014年全球范围内开展了3个大型前瞻性多中心、随机、对照Ⅲ期临床研究,即SIRFLOX、FOXFIRE及FOXFIRE Global研究(n=1 103)。三项研究的meta分析中,联合治疗组ORR显著优于单独化疗组(72%vs63%,P=0.001 2),第 12个月随访时联合组肝脏疾病进展发生率显著低于单独化疗组(22%vs39%,P<0.000 1)。该结果虽再次体现了SIRT对肝肿瘤的局部控制,但主要终点(OS)未达到,分析其原因如下:①受试者未经过细致的筛选;② 两组贝伐珠单抗的使用存在差异[9]。右侧原发CRC由于起病隐匿,在发现时往往已是晚期,更易发生RAS和BRAF基因突变,无论对化疗还是靶向药都不太敏感,因此治疗手段有限,预后差。一项对SIRFLOX和FOXFIRE GLOBAL研究进行的亚组分析旨在比较肿瘤原发部位不同的患者在接受R-SIRT联合化疗后的效果,结果观察到179例右侧原发性mCRC患者的中位OS在联合治疗组显著改善,延长了 4.9个月,而两组左侧原发患者OS差异无统计学意义,提示SIRT联合一线化疗可能更有利于右侧mCRC患者[10]。
2.1.2.2 与二、三线治疗联用
对于一线治疗失败的患者,伊立替康和瑞戈非尼作为mCRC二线和三线标准治疗的选择与SIRT的联合应用也至关重要。一项单臂前瞻性研究中,使用SIRT联合伊立替康治疗5-氟尿嘧啶(5-fluorouracil,5-FU)耐受型CRLM患者与同等情况下单用伊立替康引发的不良反应接近,联合治疗的ORR为48%,PFS为6.0个月,OS为12.2个月,与既往研究中单用伊立替康的数据相比显著提升[11]。Kennedy等[12]发表的一项单臂Ⅱ期临床研究发现,既往接受过手术或全身化疗mCRC患者接受SIRT联合瑞戈非尼治疗的耐受性总体良好,中位PFS及OS分别为4和12个月,不良反应大部分为轻到中度,提示SIRT联合化疗或生物制剂作为二线、三线治疗时是安全有效的。Walter等[13]发表的mCRC三线治疗的meta分析显示瑞戈非尼、TAS102和SIRT相对于最佳支持治疗,所有治疗均有效地改善了OS。由于各组患者疾病进展程度不同,无法评价不同治疗方案疗效,但在治疗决策过程中应考虑SIRT具有较少的不良事件发生率。Wang等[14]的一项前瞻性研究中,SIRT治疗后应用durvalumab和tremelimumab治疗的mCRC患者,在两个疗程中或之后出现疾病进展,但是没有出现治疗相关的3级或以上的毒性反应。SIRT治疗前后转移灶淋巴细胞浸润水平较低。初步证实SIRT可以安全地与durvalumab和tremelimumab协同治疗,但SIRT不能促进肿瘤定向免疫应答。由于该研究样本量少,病理取材时机不固定,结论需待进一步研究证实。
2.1.2.3 在挽救性治疗中与化疗联用
许多CRLM在多线化疗后仍发生疾病进展,提高这类患者的肿瘤应答是临床治疗的重点。在一项多种化疗失败CRLM多中心随机对照试验(n=44)中,Hendlisz等[15]探索了SIRT联合5-FU化疗与单用化疗相比的疗效,结果显示,联合组疾病控制率(disease control rate,DCR)显著升高(86%vs35%,P=0.001),肝特异性PFS显著延长(5.5个月vs2.1个月,P=0.003),其中1例患者接受联合治疗后肿瘤缩小至可切除。该研究进一步证实了SIRT增强局部控制提升化疗效果的显著作用,作为临床证据纳入2012年NCCN指南及2014年ESMO指南,并作为针对化疗难治性CRLM的后续治疗推荐。
2.1.3 SIRT在mCRC中的单用
许多mCRC患者穷尽治疗手段只能接受最佳支持治疗,预计生存时间极短,渴望新的治疗选择。针对化疗耐药、缺乏治疗选择以肝转移为主的患者,Bester等[16]开展了SIRT对比最佳支持治疗的回顾性队列研究,结果显示,接受SIRT治疗的mCRC患者中位OS(n=51)显著延长(11.9vs6.6个月,P=0.001)。这提示除前述联合应用之外,SIRT在化疗耐药mCRC的单独应用也能为患者带来获益,是挽救性治疗患者的新希望。
2002年,Kennedy等[17-18]开展了SIRT治疗经多线治疗后不可切除mCRC的大样本量真实世界研究(MORE研究,n=606),2015年和2017年有关MORE研究的两次分析结果显示,接受过≥3线化疗的患者仍可从SIRT中获益。肝外转移及肝脏受累程度、肝功能水平、白细胞计数和既往化疗次数等是影响SIRT治疗OS获益的独立变量。这项真实世界研究提示SIRT可为无法切除的mCRC患者在多线治疗后带来生存获益。
基于以上证据,NCCN指南近年针对化疗失败或难治、以肝转移为主的mCRC,以2A推荐90Y微球SIRT等肝动脉介入治疗。
2.2 90Y微球SIRT用于mCRC的转化治疗
无法进行CRLM根治术是制约患者生存的主要原因,将不可切除的肝肿瘤转化为可切除是改善预后的关键,也是多年来肝肿瘤的研究热点。通过对1998年1月—2017年8月所有关于不可手术mCRC患者进行SIRT治疗的文献回顾发现,先前不可手术的802例患者中有13.6%在治疗后可进行手术[19]。在2017年,Garlipp等[20]对SIRFOLX采用双盲影像评估该随机对照研究中无法切除的mCRC经治疗后潜在治愈的可能(REsect研究),结果显示,在基线资料评估中,化疗联合SIRT组和单独化疗组技术上可切除的比例差异无统计学意义(11.9%vs11.0%,P=0.775);而在最佳肿瘤反应时的随访评估中,联合组可切除患者显著增加(38.1%vs28.9%,P<0.001),表明SIRT可提高患者接受根治术的概率。
目前门静脉栓塞术是针对余肝较小的患者接受切除术前的标准治疗,栓塞一侧肝叶迫使血液流向对侧,使其代偿性增大,增加功能正常的肝组织储备。Garlipp等[21]发现使用SIRT在治疗肝脏肿瘤时,也存在相似作用机制诱导肝体积增加。2016年ESMO指南推荐SIRT用于未来可能进行肝切除但预计切除后剩余肝体积不足患者的辅助治疗。
2.3 90Y微球SIRT治疗的不良反应及毒性
在应用90Y微球SIRT治疗的患者中,约一半的患者会出现不同程度的不良反应,均可以自行缓解,无需改变护理策略。Kurilova等[22]的一项单中心研究,81例患者进行了146例次90Y微球SIRT治疗,中位随访时间为9.1个月。全血细胞分析结果未显示存在骨髓抑制的证据。36例次患者出现乏力、腹痛腹胀、恶心、呼吸急促、发热等反应,均为1~2级不良反应。11例次患者出现了3~4级腹痛、发热、呼吸困难等不良反应,仅给予定期临床访视评估。
SIRT应用过程中由于异常放射性微球沉积,可造成脏器局部损伤,其中以放射性肝脏损伤常见。Kokabi等[23]在39例患者中开展SIRT治疗,其中14例发生2级肝功能损害,4例发生3级肝功能损害,但未发生更严重的肝脏功能损害。90Y微球栓塞于肺动脉造成放射性肺炎的不良反应仅见个别病例报道[24],该并发症很少发生,且可以通过肺血流灌注显像预测并 避免。
2.4 90Y微球SIRT疗效影响因素
Wu等[25]回顾性分析了应用90Y微球SIRT治疗的左、右侧结肠癌患者的预后以及预后与肿瘤反应的关系。研究纳入左侧结肠癌患者74例,右侧结肠癌25例。与左侧原发患者相比,右侧原发患者治疗后OS略低(5.4个月vs6.2个月,P=0.02)。van Roekel等[26]分析了90例CRLM患者对90Y微球SIRT治疗后3个月的反应,发现在基线时未出现肝外转移的患者组中,疾病进展率明显减少(63%vs93%,P=0.001 6)。伴有肝外疾病患者的中位OS为6.5个月,而无肝外疾病患者的中位OS可达10个月,提示基线时有肝外疾病的患者比无肝外疾病的患者预后更差。Dabrowiecki等[27]回顾性分析了从2013—2018年进行90Y微球SIRT治疗的mCRC患者,发现无基因突变、MELD评分低、肿瘤负荷低、美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分为0是延长一线化疗失败后接受90Y微球SIRT治疗患者的OS的独立预测因素。
3 结论
20余年的探索证实了90Y微球治疗CRLM的疗效和安全性。基于近年不断增加的临床获益证据,90Y微球SIRT已被国际指南推荐用于不可手术的mCRC患者的姑息治疗或转化治疗,成为肝脏恶性肿瘤重要的治疗选择(图2)。在与其他药物联用,特别是与免疫治疗联用的价值有待进一步探索。
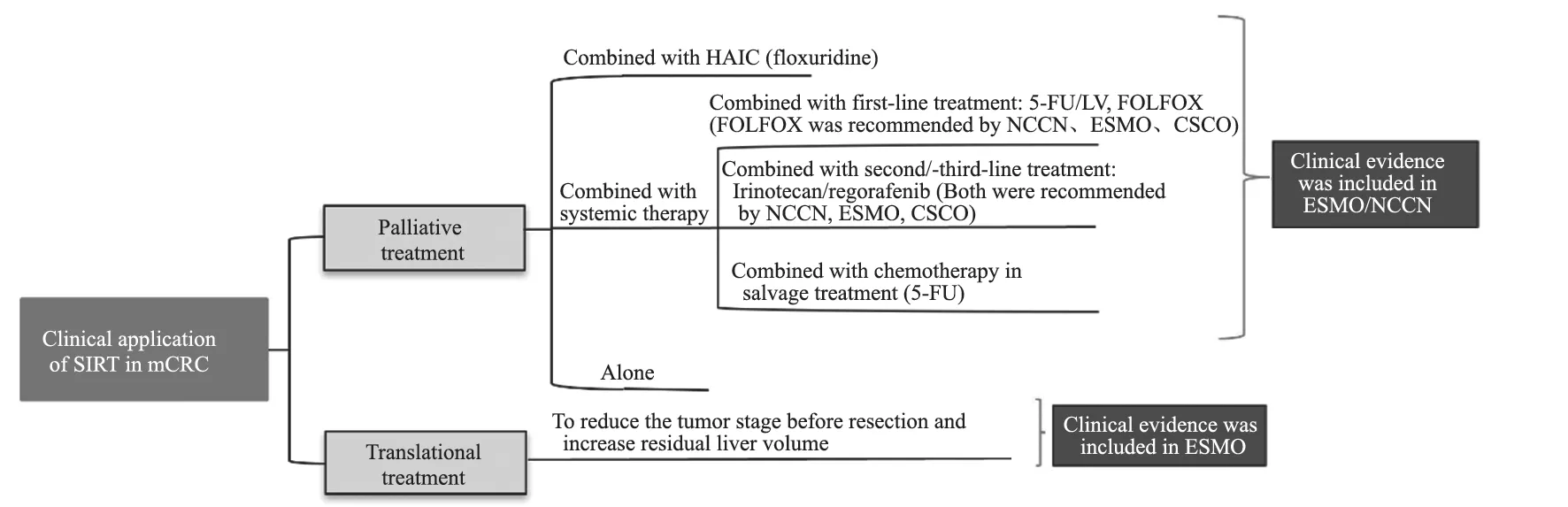
图2 SIRT在mCRC中的临床应用总结Fig.2 The summary of clinical application of SIRT in mCRC

