Circ_0007142吸附miR-647调控CCR8基因 促进胃癌细胞的上皮-间质转化和侵袭
张学成,关晓辉
1.吉林市中心医院消化科,吉林 吉林 132000;2.北华大学附属医院消化内科,吉林 吉林 132000
胃癌发病率和死亡率高,是具有高度侵袭性和转移性的恶性肿瘤之一[1]。手术治疗、化疗、靶向治疗是目前治疗胃癌的有效方法[2]。胃癌具有高转移和侵袭的特征,因此晚期患者的治疗效果不佳[3]。所以,加深对胃癌的认识,在分子水平上探讨发病机制,寻找新的治疗靶点显得尤为重要。
环状RNA(circRNA)因其不易被核酸外切酶降解的特性而备受关注,能在体内保持稳定,具有作为疾病诊断标志物的巨大潜力[4]。近年来,研究[5]发现circRNA可以作为癌症的启动因子,例如circ-UMAD1在甲状腺癌患者的血清中表达相对较高,具有较高的生物标志物潜能。Circ_0003829在口腔鳞癌中表达降低,受试者工作特征(receiver operating characteristic,ROC)曲线分析circ_0003829在口腔鳞癌中具有较高的敏感性,可以作为口腔鳞癌诊断的生物标志 物[6]。同样,circRNA也可以作为胃癌的启动因子,例如circ_0005556、circ-RNF111都可以促进胃癌的发展[7-8]。Circ_0007142作为最新发现的circRNA,被鉴定为结直肠癌的致癌基因,能促进结直肠癌的进展[9],但在胃癌中的作用目前还没有被揭示。
经研究[10]发现,circRNA可以作为竞争性内源RNA,海绵化microRNA,进而调节下游靶基因,参与疾病的发展。在食管癌中circ_0008717通过调控miR-203/Slug来促进癌细胞的增殖、侵袭和迁移[11]。microRNA是一类短链RNA,属于非编码RNA的一个亚类,经常被视为抑癌基因并结合上游circRNA来进行研究,Xu等[12]在关于结直肠癌的研究中发现circRNA DSCAM-AS1通过miR-137/Notch1促进癌症发展,miR-137可以逆转DSCAM-AS1对结直肠癌的促进作用。Ma等[13]认为血清中miR-647的降低与胃癌患者的不良预后相关。但circ_0007142结合miR-647在胃癌中的作用尚未被证实,另外有研究[14]发现,miR-647的下游存在靶基因CC族趋化因子受体8(CC chemokine receptor 8,CCR8),抗CCR8治疗可以有效地抑制小鼠结肠癌肿瘤的生长。此外也有研究[15]表明胃淋巴瘤中CCR8表达上调。
根据以上发现,本研究探讨circ_0007142吸附miR-647调控CCR8在胃癌发展过程中的生物学作用,旨在为胃癌的靶向治疗提供新的依据。
1 材料和方法
1.1 细胞系与材料
GES-1细胞、AGS细胞、SNU-16细胞、GES-1细胞专用培养基、AGS细胞专用培养基均购自宁波明舟生物科技有限公司。TRlzol分离试剂、高容量cDNA反转录试剂盒、实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)试剂盒、7500 Fast RTFQ-PCR系统、LipofectamineTM3000试剂、PVDF膜均购自美国Thermo Fisher Scientific公司。荧光原位杂交(fluorescencein situhybridization,FISH)实验试剂盒购自上海歌凡生物科技有限公司。双荧光素酶报告基因检测试剂盒购自上海翊圣生物科技有限公司。pmirGLO双萤光素酶报告基因载体质粒、HEK-293T细胞均购自BioVector中国质粒载体菌株细胞株基因保藏中心。RIP试剂盒购自广州吉赛生物科技股份有限公司。Matrigel基质胶购自上海前尘生物科技有限公司。Transwell小室购自美国Corning公司。荧光显微镜购自徕卡显微系统(上海)有限公司。0.1%结晶紫染色、0.5%结晶紫染色、RIPA裂解液均购自北京索莱宝科技有限公司。
1.2 临床组织与实验动物
从北华大学附属医院获取2018年3月—2020年4月就诊的胃癌患者的癌组织与邻近癌旁正常组织48组(距离原发灶边缘4.0~6.5 cm),其中男性患者25例,女性患者23例,TNM分期为:Ⅰ~Ⅱ期患者28例,Ⅲ期患者20例。参与该研究的所有患者承诺之前从未接受过任何放疗及化疗,并签署知情同意书。本实验严格遵守北华大学附属医院伦理委员会的要求。获取的组织存放于液氮中进行保存。20只SPF级BALB/c无菌裸小鼠,5周龄,质量为(19±2)g,购自江苏集萃药康生物科技股份有限公司。
1.3 细胞培养和转染
本研究使用人正常胃黏膜细胞GES-1和人胃癌细胞系AGS、SNU-16进行实验,GES-1细胞使用RPMI-1640培养基+10%胎牛血清+1%青霉素链霉素混合液进行培养,AGS、SNU-16细胞使用F-12培养基+10%胎牛血清+1%青霉素及链霉素混合液进行培养。所有细胞在37 ℃、CO2体积分数为5%的环境中培养,1 d后更换新鲜培养基,继续进行培养。
当细胞培养到70%左右融合度,按照实验分组进行转染,siRNA质粒载体、miRNA抑制剂、miRNA过表达载体均来自上海吉玛基因有限公司,体外实验分组为si-NC、si-cicr_0007142、miR-647 NC、miR-647 mimic、si-cicr_0007142+inhibitor NC、si-cicr_0007142+miR-647 inhibitor、miR-647 mimic+vector、miR-647 mimic+OE-CCR8;体内实验分组为si-NC、si-cicr_0007142。制备细胞悬液,植入96孔板中,使用LiopfectamineTM3000转染试剂进行转染,步骤按照试剂盒出厂说明书进行。
1.4 RTFQ-PCR
根据试剂盒要求使用TRIzol试剂提取样本中的总RNA,并对RNA的浓度、纯度进行检测。根据高容量cDNA反转录试剂盒的要求将总RNA合成第一链cDNA。引物由苏州金唯智生物科技有限公司提供(表1)。最后根据RTFQ-PCR试剂盒要求,在7500 Fast实时荧光定量PCR系统上进行检测。相对表达量使用2-ΔΔCt计算,U6将miRNA进行标准化,GAPDH将circRNA和CCR8标准化。
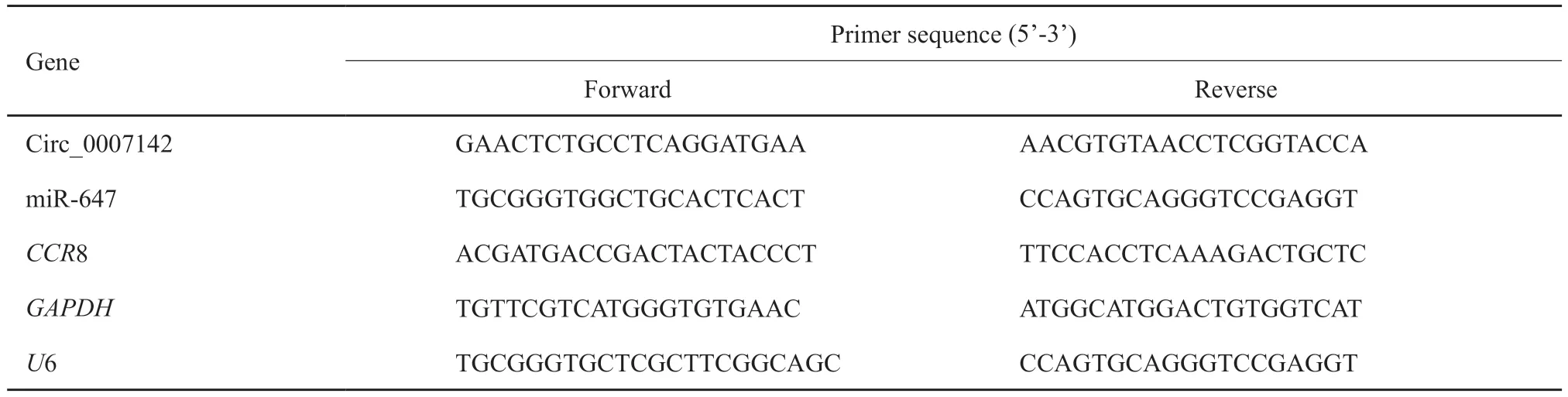
表1 RTFQ-PCR引物序列Tab.1 RTFQ-PCR primer sequences
1.5 FISH实验
样本在4%多聚甲醛室温下固定30 min,DEPC水洗并干燥,30%H2O2+纯甲醇对样本进行处理,再滴加0.25%的HCl溶液,15 min后用DEPC水洗。样本加入蛋白酶K反应20 min,用0.1 mol/L甘氨酸洗液终止反应。PBS水洗后用4%PFA多聚甲醛进行再固定,5×SSC水洗后加入预杂交液65 ℃反应1 h。加入500 ng/mL digoxigenin-labeled probe探针,暗室中65 ℃温育48 h,用封闭液温育30 min,加入生物素化鼠抗地高辛抗体,37 ℃温育1 h,加入FITC 标记抗体,暗室下37 ℃温育 30 min,DAPI染核,封片,荧光显微镜下观察染色结果。
1.6 双荧光素酶报告基因实验
构建circ_0007142与CCR8基因的野生型片段,命名为circ_0007142-WT、CCR8-WT,将野生型基因片段使用内切酶位点SpeⅠ和Hind Ⅲ扩增插入到pmirGLO双萤光素酶报告基因载体上。在circ_0007142-WT、CCR8-WT的野生型片段上设计种子序列的互补序列突变位点,命名为circ_0007142-MUT、CCR8-MUT,利用限制性内切酶与T4 DNA连接酶将突变型基因片段扩增插入到pmirGLO载体上。将这些报告质粒与miR-647 NC或miR-647 mimic使用LipofectamineTM3000试剂共转染到HEK-293T细胞中,48 h后收集细胞并进行充分裂解,离心后取上清液加入荧光素酶反应试剂,再加入细胞裂解液,最后测量萤火虫荧光素酶活性,并以肾素荧光素酶活性为标准化参考。以上详细步骤均按照试剂盒说明书进行。
1.7 RNA结合蛋白免疫沉淀(RNA-binding protein immunoprecipitation,RIP)实验
应用RIP试剂盒验证circ_0007142与miR-647、CCR8与miR-647的靶向关系。将细胞使用PBS水洗以后,裂解,收集裂解液进行实验,最后使用RTFQ-PCR检测circ_0007142、miR-647、CCR8的丰度。详细实验步骤按照RIP试剂盒出厂说明书进行严格操作。
1.8 Transwell实验
将冷冻的Matrigel基质胶融化,加入无血清培养基进行稀释,稀释液添加到transwell小室的上室,以5×104个细胞/孔的密度植入到上室的 24孔板中,并添加无血清培养基,下室则添加含有10%胎牛血清的培养基,37 ℃下温育24 h,多聚甲醛固定细胞,0.1%结晶紫染色,在显微镜下观察细胞侵袭数量。
1.9 克隆形成实验
将细胞植入6孔板,每孔5×103个细胞,置于培养箱中培养14 d,每3 d更换新培养基。培养结束后经PBS洗涤、乙醇固定后,使用0.5%结晶紫进行染色。最后在显微镜下观察细胞集落形成数量。
1.10 Western blot检测
RIPA裂解液将细胞分离提取蛋白,加入PMSF调整浓度,使用BCA定量试剂盒按照说明书要求检测蛋白浓度;蛋白在10%十二烷基硫酸钠聚丙烯酰胺凝胶中电泳分离,然后将其转移到PVDF膜上,再加入5%脱脂牛奶进行封闭。加入一抗vimentin(1∶2 000)、E-cadherin(1∶500)、N-cadherin(1∶500)、GAPDH(1∶1 000)与膜4 ℃过夜温育,使用TBST进行冲洗,加入HRP标记的山羊抗兔二抗IgG(1∶ 1 000),室温下温育1 h。加入ECL使蛋白信号可视化,在Image J软件上进行分析。
1.11 免疫组织化学实验
石蜡切片并脱蜡至水,加入3%H2O2温育以灭活内源性过氧化物酶。蒸馏水和PBS冲洗,微波抗原修复,血清封闭后加入一抗CCR8,4 ℃温育过夜,PBS冲洗后加入生物素标记的二抗,室温温育30 min后PBS冲洗,DAB显色,自来水冲洗、脱水、透明并封片,显微镜下拍照。借助Image J软件对染色结果进行半定量分析,计算阳性表达率。
1.12 裸小鼠移植瘤实验
BALB/c裸小鼠被安置在无菌环境中饲养。对癌细胞分别转染si-NC、si-circ_0007142,之后再将细胞注射到裸小鼠右侧皮下,每隔4 d测量1次皮下肿瘤体积。35 d以后,注射异氟醚麻醉裸小鼠,断颈处死,取出肿瘤后拍照、测量体积并称重。
“不要再说啦,她的亏,我这一生吃够了,再不要在我面前提她!”说罢,蒋浩德起身要走,身体摇晃了两下,紫云一把抱住他。他回过神来,眼睛直直地望着紫云,感受到来自女人的体温,差点窒息。
1.13 统计学处理
本实验数据采用SPSS 22.0软件完成统计学分析,体外实验重复进行3次,所得结果用表示;两组间符合正态分布则采用t检验,多组间采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 Circ_0007142在胃癌组织和细胞中高表达
通过RTFQ-PCR检测circ_0007142在胃癌组织和细胞中的表达,结果显示,与癌旁组织相比,胃癌组织中circ_0007142显著高表达(P<0.05,图1A)。与GES-1细胞相比,胃癌细胞系AGS、SNU-16中circ_0007142的表达都显著升高(P均<0.05,图1B),其中AGS细胞的表达(3.47±0.29)比SNU-16(2.98±0.21)高,因此本研究选择AGS细胞进行后续功能实验。ROC曲线分析显示,circ_0007142可作为胃癌诊断的一个重要指标(AUC=0.859 8,P<0.000 1,图1C)。通过分析circ_0007142的表达与临床病理学特征的相关性可见,circ_0007142高表达与TNM分期和肿瘤浸润深度相关(P均<0.05,表2)。以上实验结果表明,circ_0007142高表达可能与胃癌发展相关。
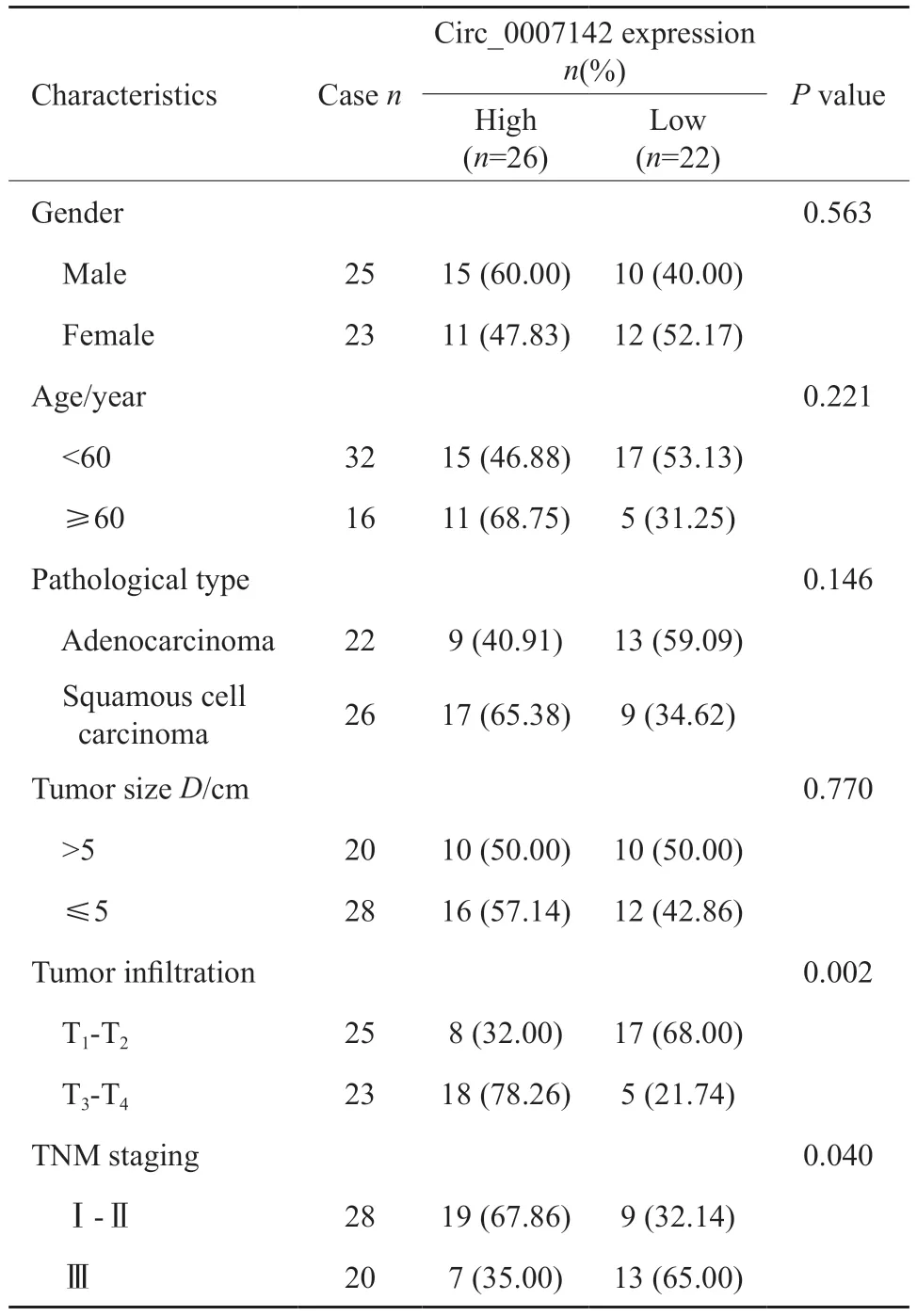
表2 Circ_0007142的表达与胃癌患者临床病理特征关系Tab.2 Relationship between expression of circ_0007142 and clinicopathological features in patients with gastric cancer
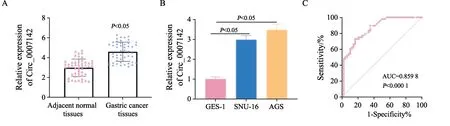
图1 RTFQ-PCR检测circ_0007142的表达Fig.1 RTFQ-PCR was adopted to detect the expression of circ_0007142
2.2 敲减circ_0007142抑制胃癌细胞的克隆形成、侵袭和EMT
通过克隆形成实验、transwell、Western blot检测探讨circ_0007142表达水平对胃癌细胞生物学行为的影响。结果表明,与si-NC组相比,si-circ_0007142组细胞的集落形成与侵袭均被抑制(P均<0.05,图2A、B)。与si-NC组相比,si-circ_0007142组细胞中vimentin与N-cadherin的蛋白水平均下调,而E-cadherin的蛋白水平上调(均P<0.05,图2C)。以上实验说明,敲减circ_0007142的表达能够抑制胃癌细胞的集落形成能力与侵袭,并且抑制EMT的形成,进而参与胃癌的进展。
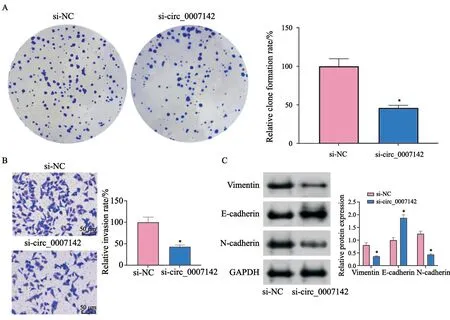
图2 敲减circ_0007142的表达能够抑制胃癌细胞恶性生物学行为Fig.2 Knockdown of circ_0007142 expression inhibits the malignant biological behavior of gastric cancer cells
2.3 在胃癌细胞中,circ_0007142可以吸附miR-647
FISH实验结果显示,circ_0007142在细胞质和细胞核均有表达,但主要定位于细胞质(图3A)。Circular RNA Interactome(https://circinteractome.nia.nih.gov/index.html)网站中发现miR-647与circ_0007142存在结合位点,同时设计了circ_0007142的突变位点(图3B),之后通过双荧光素酶报告基因和RIP实验验证了miR-647和circ_0007142之间的靶向作用关系,结果显示,与circ_0007142-WT+miR-647 NC组相比,circ_0007142-WT+miR-647 mimic组细胞的荧光素酶活性显著降低(P<0.05),而circ_0007142-MUT+miR-647 NC组与circ_0007142-MUT+miR-647 mimic组的荧光素酶活性无显著变化(P>0.05)。RIP实验结果显示,与miR-647 NC组相比,circ_0007142在miR-647 mimic组的Ago2抗体上富集更多,circ_0007142与miR-647的靶向关系得到证实(图3C、D)。通过RTFQ-PCR发现miR-647在胃癌组织中表达较正常组织降低(P<0.05,图3E),此外,miR-647在胃癌细胞中的表达较正常细胞同样降低(P<0.05,图3F),胃癌组织中miR-647的表达与circ_0007142呈负相关关系(r=-0.7514,P<0.000 1,图3G),且敲减circ_0007142能够诱导miR-647的表达(P<0.05,图3H)。以上实验结果表明circ_0007142可以作为分子海绵吸附miR-647而发挥作用。
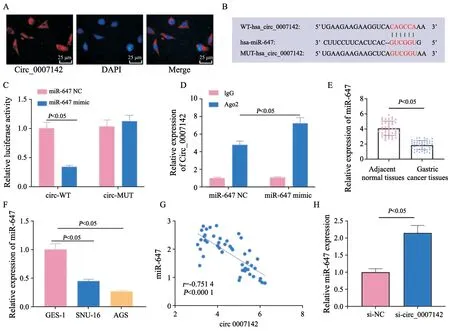
图3 Circ_0007142可以作为分子海绵吸附miR-647Fig.3 Circ_0007142 absorbs the expression of miR-647 as a molecular sponge
2.4 miR-647抑制剂可以部分挽救沉默circ_0007142对胃癌细胞的作用
对circ_0007142通过miR-647调控胃癌细胞的生物学行为进行研究,结果表明si-circ_0007142转染对胃癌细胞的克隆形成、侵袭和EMT有抑制作用,但该作用被miR-647 inhibitor部分挽救(P均<0.05,图4A~C)。
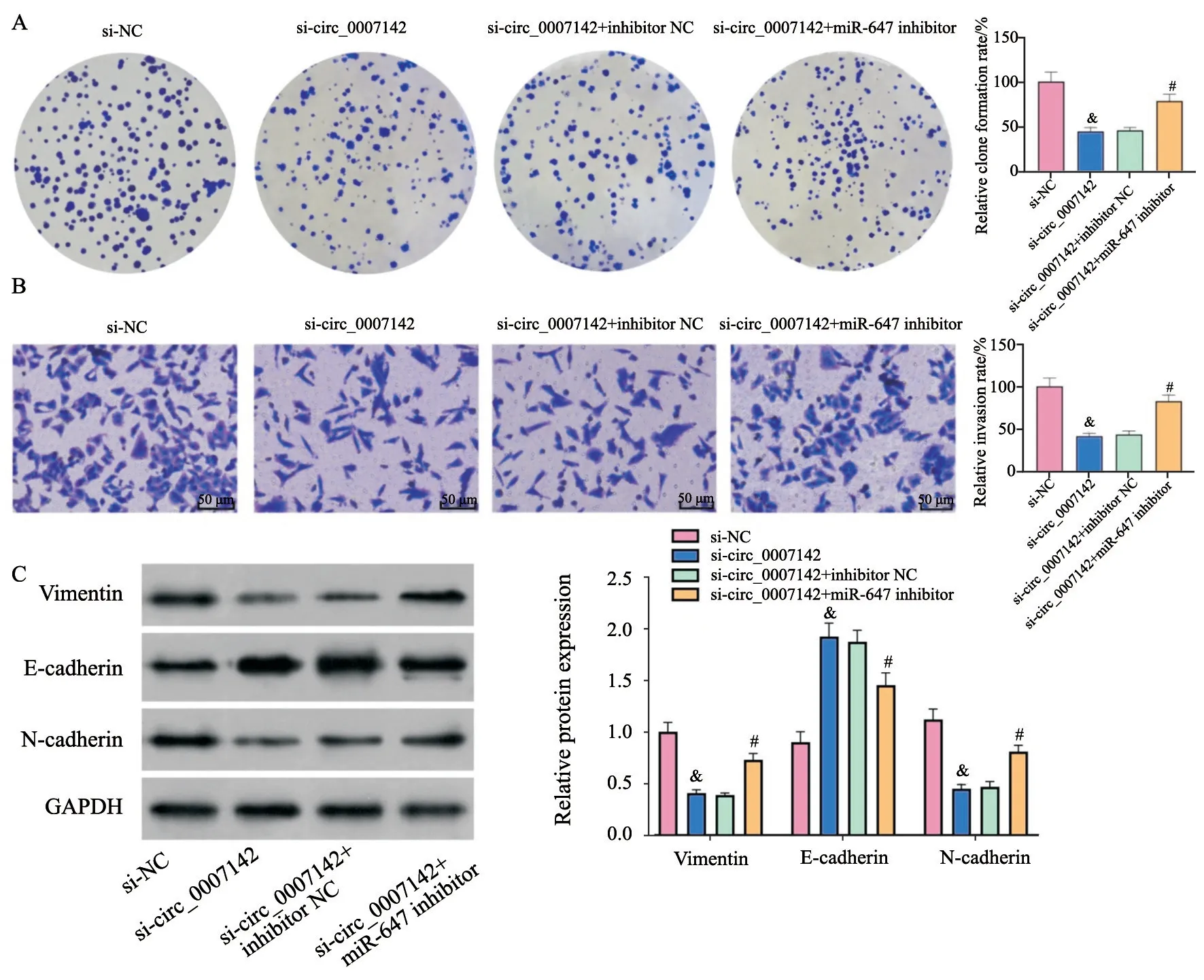
图4 各组细胞克隆形成、侵袭和EMT相关因子表达Fig.4 Clone formation,invasion and expressions of EMT related factors in each group of cells
2.5 CCR8是miR-647的下游靶点且在胃癌组织和细胞中表达增强
在TargetScan(http://www.targetscan.org/vert_71/)数据库中发现CCR8与miR-647存在结合位点,同时设计CCR8的突变位点(图5A)。双荧光素酶报告基因实验显示,与CCR8-WT+miR-647 NC组相比,CCR8-WT+miR-647 mimic组细胞的荧光素酶活性下调(P<0.05),CCR8-MUT+miR-647 NC组与CCR8-MUT+miR-647 mimic组的荧光素酶活性差异无显著变化(P>0.05)。RIP实验结果显示,与miR-647 NC组相比,CCR8在miR-647 mimic的Ago2抗体上富集更多(P<0.05)。CCR8与miR-647的互作用关系被证实(图5B、C)。结合GEPIA(http://gepia)数据库与UALCAN(http://ualcan.path.uab.edu/index.html)数据库发现CCR8在胃癌组织中高表达(图5D、E)。RTFQ-PCR和免疫组织化学检测结果显示与网站预测结果一致,CCR8在胃癌组织中的表达高于正常组织(P<0.05,图5F、G),在胃癌细胞中也得到同样的结果(P均<0.05,图5H),相关性分析显示,CCR8的mRNA表达与miR-647表达呈负相关(P<0.000 1,图5I)。RTFQ-PCR检测干预miR-647的表达对CCR8的影响,结果显示,过表达miR-647能够显著抑制CCR8的表达(P<0.05,图5J)。相对于inhibitor NC组,敲减miR-647的表达能够诱导CCR8表达增强,但该作用被 si_circ_0007142部分挽救(P均<0.05,图5K)。以上实验结果说明,CCR8是miR-647的下游靶点,circ_0007142能够作为分子海绵吸附miR-647进而调控CCR8的表达。
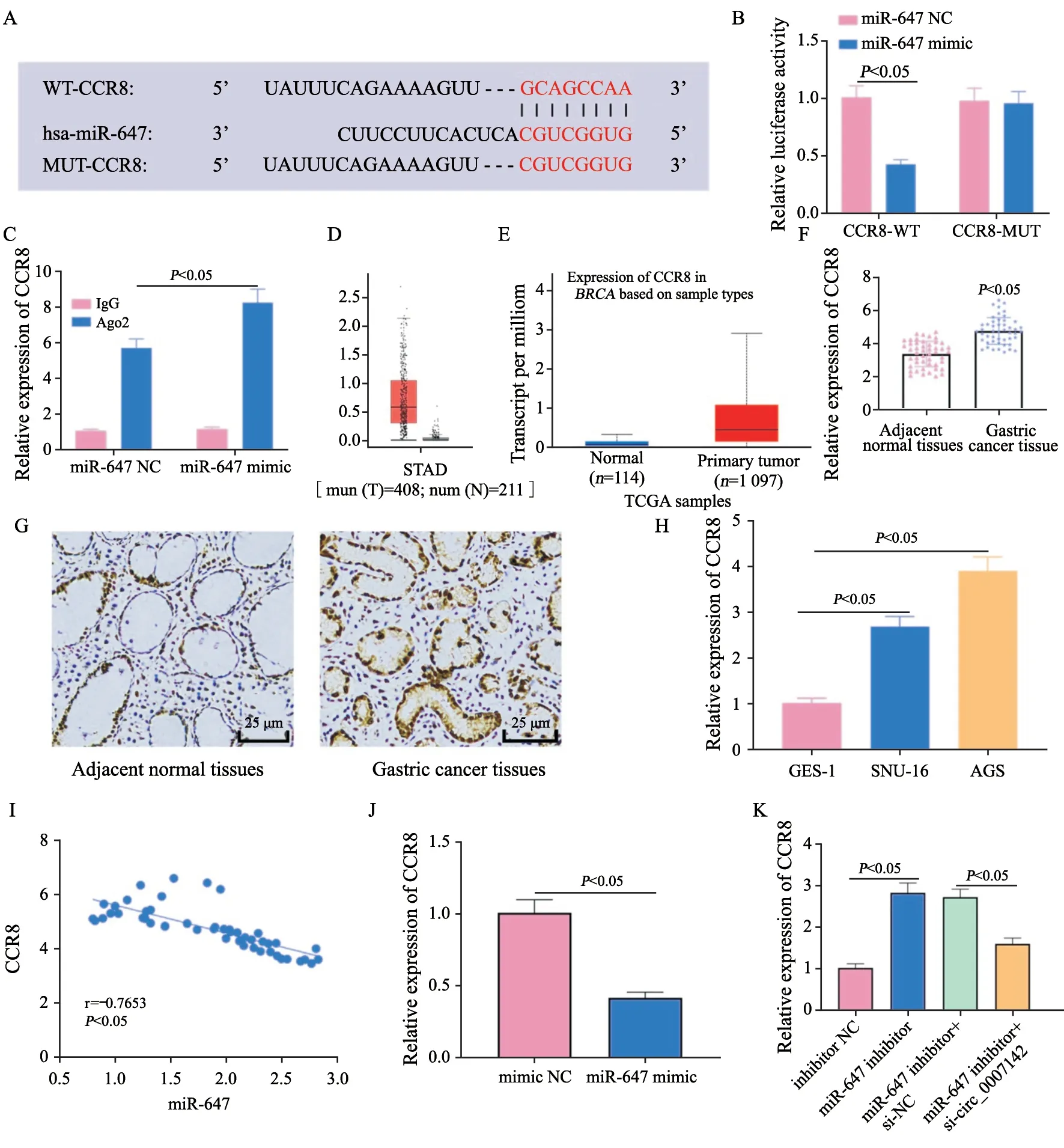
图5 CCR8是miR-647的下游靶基因且其表达受circ_0007142的调控Fig.5 CCR8 was a downstream target gene of miR-647 and its expression was regulated by circ_0007142
2.6 过表达CCR8可以部分挽救上调miR-647对胃癌细胞的作用
通过克隆形成实验、transwell、Western blot实验分析CCR8是否能影响miR-647调控的胃癌细胞生物学行为。结果发现,miR-647 mimic能够抑制胃癌细胞的克隆形成、侵袭和EMT,但该作用被OE-CCR8部分挽救(P均<0.05,图6)。
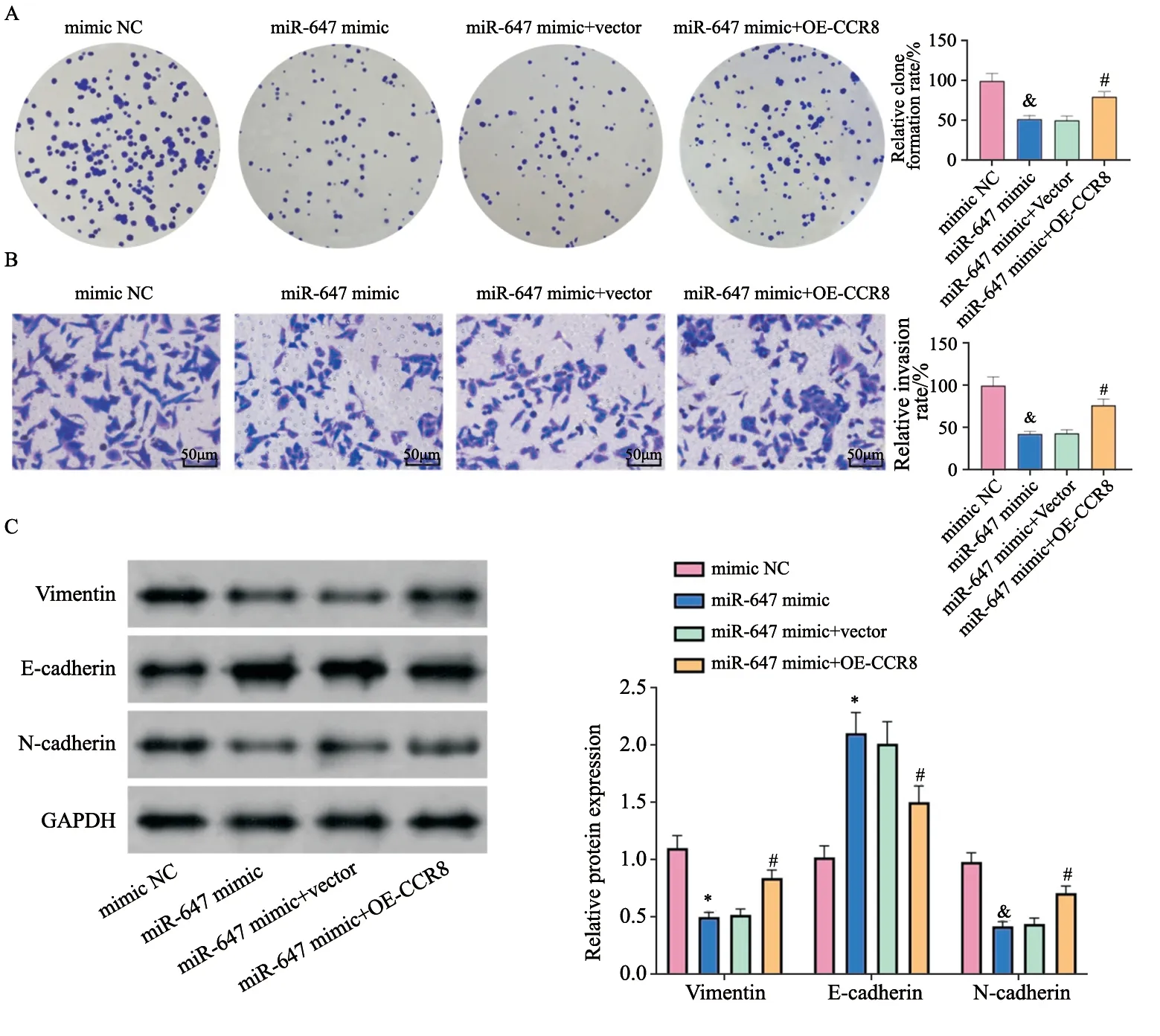
图6 各组细胞克隆形成、侵袭和EMT相关因子表达Fig.6 Clone formation,invasion and expressions of EMT related factors in each group of cells
2.7 敲减circ_0007142可以抑制裸小鼠体内成瘤能力
本研究通过体内实验进一步验证circ_0007142对胃癌的作用。在小鼠体内注射转染了si-NC、si-circ_0007142的癌细胞,结果发现si-circ_0007142组肿瘤的体积和重量均比si-NC组低(P<0.05,图7A~C)。以上实验数据说明,敲减circ_0007142可以抑制裸小鼠体内成瘤能力。本研究机制图见图7D。
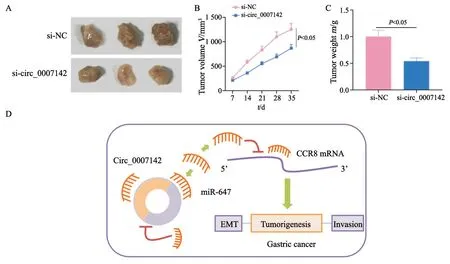
图7 敲减circ_0007142可以抑制裸小鼠体内成瘤能力Fig.7 Knockdown of circ_0007142 inhibits tumorigenesis in nude mice
3 讨 论
胃癌的发病机制复杂,细胞生物学、分子生物学等都参与其中,在高通量测序技术与生物信息学分析高速发展的今天,对circRNA在疾病中作用的研究已经成为一大热点。EMT伴随上皮细胞标志物E-cadherin表达被抑制、间充质表型标志物vimentin与N-cadherin表达被促进,这个过程使细胞具有转移和侵袭的能力,对于癌症原发灶转移有重要的意义[16]。
CircRNA在胃癌中关于EMT和侵袭转移的机制已有研究,Jin等[17]经过研究发现,沉默circ_0101145的表达通过调节miR-548c-3p/LAMC2轴抑制肝癌EMT。Circ_0007142作为本次的研究对象,曾被发现在肺腺癌和结直肠癌中均可促进癌细胞的增殖、迁移和侵袭[18-19]。本研究发现,circ_0007142在胃癌组织中呈高表达,并且功能实验显示,沉默circ_0007142可以抑制癌细胞的集落形成、侵袭和EMT,并且在体内实验中沉默circ_0007142能抑制肿瘤的生长与EMT。通过之前研究得知,circRNA可以与miRNA竞争式结合,下调miRNA的表达。借助生物学信息网站寻找circ_0007142的下游靶点,进一步选中miR-647,并使用双荧光素酶报告基因实验验证二者的靶向关系。miR-647之前被报道在胃癌耐药细胞中低表达,miR-647过表达可以降低胃癌细胞的迁移和侵袭能力[20]。Cao 等[21]通过研究认为miR-647在体内和体外均对胃癌的发展有抑制作用。本研究发现,miR-647在胃癌组织中低表达,并与circ_0007142的表达呈负相关,沉默circ_0007142对胃癌细胞的作用也可以被miR-647抑制剂部分逆转。
分析miR-647的下游靶基因发现,CCR8与miR-647之间具有相互作用。趋化因子是一类信号蛋白,可以诱导细胞定向趋化,参与血细胞发育、血管形成、细胞凋亡等过程,在肿瘤的发展、转移、炎症感染等过程中都发挥着重要作用[22]。在对浸润性膀胱癌的研究中发现,CCR8水平高与免疫耐受相关,高水平的CCR8预示着预后差,化疗效果差[23]。Li等[24]通过研究得出结论,CCR8可以作为预测胃肠道间质瘤的生物标志物,其高表达与恶性程度、不良预后相关。基于此,本研究在生物学网站中检索到CCR8在胃癌组织中高表达,借助实验进一步证实CCR8在胃癌组织中高表达。并且发现,在胃癌组织中,CCR8与miR-647的表达呈负相关,过表达CCR8可以部分抵制上调miR-647带来的影响。
基于以上分析,本次研究证明circ_0007142可能会通过miR-647/CCR8轴参与胃癌的发展,为胃癌的预防与治疗探索到新的有潜力的诊断标志物。

