铜卟啉金属有机框架材料用于高性能锂硫电池
万思成 熊冰清 潘园园 邱常鼎 柯福生
(武汉大学化学与分子科学学院,武汉 430072)
0 引言
随着科技的进步和生活水平的提高,人们对便携式电子设备和纯/混合动力汽车的需求快速增长,因此开发具有高能量和高功率密度的下一代锂离子电池(lithium‑ion batteries,LIBs)迫在眉睫[1]。然而,LIBs能量密度的提升受限于正极材料[2]。锂硫电池具有1 675 mAh·g-1的理论比容量、2 600 Wh·kg-1的能量密度和硫资源丰富等优势成为后锂离子时代的研究热点和重点之一[3]。但是锂硫电池在充放电过程中产生的中间产物多硫化锂(lithium poly‑sulfides,LiPSs)易溶解于电解液中,并引发一系列问题,如多硫离子的“穿梭效应”、金属锂腐蚀和电解液黏度增大等[4‑5]。
针对上述问题,多孔碳[6]、聚合物[7]、金属化合物[8‑11]、金属有机框架材料(metal organic frameworks,MOF)[12‑13]、共价有机框架材料(covalent organic frame‑works,COF)[14]等各种材料被开发作为硫载体。其中,MOF作为一种新型的多孔材料,因其高的比表面积、大的孔体积、可调节的孔径和丰富的化学环境而受到人们的广泛关注。MOF丰富的Lewis酸位点和官能团为LiPSs提供了大量的化学锚定中心,可有效缓解 LiPSs的穿梭效应[15‑18]。然而,Lewis酸位点的金属节点在吸附LiPSs后会影响MOF结构的稳定性,如HKUST‑1等在循环过程中和LiPSs反应导致MOF结构坍塌[19‑20]。因此需要选择在锂硫体系中稳定的MOF作为硫载体,如锆基MOF[21]。
我们以卟啉为配体,合成锆基卟啉MOF(PCN‑222),同时利用卟啉环与Cu2+配位,得到额外含Lew‑is酸结合位点的PCN‑222‑Cu。不仅可以利用卟啉环锚定LiPSs,限制LiPSs的扩散,而且可利用配位的Cu2+催化硫物种的氧化还原,降低电化学极化。研究结果表明,PCN‑222‑Cu作为硫载体具有优异的电化学性能和循环稳定性。
1 实验部分
1.1 试剂和仪器
无水氯化铜、八水合氧氯化锆、N,N‑二甲基甲酰胺(DMF)、N,N‑二甲基乙酰胺(DEF)、丙酮、对叔丁基苯甲酸、甲酸(88%,w/w)、吡咯、浓盐酸(37%,w/w)、对甲酰基苯甲酸甲酯、丙酸、无水乙醇、氢氧化钾、升华硫(国药化学试剂)。
粉末X射线衍射(PXRD)测试采用日本理学Rigaku SmartLab X 射线粉末仪,Cu Kα 射线(λ=0.154 nm),管电压为45 kV,管电流200 mA,扫描速率5(°)·min-1,扫描步长0.01°,扫描范围2θ=2°~50°。N2吸附-脱附测试采用美国康塔公司的Autosorb iQ2和Quadrasorb evo气体吸附仪,孔径计算采用非局部密度泛函理论(NLDFT)模型,比表面积采用多层物理吸附方法计算。样品形貌采用场发扫描电子显微镜(FESEM,Zeiss,5 kV)测试。由于MOF导电性较差,测试前在其表面进行了喷金处理。紫外可见吸收光谱(UV‑Vis)测试采用Agilent Cary 100紫外可见分光光度计,检测波长范围是350~800 nm。
1.2 卟啉配体的合成
首先将对甲酰基苯甲酸甲酯(23.4 g,0.143 mol)溶解在300 mL丙酸中[22],加热到120℃,然后在避光和Ar气环境下,在20~30 min内加入吡咯(9.0 mL)和丙酸(9.0 mL)的混合溶液,于140℃下回流12 h,冷却至室温,过滤收集紫色固体,用丙酸和水洗涤后干燥。称取3.0 g得到的固体产物溶解于100 mL四氢呋喃和100 mL甲醇的混合溶剂中,再加入由10.5 g KOH和100.0 mL水配成的碱液。将混合溶液于85℃下回流24 h,用旋转蒸发仪将四氢呋喃和甲醇蒸出,加适量水稀释后,用1.0 mol·L-1HCl将溶液酸化至pH=5,经过滤收集,用水洗涤和真空干燥后,得到的紫色固体即为所需的卟啉配体,即四羧基卟啉(etrakis(4‑carboxyphenyl)‑porphyrin,H2TCPP)。
1.3 PCN⁃222的合成
称取12.5 mg H2TCPP、23.5 mg八水合氧氯化锆和1.350 0 g对叔丁基苯甲酸于20 mL螺口玻璃瓶中,加入3.0 mL N,N‑二乙基甲酰胺,加盖并超声溶解[22‑23]。混合溶液在120℃的烘箱中加热12 h,过滤收集紫色晶体,依次使用DMF和丙酮通过索氏提取器洗涤,真空干燥。产物在脱气站中120℃和低于122 Pa的真空环境下脱气12 h,以去除孔道中的残余溶剂,即得到活化处理的PCN‑222。
1.4 PCN⁃222⁃Cu的合成
将无水CuCl2(105 mg,0.78 mol)溶于50 mL DMF中,加入活化处理的PCN‑222(100 mg,0.078 mol),随后在85℃下加热搅拌24 h。过滤后,用1 mol·L-1HCl和去离子水洗涤得到红色的产物。采用索氏提取器洗涤和真空脱气活化处理的方法,得到活化后的PCN‑222‑Cu。
1.5 S⁃in⁃MOF的制备
将硫粉与MOF样品按质量比7∶3加入派热克斯玻璃管并封住管口,然后在155℃恒温20 h,冷却至室温后得到负载硫质量分数为70%的MOF样品,即S‑in‑PCN‑222和S‑in‑PCN‑222‑Cu。
1.6 正极片制备
以N‑甲基‑2‑吡咯烷酮为溶剂,将载硫后的MOF样品、BP 2000导电碳和聚丙烯酸黏结剂以质量比7∶2∶1混合,于微型振荡器中振荡形成均匀的浆料,采用四面制备器将其涂布在平整的铝箔上。然后在真空干燥箱中55℃保持12 h,并切成直径为10 mm的圆片,其中硫的面载量为1.0~1.2 mg·cm-2。
1.7 电池组装和电化学测试
电池正极为载硫后的MOF电极片,负极为锂片,隔膜为 Celgrad 2400,电解液为 1 mol·L-1的双三氟甲基磺酸酰亚胺锂的乙二醇二甲醚和1,3‑二氧戊环(体积比1∶1)溶液,并含质量分数1%的LiNO3(苏州多多化学科技有限公司)。在充满氩气氛围的手套箱内组装CR2016扣式电池。采用蓝电电池测试仪对电池进行恒电流充放电测试。充放电电压范围为1.8~2.7 V,电流为1C和3C(1C=1 680 mAh·g-1)。采用电化学工作站(VMP3)对电池进行循环伏安(CV)测试。
2 结果与讨论
2.1 紫外-可见吸收光谱分析
通过样品的颜色变化,可以清晰观察到PCN‑222在负载Cu2+前颜色为深紫色,而负载后颜色变为红色(图1a)。说明PCN‑222与Cu2+存在明显的相互作用。为了进一步表征它们之间的相互作用,通过UV‑Vis检测卟啉特征吸收峰的变化。首先在DMF中用少量氨水将MOF消解,然后用UV‑Vis检测消解后的溶液(图1b)。结果表明消解的PCN‑222样品具有典型的卟啉吸收峰,分别为位于419 nm附近的特征吸收峰和500~700 nm的一系列指纹峰[24]。而消解的PCN‑222‑Cu样品的指纹峰的数量明显减少并发生偏移,仅仅在541 nm附近出现了明显的Cu‑TCPP的指纹峰[25]。这一系列吸收峰的变化证明了卟啉环的化学环境发生改变,说明PCN‑222的卟啉环成功与Cu2+发生配位。
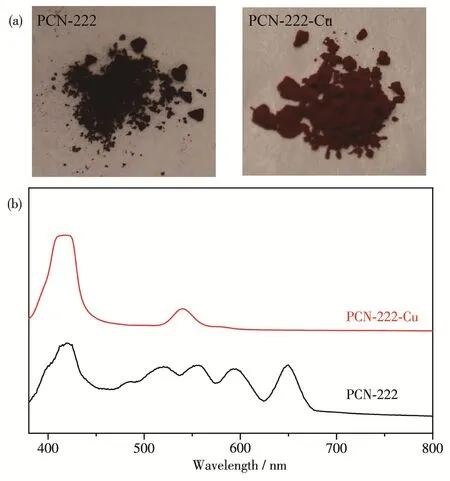
图1 (a)PCN‑222和PCN‑222‑Cu的颜色;(b)氨水消解后的PCN‑222和PCN‑222‑Cu的UV‑Vis谱图Fig.1 (a)Colors of PCN‑222 and PCN‑222‑Cu;(b)UV‑Vis spectra of the PCN‑222 and PCN‑222‑Cu digested in ammonium hydroxide
2.2 PXRD分析
通过PXRD考察载硫前后PCN‑222和PCN‑222‑Cu样品的晶相结构变化。图2a是PCN‑222和PCN‑222‑Cu的PXRD图,所有衍射峰的位置与模拟的PCN‑222衍射峰保持一致,说明得到的MOF样品为纯相。此外,PCN‑222‑Cu的PXRD图中未见明显的金属盐的杂峰,说明没有金属盐残留。从S‑in‑PCN‑222和S‑in‑PCN‑222‑Cu的PXRD图中可知载硫之后MOF的峰强度系统性变低(图2b),特别是2.2°附近的低角度衍射峰几乎消失,这是由于孔道内部大部分空间被硫占据,但是高角度的MOF衍射峰仍清晰可见,这说明MOF的结构没有发生改变。类似的现象也可以从其他MOF中观察到[13,26]。通过与纯硫粉的PXRD图对比,几乎没有观察到单质硫的衍射峰,这说明硫被成功载入MOF孔道中。
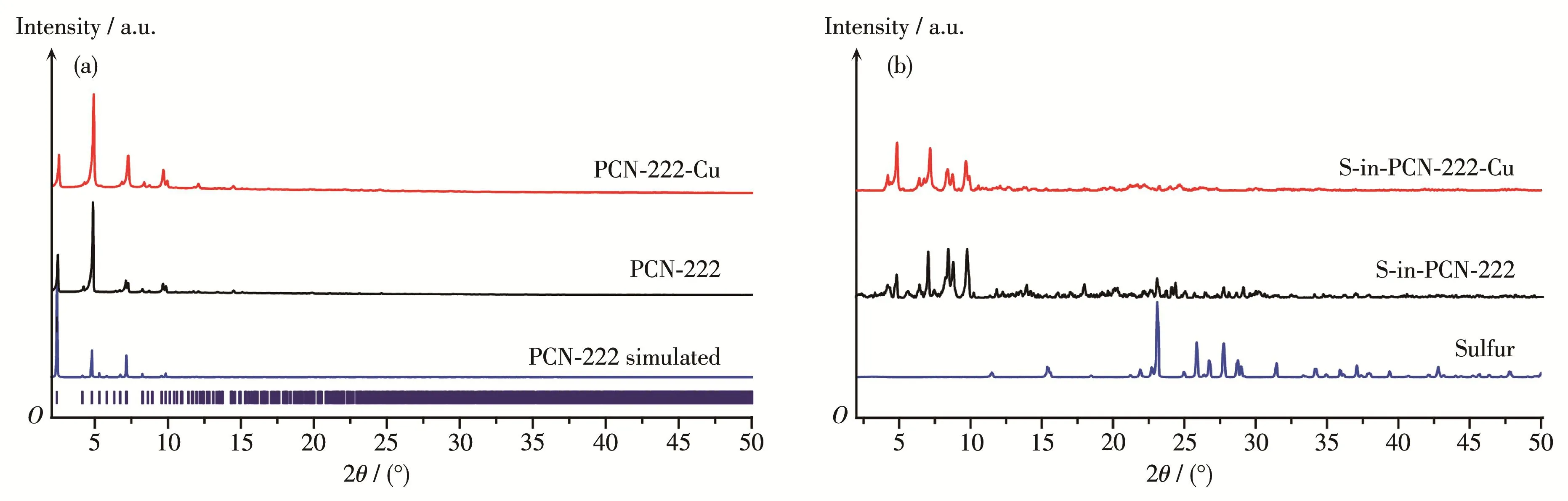
图2 (a)PCN‑222、PCN‑222‑Cu和模拟的PCN‑222的PXRD图;(b)S‑in‑PCN‑222、S‑in‑PCN‑222‑Cu和硫粉的PXRD图Fig.2 (a)PXRD patterns of synthesized PCN‑222,PCN‑222‑Cu,and simulated PCN‑222;(b)PXRD patterns of S‑in‑PCN‑222,S‑in‑PCN‑222‑Cu and sulfur powders
2.3 N2吸附-脱附测试分析
对MOF及S‑in‑MOF样品在77 K下用N2进行吸附-脱附测试,探究MOF及S‑in‑MOF的吸附量和比表面积变化。从PCN‑222和PCN‑222‑Cu的N2吸附-脱附曲线(图3)可知,PCN‑222和PCN‑222‑Cu均为典型的LangmuirⅣ型等温线,在相对压力达到0.22附近时,吸附量陡增,表明其具有高度有序的介孔[23]。PCN‑222和PCN‑222‑Cu的吸附量分别为850和880 cm3·g-1,比表面积分别为2 380和 2 530 m2·g-1,与文献的数值接近[23],且二者的孔径分布基本一致,均为~1.5 nm的微孔和~3.2 nm的介孔,孔结构未出现明显变化。在负载硫后,S‑PCN‑222和S‑in‑PCN‑222‑Cu的吸附量和比表面积均趋于0,进一步证明硫成功进入MOF的孔道。
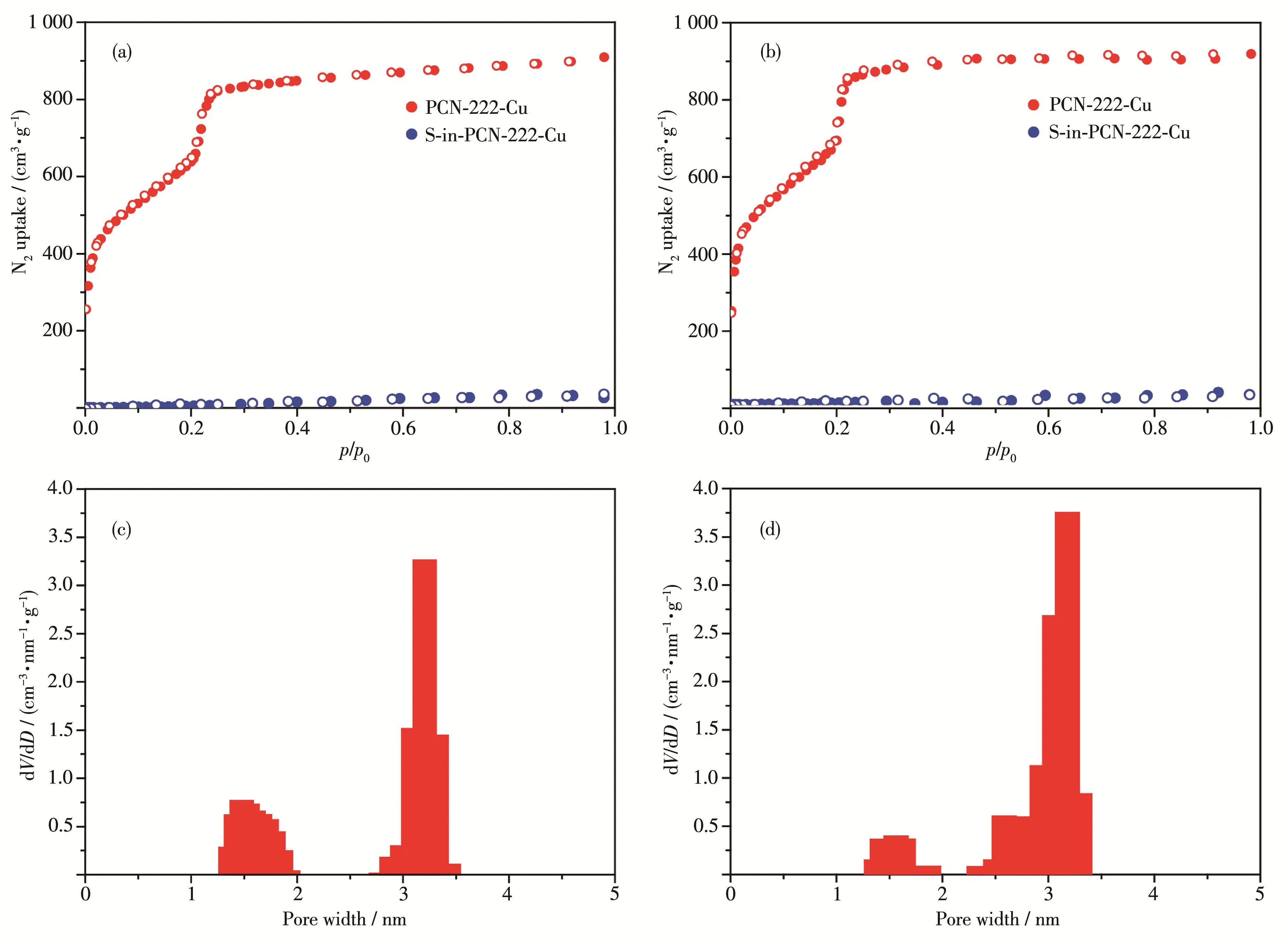
图3 PCN‑222、S‑in‑PCN‑222(a)和PCN‑222‑Cu、S‑in‑PCN‑222‑Cu(b)的N2吸附-脱附等温线;PCN‑222(c)和PCN‑222‑Cu(d)的孔径分布图Fig.3 N2adsorption‑desorption isotherms of PCN‑222,S‑in‑PCN‑222(a)and PCN‑222‑Cu,S‑in‑PCN‑222‑Cu(b);Pore size distribution of PCN‑222(c)and PCN‑222‑Cu(d)
2.4 形貌结构分析
采用SEM表征PCN‑222和PCN‑222‑Cu负载硫前后的形貌结构及颗粒大小(图4)。SEM结果表明,PCN‑222和PCN‑222‑Cu的形貌均为六方棱柱的棒状结构(图4a、4c),与PCN‑222的一维六方型孔道相对应,截面为六边形,边长为1 μm左右,长度从几微米到十几微米。说明卟啉环与Cu2+配位过程中,形貌结构未发生明显的改变。而且负载硫之后,仍保持六方棱柱的棒状结构(图4b、4d),同时没有观察到明显的硫颗粒出现,表明硫成功载入MOF孔道且未破坏MOF的结构。此外,采用两电极法测试S‑in‑PCN‑222和S‑in‑PCN‑222‑Cu的电导率分别为2.65和4.80 μS·m-1,说明铜离子的引入使电导率略有提升,这可能与增加卟啉环的电子密度有关。

图4 (a)PCN‑222、(b)S‑in‑PCN‑222、(c)PCN‑222‑Cu和(d)S‑in‑PCN‑222‑Cu的SEM图Fig.4 SEM images of(a)PCN‑222,(b)S‑in‑PCN‑222,(c)PCN‑222‑Cu and(d)S‑in‑PCN‑222‑Cu
2.5 电化学性能测试
为了考察卟啉环与Cu2+配位后对锂硫电池性能的影响,测试S‑in‑PCN‑222和S‑in‑PCN‑222‑Cu电极的恒电流充放电曲线,如图5所示。为了减小极化的影响,所有电池均在0.5C的倍率下活化3周后,再在相应的倍率下测试其循环稳定性。如图5a所示,在1C的倍率下S‑in‑PCN‑222‑Cu电极的首周放电容量为1 146 mAh·g-1,较S‑in‑PCN‑222(850 mAh·g-1)有明显的提升。随着充放电的进行,S‑in‑PCN‑222‑Cu电极循环300周后,仍保持840 mAh·g-1的可逆容量,明显优于S‑in‑PCN‑222电极。该结果表明,卟啉环上的Cu2+对锂硫电池的性能具有促进作用。分析首周的充放电曲线可以发现,S‑in‑PCN‑222电极在第2个放电平台和充电平台前均存在一个明显的极化过电位(图5b蓝色虚线框)。但当PCN‑222中的卟啉环与Cu2+配位后,该极化现象得到明显的改善,表明与卟啉环配位的Cu2+可以加快硫物种的氧化还原反应。在1C倍率下,对比S‑in‑PCN‑222和S‑in‑PCN‑222‑Cu电极的充放电曲线(图5c),S‑in‑PCN‑222‑Cu电极的放电平台明显高于S‑in‑PCN‑222电极,而充电平台则明显更低,说明Cu2+的配位可以明显地减小电化学极化,进一步证明了Cu2+的配位能够加快LiPSs反应速率,降低电化学极化并提高硫的利用率[27]。此外,CV测试结果也证实了该结论,如图5d所示,说明S‑in‑PCN‑222‑Cu能够提高LiPSs的反应速率,有效降低极化,提高电化学性能[28]。
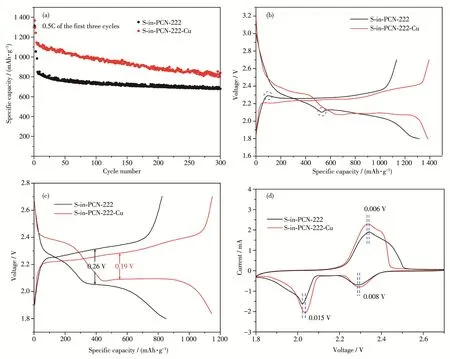
图5 经过0.5C活化3周后S‑in‑PCN‑222和S‑in‑PCN‑222‑Cu电极在(a)1C倍率下的循环性能曲线、(b)0.5C和(c)1C倍率下的充放电曲线以及(d)0.1 mV·s-1扫速下的CV曲线Fig.5 (a)Cycling performance at 1C,and the corresponding of galvanostatic discharge‑charge curves at(b)0.5C and(c)1C,and(d)CV curves at 0.1 mV·s-1of S‑in‑PCN‑222 and S‑in‑PCN‑222‑Cu electrodes after three cycles activation at 0.5C
为了进一步考察S‑in‑PCN‑222‑Cu电极在高倍率下的长循环稳定性,将充放电倍率提高至3C,结果如图6所示。结果表明,首周放电容量可达675 mAh·g-1,经过800次循环后,S‑in‑PCN‑222‑Cu电极的可逆容量约为430 mAh·g-1(图6a),容量衰减率仅为每周0.045%,而且在该倍率下循环800周后仍存在 2 个明显的放电平台(图 6b)。目前该 S‑in‑PCN‑222‑Cu电极在纯MOF硫载体中具有最好的高倍率性能和长循环稳定性[15‑16,19,21,29‑43]。说明 Cu2+与卟啉环的协同作用能有效地降低电化学极化,并显著地提高MOF电极在高倍率下的电化学性能。
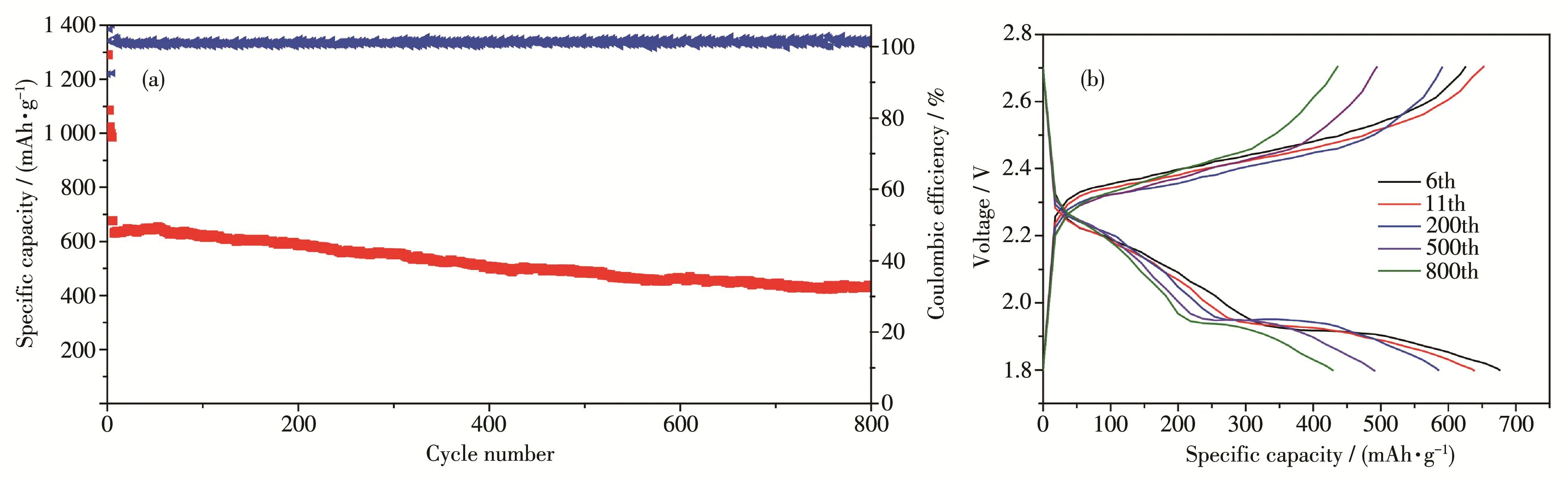
图6 经过0.5C倍率活化5周后S‑in‑PCN‑222‑Cu电极(a)在3C倍率下的循环性能曲线和(b)对应的充放电曲线Fig.6 (a)Long‑term cycling performance and(b)corresponding of galvanostatic discharge‑charge curves of S‑in‑PCN‑222‑Cu electrode at 3.0C after five cycles activation at 0.5C
3 结论
采用后修饰的方法合成了金属卟啉类锆基MOF(PCN‑222‑Cu),并首次用于锂硫电池的硫载体。UV‑Vis结果表明Cu2+与MOF的卟啉环成功配位。采用PXRD、N2吸附-脱附和SEM证实硫负载于MOF孔道中且未改变MOF的结构。电化学测试结果表明,S‑in‑PCN‑222‑Cu电极在3C倍率下,循环800周后的容量仍保持430 mAh·g-1,每周容量衰减率为0.045%。因此,N与Cu2+的协同作用能够增强对LiPSs的锚定并加快其反应速率,降低电化学极化,显著提升纯MOF载体用于Li‑S电池的电化学性能和循环稳定性,拓展了MOF材料在锂硫电池中的应用前景。

