肝细胞性肝癌中线粒体转录延伸因子的表达及意义
李素芬,李 彬,普元倩,杨 娜,王唯斯,自加吉,余 敏,熊 伟
肝细胞性肝癌(hepatocellular carcinoma, HCC)是最常见的原发性肝癌,发病率和病死率均较高[1]。肝癌可以通过手术切除、肝移植、肝定向疗法和全身疗法进行治疗,但肝癌的3年生存率仅为12.7%,中位生存期为9个月[2]。线粒体转录延伸因子(mitochondrial transcription elongation factor, TEFM)基因又被命名为C17orf42,定位于人的17q11.2,含有4个外显子,mRNA全长为1 357 bp,编码1个由360个氨基酸残基组成的蛋白质[3]。Agaronyan等[4]首次报道,TEFM是调控线粒体基因组转录与复制相互转换的关键分子。研究证实,TEFM具有调控线粒体DNA(mitochondrial DNA, mtDNA)转录延伸和抗转录终止的功能[5],并且参与线粒体RNA的转录后加工[6],与线粒体能量产生及线粒体疾病的发生密切相关[7]。随着对TEFM的深入研究发现,TEFM基因缺失或表达异常可能导致胰腺癌[8]、I型神经纤维瘤[9]和脑胶质瘤[10]等恶性肿瘤的发生,但TEFM蛋白在HCC组织中的表达及与临床病理学特征的相关性尚未见报道。本文采用免疫组化法检测70例HCC组织中TEFM蛋白的表达,分析其表达与临床病理学特征的关系及对预后的影响。
1 材料与方法
1.1 临床资料收集70例HCC患者的组织标本,将HCC确诊病例组织(70例及复孔)和配对的癌旁组织标本(70例)制成组织芯片,HCC组织芯片样本购自武汉赛维尔公司。70例HCC患者中男性66例,女性4例,年龄14.0~69.0岁,中位年龄47.5岁;患者均首次确诊为HCC,未行放、化疗。HCC患者的组织标本根据美国癌症联合委员会(AJCC)/国际抗癌联盟(UICC)的TNM分期系统进行分期,其中Ⅰ期25例,Ⅱ期5例,Ⅲ期33例,Ⅳ期7例。本实验经大理大学医学伦理委员会批准,患者均签署知情同意书。
1.2 细胞培养6种人类HCC细胞系(SMMC-7721、BEL-7402、Hep3B、HepG2、QGY-7701、SK-Hep1)和人类正常肝细胞(THLE-2)购自中国科学院上海细胞库。将细胞用含10%胎牛血清(FBS)和1%抗生素(100 U / mL青霉素、100 mg / L链霉素)的高糖DMEM培养基进行体外培养。将所有细胞置于37 ℃、5%CO2的培养箱中。所有细胞系均通过短串联重复序列(short tandem repeat, STR)分析进行鉴定,并使用TransDetect荧光素酶支原体试剂盒检测是否存在支原体的污染。
1.3 Western blot法从RIPA细胞裂解液中收集蛋白质样品,并使用二辛可宁酸(bicinchoninic acid, BCA)试剂盒测定总蛋白质浓度。用10%SDS-PAGE凝胶分离50 mg总蛋白的样品,电转移置聚偏二氟乙烯(PVDF)膜上。将PVDF膜在TBS中的5%脱脂牛奶中室温封闭1 h,在4 ℃与兔抗TEFM单克隆抗体(1 ∶1 000, GeneTex, USA)孵育过夜。用TBST洗涤后,将PVDF膜用辣根过氧化物酶(horseradish peroxidase, HRP)偶联的山羊抗兔IgG(1 ∶5 000, Abcam, USA)在4 ℃下孵育2 h。采用Western blot发光液检测蛋白质信号,并用Image Lab 5.2.1软件进行半定量分析。TEFM蛋白的相对表达水平用目的条带与内参条带之间的累积光密度(accumulated optical density, AOD)之比表示,实验重复3次。
1.4 组织芯片制作HCC组织芯片由武汉赛维尔生物公司制作,70例配对的HCC组织和癌旁组织用4%多聚甲醛固定24 h后,将组织从固定液取出在通风橱内用手术刀将目的部位组织修平整,将修切好的组织和对应的标签置于脱水盒内。将脱水盒放进脱水机内依次梯度乙醇进行脱水,将浸好蜡的组织于包埋机内进行包埋、冻台冷却,蜡凝固后将蜡块从包埋框中取出并修整。将修整好的蜡块置于石蜡切片机,4 μm厚切片,切片漂浮于摊片机40 ℃温水将组织展平,载玻片将组织捞起,60 ℃烘箱内烤片,常温保存备用。
1.5 免疫组化采用免疫组化SP法染色,标本均经修剪、脱水、包埋、切片、染色、封片。石蜡切片脱蜡至水洗,将组织切片置于柠檬酸抗原修复缓冲液(pH 6.0)的修复盒中,于微波炉内进行抗原修复。自然冷却后将玻片置于PBS(pH 7.4)中洗涤,放入3%双氧水溶液,阻断内源性过氧化物酶。滴加3%BSA均匀覆盖组织,室温封闭30 min。在切片上滴加用兔抗人TEFM抗体(1 ∶100),4 ℃孵育过夜。滴加HRP标记的山羊抗兔IgG二抗覆盖组织,室温孵育50 min。滴加新鲜配制的DAB显色液,苏木精复染细胞核3 min,中性树胶封固。使用倒置显微镜检查,图像采集分析,苏木精染细胞核为蓝色,阳性为棕黄色。
1.6 细胞阳性率判断使用PANNORAMIC全景切片扫描仪将组织切片上机后,切片会在扫描仪的镜头下逐步移动,一边移动、一边成像将组织切片的信息均扫描成像形成文件夹。文件夹用CaseViewer 2.2软件打开,可以1~400倍放大进行观察。使用Halo v3.0.311.314分析软件中TMA插件设置芯片组织点直径大小和行列数,软件自动生成编号。使用Indica Labs-Multiplex IHC v2.2.0模块,分别定量每张芯片每个点的目的区域阳性细胞数、总细胞数,并计算细胞阳性率。
1.7 组织芯片H-score评分将每张切片内阳性的细胞数及其染色强度以特定的公式转化成相应的数值,达到对组织染色目的蛋白质半定量的目的。H-score=∑(阳性细胞数量×代表着色强度)=(弱阳性细胞的百分比×1)+(中度阳性细胞的百分比×2)+(强阳性细胞的百分比×3)。

2 结果
2.1 TEFM蛋白在6种人类HCC细胞中的表达Western blot实验结果表明,TEFM蛋白的表达量在BEL-7402细胞中最低(1.412±0.007),在Hep3B细胞中最高(2.210±0.008) 。与体外培养的人类正常肝细胞(THLE-2)相比,TEFM蛋白的表达量在6种人类HCC细胞系(SMMC-7721、BEL-7402、Hep3B、HepG2、QGY-7701和SK-Hep1)中均显著上调[(1.803±0.275)倍](P<0.05,图1)。

图1 Western blot法检测TEFM蛋白在正常肝细胞(THLE-3)和6种肝细胞性肝癌细胞中的表达:A.电泳图;B.直方图
2.2 HCC、癌旁组织中细胞阳性率和TEFM蛋白的相对表达量HCC组织芯片中收集70例HCC患者的组织标本,该芯片结果包括HCC确诊病例组织及复孔和配对的癌旁组织。使用Halo v3.0.311.314分析软件中TMA插件设置芯片组织点直径大小和行列数,软件自动生成编号(图2)。本组根据HCC组织及其癌旁组织的细胞阳性率进行定量分析,结果显示:HCC组织的细胞阳性率高于其配对癌旁组织(t=2.235,P=0.041,图3A)。

图2 肝细胞性肝癌和对应癌旁组织的全芯片组织扫描:其中第1、4、7、10、13、16列为癌旁组织;其余列为肝细胞性肝癌组织
根据H-score评分比较HCC组织及其配对癌旁组织的TEFM相对表达量,结果发现与癌旁组织相比,HCC组织的TEFM相对表达量增高(t=2.569,P=0.038,图3B)。
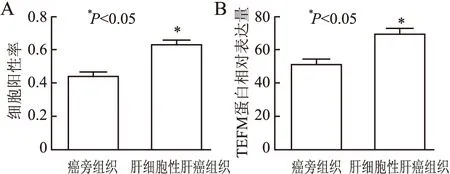
图3 肝细胞性肝癌和癌旁组织中的细胞阳性率及TEFM相对表达量:A.肝细胞性肝癌组织与癌旁组织的细胞阳性率;B.肝细胞性肝癌组织与癌旁组织的TEFM相对表达量
2.3 不同TNM分期的HCC和癌旁组织中的TEFM相对表达量本组HCC组织芯片结果显示,TEFM蛋白阳性染色定位于细胞质,呈棕黄色。本组结果显示,相同TNM分期的TEFM蛋白表达量在
HCC组织中比对应的癌旁组织高,但HCC的TNM分期与TEFM蛋白表达量高低之间并无明显关联(图4)。

图4 TEFM蛋白在不同病理分期的肝细胞性肝癌和癌旁组织中的表达:A.Ⅰ期肝细胞性肝癌的癌旁组织;B.Ⅰ期肝细胞性肝癌组织;C.Ⅱ期肝细胞性肝癌的癌旁组织;D.Ⅱ期肝细胞性肝癌组织;E.Ⅲ期肝细胞性肝癌的癌旁组织;F.Ⅲ期肝细胞性肝癌组织;G.Ⅳ期肝细胞性肝癌的癌旁组织;H.Ⅳ期肝细胞性肝癌组织,SP法
2.4 不同分化程度的HCC组织与癌旁组织中TEFM相对表达量根据HCC的临床病理结果将HCC组织划分为高、中和低分化组,HCC细胞分化程度越低,则HCC的恶性程度越高。本组结果显示,无论高、中分化或者低分化HCC组织中的TEFM蛋白表达水平均高于癌旁组织(图5)。

图5 TEFM蛋白在不同分化程度的HCC组织及癌旁组织中的表达:A.高分化肝细胞性肝癌的癌旁组织;B.高分化肝细胞性肝癌组织;C.中分化肝细胞性肝癌的癌旁组织;D.中分化肝细胞性肝癌组织;E.低分化肝细胞性肝癌的癌旁组织;F.低分化肝细胞性肝癌组织,SP法
2.5 HCC组织中TEFM的表达与临床病理特征的关系根据H-score评分得出本组TEFM相对表达水平由低到高排列。将TEFM相对表达量按中位表达量进行分组,低于中位表达量的标本为低表达组,高于中位表达量的标本为高表达组。本组TEFM低表达组35例,高表达组35例。统计学分析结果显示:TEFM相对表达量与AFP差异有统计学意义(P=0.001);其与患者年龄、性别、肿瘤分期、淋巴结转移、分化程度、HBV感染、肝硬化、血管侵犯、肿瘤数量、肿瘤大小、肿瘤包膜完整性和肿瘤复发均无相关性(P均>0.05,表1)。

表1 肝细胞性肝癌中TEFM蛋白表达与临床病理特征的关系
2.6 HCC组织中TEFM表达与预后的关系本组应用Kaplan-Meier和Log-rank检验HCC患者预后与TEFM表达的关系,绘制总生存期(overall survival, OS)和无瘤生存期(disease-free survival, DFS)生存曲线。结果发现,TEFM蛋白的表达与HCC患者的OS(P=0.539,图6A)以及DFS(P=0.994,图6B)均无相关性。

图6 TEFM蛋白表达与肝细胞性肝癌预后的关系:A.总生存期;B.无瘤生存期
3 讨论
HCC是我国常见恶性肿瘤之一,每年全球有近100万新的HCC确诊病例,中国占病例总数的50%以上[11]。尽管HCC的早期诊断和HCC的治疗取得一定程度进展,但HCC患者的预后仍然较差,复发率较高[12]。因此,分析HCC发生、发展的病理、生理机制,以寻求新的诊断方法,改善HCC患者的预后水平至关重要。TEFM在哺乳动物胚胎发育、细胞增殖、维持细胞呼吸链功能和能量代谢等具有重要作用[13]。目前,TEFM蛋白与HCC的发生、发展、临床病理特征及预后关系尚不明确。
本组首先通过Western blot法检测人类正常肝细胞(THLE-2)和6种HCC细胞(SMMC-7721、BEL-7402、Hep3B、HepG2、QGY-7701和SK-Hep1)中TEFM蛋白的表达差异。TEFM蛋白在6种人类HCC中的表达与THLE-2相比,其表达均上调。采用组织芯片技术结合免疫组化检测HCC组织和对应的癌旁组织中细胞阳性率和TEFM蛋白的表达。结果表明:与癌旁组织相比,HCC组织细胞阳性率增高,且TEFM蛋白在HCC组织中表达量增高;提示TEFM基因的作用可能类似于细胞癌基因,参与HCC的发生。免疫组化结果还显示,TEFM蛋白仅在HCC组织的细胞质中呈阳性。已有研究表明,HCC的发生不仅与细胞核内的DNA相关,也与细胞质中的mtDNA密切相关[14]。Qiao等[15]发现,与癌旁组织相比,HCC组织中mtDNA拷贝数降低、突变率增加,通过线粒体转录因子A(mitochondrial transcription factor A, TFAM)蛋白过表达促进mtDNA转录,参与肿瘤的发生、发展。本实验结果表明,TEFM蛋白也在HCC组织中高表达,提示TEFM蛋白可能与TFAM蛋白协同作用,促进mtDNA的转录,进而调控细胞能量代谢促进HCC发生。此外,本组还对TEFM蛋白的相对表达量与HCC临床病理特征的相关性进行分析,结果发现:TEFM相对表达量与HCC患者的血清AFP有相关性(P<0.01)。由于临床上仅有血清AFP 的升高并不能直接确诊肝癌,单项肿瘤标志物的指标敏感性和特异性有一定的局限,联合诊断是提高诊断效能的重要方法之一。TEFM蛋白检测与血清AFP的检测联合使用,可能成为HCC诊断的辅助手段。本组使用Kaplan-Meier生存模型对TEFM相对表达量和HCC患者预后的关联进行分析。结果发现,TEFM相对表达量与HCC患者OS和DFS均无相关性(P>0.05),提示TEFM蛋白表达量不能作为HCC患者预后的有效指标。由于本组收集的HCC样本量较小、人群异质性和缺乏随机性,导致分析结果可能存在一定的误差,需扩大样本的数量进一步分析。
总之,本组发现TEFM蛋白在HCC细胞和组织中表达增高,反映TEFM可能为HCC诊断的潜在肿瘤标志物之一。同时,TEFM蛋白检测可与血清AFP检测联合作为HCC的辅助诊断手段。未来可进一步探索TEFM蛋白在HCC发生、发展中的功能,进而寻找有效抑制TEFM过表达的siRNA或小分子抑制剂,有助于HCC的临床治疗。

