HPMo12O40修饰电极对酪氨酸酶的电化学传感
蔡思学,谢乐芳,丁小梅,王 力
(集美大学海洋食品与生物工程学院,福建 厦门 361021)
0 引言
酪氨酸酶又称多酚氧化酶,是一种兼具单酚酶和二酚酶活性的多功能含铜氧化酶[1],在微生物、动植物和人体中都广泛存在,在催化氧化酚类化合物的酶促褐变、促进黑色素形成方面发挥着重要作用。它是果蔬褐变的关键酶,一方面可以使果蔬中的酚类物质被氧化为棕褐色,另一方面所生成的氧化产物会与其他蛋白质等组分结合而抑制多种酶活性。因此,酪氨酸酶会显著影响新鲜果蔬的颜色和质量,导致果蔬的保质期缩短[2-4]。研究表明,果蔬因为褐变造成的损失率高达50%[5]。并且,酪氨酸酶也是各种微生物生命活动所必需的酶之一,对其活性进行抑制可以控制腐败菌的生长,达到对食品保鲜防腐的目的[6]。但目前,发现的大多数酪氨酸酶检测方法由于其抑制剂的毒性而不能口服或应用于皮肤[7],所以,找到一种灵敏、高效、安全检测酪氨酸酶的方法,对评价果蔬褐变、食品保鲜有潜在的应用前景。
多金属氧酸盐(polyoxometalates,POMs)简称多酸,通常是由前过渡元素(钼、钒、钨、铌等d0电子构型元素)形成的一类高氧化态阴离子金属氧簇[8],因其无毒、无臭、不挥发,便于萃取分离,且具超强的酸性、氧化还原性、高负电荷,特别是其无可比拟的结构多样性和理想的电荷转移能力,因而被应用于医药、催化、电化学等多个领域,是一种具有广泛应用前景的绿色高效多功能催化剂。其中,在电化学领域,主要根据多酸的氧化还原、高度负电性质和导电率等展开研究[9-11]。为了减少多酸在溶液中降解,促进其回收再利用,研究中通常将其固定在pH值稳定且具有高比表面积的碳基载体上[12]。制备多酸修饰电极的方法有电极浸涂吸附法、电极表面电沉积法、聚合物包埋法等[13],并且多酸修饰电极与普通玻碳电极相比,具有电流响应增加、检出限降低、电极反应性能和电催化性能提高等优势[14]。近年来,多酸对酶的高效抑制作用已成为研究的热点,虽确切的机制尚不明确,但主要归因于高负电荷的多酸与蛋白质之间正电荷区间的相互作用[15],如磷酸酶、核苷酸酶、ATP酶和葡萄糖苷酶等,不同量的多酸都有高效的抑制作用[16]。
由于杂多化合物尤其是钼系列化合物很容易吸附在碳电极表面,因此,文献[17-19]利用吸附法制备了磷钼酸修饰电极,其电极表现出很好的稳定性和氧化还原性能。但现阶段对于多酸修饰电极用于酪氨酸酶的检测鲜有报道,因此,有望利用吸附法将多酸修饰至电极表面作为电化学传感器用于酪氨酸酶的检测,为评价果蔬褐变提供可靠的方法。本文制备H3PMo12O40修饰玻碳电极,通过阳极化、吸附法进行处理,进而增强H3PMo12O40的吸附能力,利用H3PMo12O40与蛋白质之间可能会发生的反应,研究其在不同支持电解质、扫描速度下对酪氨酸酶的电化学传感效果,以此为电化学传感器检测酪氨酸酶,抑制果蔬褐变提供一定的理论依据。
1 实验部分
1.1 试剂和仪器
Al2O3粉购自天津艾达恒晟科技有限公司;酪氨酸酶购自Sigma-Aldrich公司;硫酸钠、硫酸和H3PMo12O40均购自国药集团化学试剂有限公司。实验试剂除Al2O3粉质量分数为99.9%外,其余均为分析纯,用水均为超纯水。
PGSTAT302N电化学工作站,瑞士万通中国有限公司;玻碳电极,武汉高仕睿联科技有限公司;DHG-9037A电热恒温鼓风干燥箱,上海精宏实验设备有限公司;KQ250ES型超声波清洗器,昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 玻碳电极的预处理
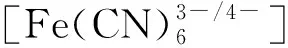
1.2.2 H3PMo12O40修饰玻碳电极的制备
在+2.0 V的电势条件下,将预处理好的玻碳电极置于2 mol/L H2SO4中极化3 s进行阳极化处理,以加强其吸附效果,之后在-0.4~+0.8 V电势电位下将电极处于5 mmol/L的H3PMo12O40溶液中,循环扫描25圈,即完成多酸修饰电极表面的制备。
1.2.3 不同支持电解质对电极的修饰
在-0.4~+0.8 V的电位区间内,分别以不同支持电解质50 mmol/L、pH=6.8磷酸盐缓冲液、超纯水、不同比例的V(0.1 mol/L H2SO4)∶V(0.5 mol/L Na2SO4)=2∶8混合溶液在100 mV/s扫描速度下进行循环伏安扫描,观察在不同电解质支持下电极的修饰效果。
1.2.4 不同扫描速度检测电极的修饰效果
以V(0.1 mol/L H2SO4)∶V(0.5 mol/L Na2SO4)=2∶8混合溶液作为支持电解质,分别在不同扫描速度(10,20,30,40,50,60,70,80,90,100 mV/s)下对H3PMo12O40修饰电极进行循环伏安扫描,并观察其规律。
1.2.5 修饰电极催化不同浓度酪氨酸酶
分别以4 mL的磷酸盐缓冲液和4 mLV(0.1 mol/L H2SO4)∶V(0.5 mol/L Na2SO4)=2∶8混合溶液作为支持电解质,再加入0.4 mL,0,21.48,40.28,59.08,77.87,96.67 U/mL的酪氨酸酶(由50 mmol/L、pH=6.8的磷酸盐缓冲液配制)进行循环伏安扫描(-0.4~+0.8V电势电压、100 mV/s 扫描速度),观察修饰电极对不同浓度酪氨酸酶的催化规律,并制作标准曲线以评价修饰电极对酪氨酸酶的催化效果,其检出限计算为空白溶液(支持电解质)标准偏差的三倍除以分析曲线的斜率。
1.2.6 修饰电极连续催化酪氨酸酶
在100 mV/s扫描速度、-0.4~+0.8 V电位区间条件下,首先在反应体系中加入4 mL磷酸盐缓冲液进行扫描,继而加入0.2 mL,249.73 U/mL酪氨酸酶溶液并迅速混合均匀,进行循环伏安扫描,再加入0.4 mL 249.73 U/mL酪氨酸酶溶液迅速混合均匀,进行循环伏安扫描。以此类推,分别加入0.6,0.8,1.0,1.2,1.4,1.6,1.8,2.0,2.2 mL,249.73 U/mL酪氨酸酶溶液,进行循环伏安扫描,每次扫描圈数均为1圈。
1.2.7 H3PMo12O40修饰电极稳定性、重现性的测定
在100 mV/s扫描速度、-0.4~ +0.8 V电位区间条件下,以V(0.1 mol/L H2SO4)∶V(0.5 mol/L Na2SO4)=2∶8混合溶液作为支持电解质,非连续性扫描多酸修饰电极,每次扫描3圈,并观察其规律。后续对修饰电极进行100圈的循环伏安扫描,观察响应电流的变化以确定其稳定性。
同一制备条件下以6支H3PMo12O40修饰电极来检测电极的重现性。
1.2.8 数据分析
实验数据重复3次平行测定,采用SPSS 17.0版本进行分析,实验作图使用Origin 8.0专业软件完成。
2 结果与讨论
2.1 不同支持电解质对电极的修饰
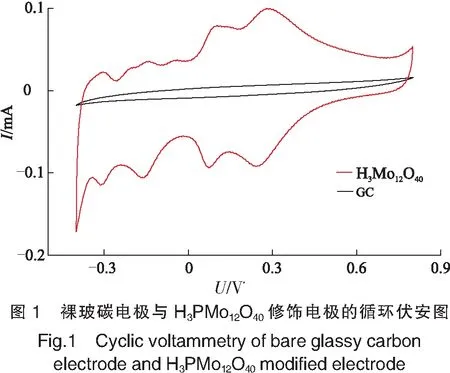
如图1所示,以V(0.1 mol/L H2SO4)∶V(0.5 mol/L Na2SO4)=2∶8混合溶液作为支持电解质下,H3PMo12O40修饰的玻碳电极与裸玻碳电极相比,出现明显的多金属氧酸盐特征氧化还原峰,表现出更清晰的伏安行为。说明H3PMo12O40被成功修饰至电极表面,能有效改善电流响应,可以用于后续实验。
不同溶液作为支持电解质修饰电极的循环伏安图如图2所示。由图2a可以看出,超纯水作为支持电解质,其响应电流为0 mA,原因是超纯水在处理过程中溶解盐类等导电物质几乎都被除去,电阻率太大,所以没有导电作用[20]。与图2b比较发现,在0.5 mol/L Na2SO4溶液支持下,循环伏安图没有出现多酸的特征氧化还原峰,原因可能是多酸在中性溶液中易分解,特别是钼基会随着pH值的升高逐渐分解,导致多酸离子浓度低从而不足以响应电流[21]。而在V(0.1 mol/L H2SO4)∶V(0.5 mol/L Na2SO4)=1∶1和0.1 mol/L H2SO4溶液支持下均出现特征氧化还原峰,且在H2SO4溶液中强于混合溶液的。
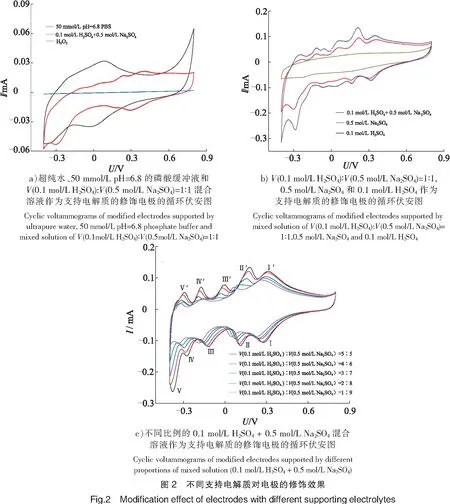
考虑到体系最终测定酪氨酸酶,其活性条件较温和,不能处于强酸强碱下,所以继续研究不同比例的硫酸、硫酸钠混合溶液作为支持电解质对修饰电极的效果,结果如图2c所示。由图2c可见,随着硫酸、硫酸钠溶液的比例由5∶5至1∶9,即酸性减弱,循环伏安图的响应电流也随之减弱。由于H3PMo12O40的电化学还原机理是两电子双质子的过程,可以发现,随着pH值的增加,氧化还原峰电位发生负移[22],当V(0.1 mol/L H2SO4)∶V(0.5 mol/L Na2SO4)=1∶9时,氧化峰个数由5个下降至4个,表明该反应过程确实有质子参与。但多酸对酸性敏感,当酸性减弱至一定程度时,多酸将会分解,氧化还原峰将减少,并且pH值增加可能使负电荷基团增多从而加大之间的静电排斥,抑制电化学反应的发生[23]。所以,为了保证检测的准确度、灵敏度,选择V(0.1 mol/L H2SO4)∶V(0.5 mol/L Na2SO4)=2∶8混合溶液作为电解质进行后续实验,此时氧化还原峰为5对,其中3对明确的氧化还原峰Ⅰ-Ⅰ′、Ⅱ-Ⅱ′、Ⅲ-Ⅲ′对应H3PMo12O40的2-、4-、6-电子转移[24-26],用式(1)~式(3)进行描述:
(1)
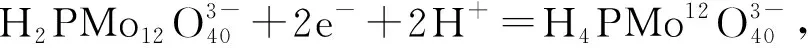
(2)
(3)
2.2 不同扫描速度检测电极的修饰效果
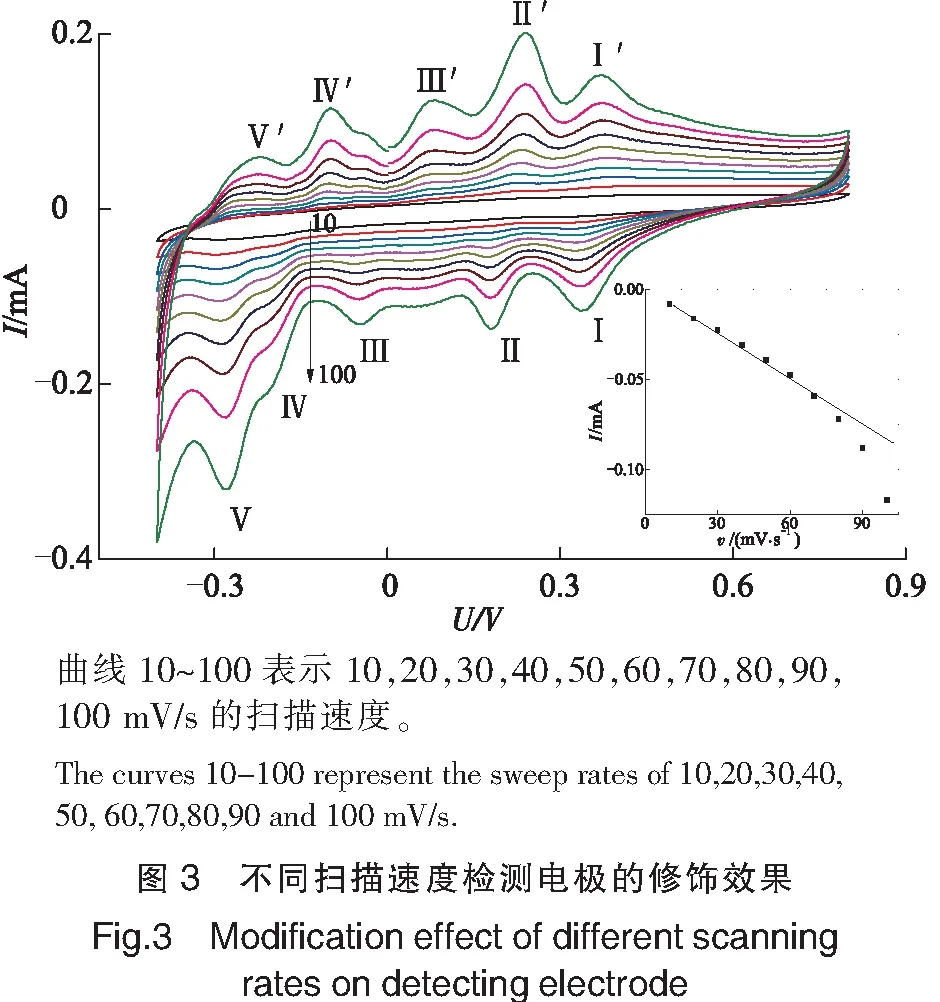
如图3所示,以V(0.1 mol/L H2SO4)∶V(0.5 mol/L Na2SO4)=2∶8混合溶液作为支持电解质下,扫描速度从10 mV/s增至100 mV/s的同时,氧化还原峰的响应电流增强,当扫描速度达100 mV/s时,多酸的特征氧化还原峰明显,后续进一步增加扫描速度,实验效果并不显著。说明100 mV/s的扫描速度适合扫描该多酸修饰电极。并且从图3还可以看出,随着扫描速度的变化,其氧化还原峰电位未发生改变,在10~70 mV/s内氧化还原峰的响应电流与扫描速度之间呈现良好的线性关系,80~100 mV/s内响应电流与扫描速度的对数呈线性关系,表明该反应过程属于表面与扩散的共同控制[27-31]。
2.3 H3PMo12O40修饰电极催化不同浓度的酪氨酸酶
图4a以磷酸盐缓冲液作为支持电解质,随酪氨酸酶浓度的增加,对应响应电流减弱,但减弱的幅度很小,表明多酸对酪氨酸酶有一定的催化效果。
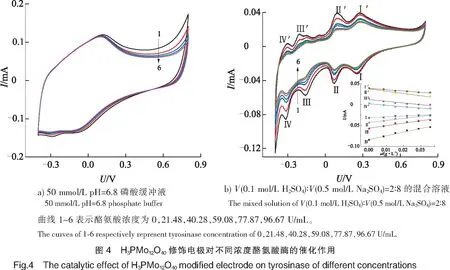
以V(0.1 mol/L H2SO4)∶V(0.5 mol/L Na2SO4)=2∶8混合溶液作为支持电解质,结果如图4b所示,图4b呈现4对明显的特征氧化还原峰,并且其氧化还原峰、对应响应电流随酪氨酸酶浓度的增大呈下降趋势,表明多酸具有双重催化功能,既能氧化催化又能还原催化酪氨酸酶。可能在该体系下酪氨酸酶中的羧基负载、负基团可以与修饰电极的正电荷发生有效的相互作用,增加了亲和力,所以效果显著[32]。相比磷酸盐缓冲液,硫酸、硫酸钠混合溶液体系可以使之呈现明显的氧化还原峰,原因可能是多酸在酸性条件下较中性条件更稳定,符合Ensafi等[33]的研究结果:在酸性溶液中多酸更有机会发挥催化作用,而缓冲溶液pH=6.8使体系基本处于中性条件下,导致在该体系下多酸修饰电极催化酪氨酸酶不会出现明显的特征峰。且以图4b插图峰Ⅳ为例,对应线性曲线为:I=0.863 1C-0.083,R2=0.998 5,检出限(S/N=3)为15.76 U/mL-1,表明在该体系下响应电流同酪氨酸酶的浓度存在良好的线性关系,可作为标准曲线用于果蔬中酪氨酸酶的检测。
2.4 H3PMo12O40修饰电极对酪氨酸酶的连续催化作用
以V(0.1 mol/L H2SO4)∶V(0.5 mol/L Na2SO4)=2∶8混合溶液作为支持电解质,研究H3PMo12O40修饰电极对酪氨酸酶的连续催化作用,结果如图5所示。可见,H3PMo12O40对酪氨酸酶的催化没有扫出明显的氧化还原峰,且随酪氨酸酶加入量的增加,响应电流还出现了轻微的减弱趋势。原因可能是,虽然酪氨酸酶在持续加入,但部分酶已失活,导致实际浓度在下降,多酸对其催化效果不显著。
2.5 H3PMo12O40修饰电极的稳定性
从循环伏安图(见图6)可见,在V(0.1 mol/L H2SO4)∶V(0.5 mol/L Na2SO4)=2∶8混合溶液作为支持电解质下,修饰电极经过7次非连续性扫描、清洗过程,但整个过程响应电流并没有出现明显的减弱,最终响应电流值较开始仅下降了3.14%。后续对修饰电极进行100圈的循环伏安扫描(-0.4~+0.8 V的电位区间,扫描速度为100 mV/s),发现响应电流基本没有发生变化,表明基于吸附法制备的H3PMo12O40修饰电极稳定性良好。
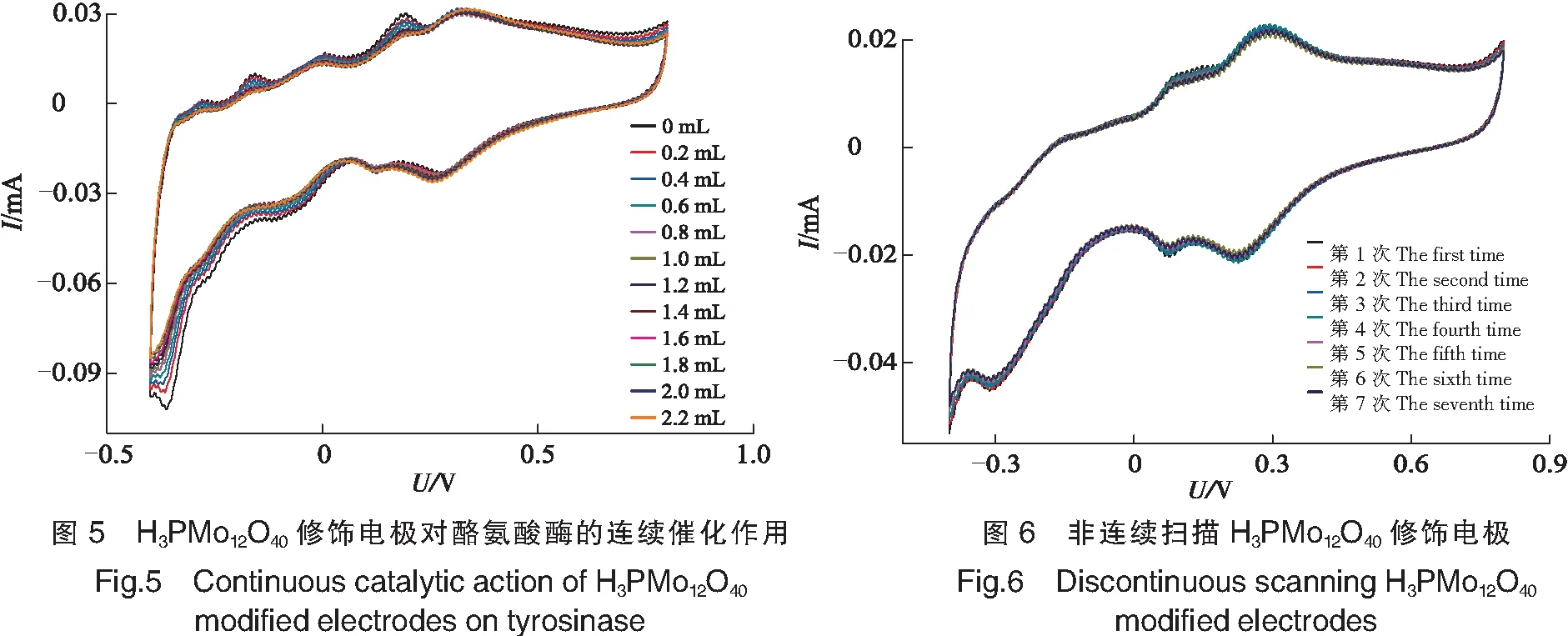
2.6 H3PMo12O40修饰电极的重现性
同一制备条件下以6支H3PMo12O40修饰电极来检测电极的重现性,结果表明:各响应电流间相对标准偏差为3.72%,表明基于吸附法制备的H3PMo12O40修饰电极具有良好的重现性。
3 结论
对玻碳电极进行阳极化处理,用吸附法将H3PMo12O40修饰至电极表面,将制备的修饰电极作为传感器适合在100 mV/s的扫描速度下进行扫描。为保持酪氨酸酶活性和避免H3PMo12O40分解,以V(0.1 mol/L H2SO4)∶V(0.5 mol/L Na2SO4)=2∶8混合溶液作为支持电解质最优,此时所对应的循环伏安图有明显的氧化还原峰,其响应电流和酪氨酸酶有着很好的线性关系。并以峰Ⅳ为例:I(Ⅳ)=0.863 1C-0.083,计算出检出限(S/N=3)为15.76 U·mL-1,且H3PMo12O40修饰电极有着良好的稳定性和重现性,对酪氨酸酶的催化和电化学传感效果良好。所以,后续有望将该修饰电极作为传感器安全地用于果蔬中酪氨酸酶的检测,对抑制果蔬褐变具有潜在的应用前景。

