有氧运动对稳定期慢性阻塞性肺疾病患者血清炎性因子及心肺运动功能的影响
黄鑫,钱钧,陈法余,郝建,姚燕妹,朱世飞,王静华*
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是以持续存在的气流受限为特征的一组可以预防和治疗的疾病,气流受限不完全可逆,病情呈渐进性进展[1]。其发生发展大多数是由于肺部吸入明显暴露于空气中的有毒颗粒或气体,引起气道和/或肺泡异常,进而造成气道、肺实质及肺血管的破坏[2]。COPD的发病机制尚不明确,可能是机体长时间与多种环境因素相互作用的结果,但可以肯定的是,慢性炎性反应在COPD的发生、进展和预后中扮演重要角色,且多种炎性因子和递质参与其中[3]。此病常年反复发作,严重影响患者的劳动力和生活质量,危害健康。COPD稳定期患者的治疗,现有措施仍以支气管扩张、祛痰及长期家庭氧疗为主,但效果不能满足临床治疗和患者的生活需求。COPD 全球创议(global initiative for chronic obstructive lung disease,GOLD)2019 年修订版提出了中国特色COPD康复方法,如肺道音康复技术、改良太极拳运动等[4],明确了肺康复治疗在改善患者长期预后方面的重要性。作为肺康复的核心内容,有氧运动能明显缓解患者呼吸困难情况,改善活动能力,提高生活质量[5]。心肺运动试验是在负荷递增的运动状态中监测机体的心肺功能指标,通过对二氧化碳排出量(carbondioxide output,VCO2)、摄氧量(oxygenintake,VO2)、每分通气量(ventilation,VE)等各项参数的分析,评估机体心肺功能受损情况和储备能力。本文主要探讨有氧运动作为一线非药物治疗对COPD稳定期患者血清炎性因子和心肺运动功能的影响,从而为改善患者预后提供依据。
1 对象与方法
1.1 研究对象 以2019年1月至2020年7月入住解放军杭州疗养院的中重度COPD稳定期患者60例为研究对象,根据随机数字表法将其分为对照组和试验组,各30例。本试验经过解放军杭州疗养院医学伦理委员会批准。研究对象入选标准:(1)符合中华医学会2019年COPD诊断和分组标准[4],根据患者吸入支气管扩张剂后第一秒用力呼气末容积(FEV1)下降程度选取研究对象(中度:50%≤FEV1<80%;重度:30%≤FEV1<50%);(2)非COPD急性发作期;(3)无有创或无创机械通气治疗;(4)规律吸入支气管舒张剂和糖皮质激素;(5)无免疫调节剂用药史;(6)无肺动脉高压、严重心肝肾及其他不适宜锻炼的局部或全身性疾病;(7)无精神类疾病史;(8)依从性可。告知受试者及家属试验采取的形式、目的、可能存在的风险,签署知情同意书。试验过程中,若患者出现急性发作、严重腿痛、严重疲劳或其他原因无法完成设定的运动量,即判定为样本脱落(其中60例受试者中,试验组1例因出现急性发作症状选择退出试验)。两组患者的性别、年龄、入院时身高和体质量、病程、呼吸困难分级(mMRC分级)比较,差异无统计学意义(P>0.05),见表 1。

表1 两组COPD稳定期患者一般情况比较Table 1 Comparison of the general situation of two groups of patients with stable COPD
1.2 试验方法 先对两组患者进行健康宣教,如劝导其戒烟、加强运动、避免着凉和感冒、改善居住环境卫生、耐寒能力的锻炼、规范吸入气雾剂等,再给予氧疗、平喘、祛痰、吸入支气管扩张剂(沙美特罗替卡松粉吸入剂250 μg,每日1~2揿)等常规治疗。试验组在此基础治疗上,规律进行有氧运动训练,训练方式为脚踩功率自行车,训练仪器为意大利COSMED公司的2900型脚踏车式运动心肺测试仪,训练强度为根据每个受试者测试所得无氧阈所对应的不同运动负荷进行训练,过程中采用负荷功率递增方案[6-7]。心肺运动试验参数与专业操作人员的指导方法及患者的配合程度密切相关,因此规范化的心肺运动试验方案是保证各参数准确的关键。心肺运动试验方案操作过程:试验开始前完成相关的定标工作,包括严格的气流容量、气体浓度等多级定标,以保证试验的精确度。操作人员先给患者示范动作,患者提前练习。根据团队既往有氧运动训练试验及参考书计算递增功率[6-7]。将计算得出的递增功率适度地增减1/2~2/3,以符合不同试验对象的病情情况。具体运动过程如下:(1)清洁患者胸廓及背部皮肤后,连接12导联心电图,协助患者戴上面罩,并检查是否漏气;(2)根据各试验对象的身高比例调整座椅与扶手高度,连接能够定时测量血压和指尖血氧饱和度的测量装置;(3)嘱患者静息状态下自然呼吸3 min,随后不加载负荷功率状态下缓慢踩车热身3 min,按计算所得的递增功率递增,转速保持在55~65 r/min;(4)当试验对象达到峰值摄氧量(Peak VO2)、VO2出现平台或者出现不良反应时〔疲劳、腿痛以至于无法维持转速,面色苍白、胸闷气急、呼吸困难、胸痛等不适,血压高于 180/120 mm Hg(1 mm Hg=0.133 kPa)或低于90/50 mm Hg,心律失常〕立即终止试验;(5)运动训练完成后嘱患者静息状态下休息30 min;(6)按照标准化分析原则对心肺运动试验数据进行分析判读,数据先经每秒分切,再用10 s平均数据进行分析,根据V-斜率法和VE取得无氧阈的值,以制定后续有氧运动训练的负荷功率。有氧训练方案:运动开始时,不加载负荷功率或较低的恒定负荷功率(如10 W)情况下热身10 min,而后运动负荷缓慢递增至无氧阈时功率的70%,保持每分钟递增的运动负荷相同(女性为15 W/min,男性为20 W/min),总的负荷功率递增试验时间维持在10 min以内,运动过程中受试者保持匀速踩车,转速保持在55~65 r/min,试验结束前最后2 min负荷功率降至0,继续无负荷缓慢踩车5 min,试验结束。训练频率:30~45 min·次-1·d-1,5次/周,共计12周。
1.3 观察指标
1.3.1 运动耐力指标 所有受试者均在试验前和第12 周 后 进 行 6 min 步 行 试 验(6-minute walk test,6MWT),患者在安静的室内沿一段标好距离的平直地面(如30 m)尽自己体能往返行走,计时6 min,记录总的步行距离,四舍五入精确到米,记为6 min步行距离(6MWD)。
1.3.2 生活质量指标 所有受试者均在试验前和第12周后填写圣乔治呼吸问卷(St.George's Respiratory Questionnaire,SGRQ),问卷包括呼吸症状、活动受限和疾病对其生活的影响3部分,共计50项,分值越高表明受试者的日常生活质量越高[8]。
1.3.3 心肺运动试验指标 所有受试者均在试验前和第12周后监测峰值公斤摄氧量(peak oxygen uptake/kg,Peak VO2/kg)、最大分钟通气量(maximal ventilation,VEmax)、无氧阈时二氧化碳通气当量(ventilation equivalent,VE/VCO2at AT)。
1.3.4 血清炎性因子水平 所有受试者均在试验前和第12周后空腹采集静脉血5 ml,室温下离心(3 000 r/min,10 min,离心半径 13.5 cm),上清液于 -80 ℃保存待用,按照试剂盒(购于杭州达真生物技术有限公司)说明书,采用酶联免疫吸附法(ELISA)检测白介素10(IL-10)、白介素17(IL-17)、基质金属蛋白酶9(MMP-9)水平。
1.4 统计学方法 应用SPSS 21.0软件进行统计分析,计量资料以(±s)表示,两组间比较采用独立样本t检验,同组内治疗前后比较采用配对样本t检验;计数资料以频数表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 治疗前后两组COPD稳定期患者运动耐力及生活质量指标变化情况 治疗前两组患者6MWD、SGRQ得分比较,差异无统计学意义(P>0.05)。治疗12周后,对照组及试验组6MWD、SGRQ得分均较治疗前升高(P<0.05),且第12周试验组6MWD、SGRQ得分高于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组COPD稳定期患者治疗前后6MWD和SGRQ的比较(±s)Table 2 Pre- and post-treatment measurement results of 6MWD and SGRQ between two groups of patients with stable COPD
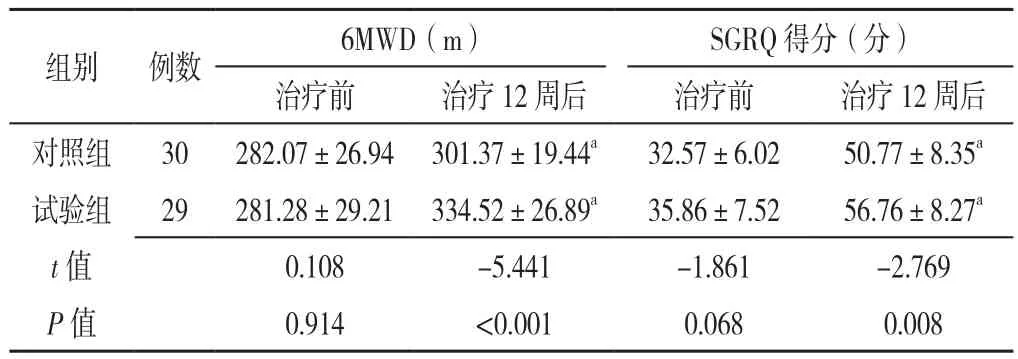
表2 两组COPD稳定期患者治疗前后6MWD和SGRQ的比较(±s)Table 2 Pre- and post-treatment measurement results of 6MWD and SGRQ between two groups of patients with stable COPD
注:6MWD=6 min步行距离,SGRQ=圣乔治呼吸问卷;a表示与同组治疗前比较,P<0.05
组别 例数 6MWD(m) SGRQ得分(分)治疗前 治疗12周后 治疗前 治疗12周后对照组 30 282.07±26.94 301.37±19.44a 32.57±6.02 50.77±8.35a试验组 29 281.28±29.21 334.52±26.89a 35.86±7.52 56.76±8.27a t值 0.108 -5.441 -1.861 -2.769 P值 0.914 <0.001 0.068 0.008
2.2 治疗前后两组COPD稳定期患者心肺运动试验指标变化情况 治疗前两组患者Peak VO2、VEmax及VE/VCO2at AT 比较,差异无统计学意义(P>0.05)。治疗12周后,对照组及试验组Peak VO2、VEmax均较治疗前升高(P<0.05),VE/VCO2at AT 均较治疗前下降(P<0.05);且第12周试验组Peak VO2、VEmax高于对照组,VE/VCO2at AT低于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组COPD稳定期患者治疗前后心肺运动试验各项指标的比较(±s)Table 3 Pre- and post-treatment cardiopulmonary exercise test indices between two groups of patients with stable COPD

表3 两组COPD稳定期患者治疗前后心肺运动试验各项指标的比较(±s)Table 3 Pre- and post-treatment cardiopulmonary exercise test indices between two groups of patients with stable COPD
注:Peak VO2=峰值摄氧量,VEmax=最大分钟通气量,VE/VCO2 at AT=无氧阈时二氧化碳通气当量;a表示与同组治疗前比较,P<0.05
组别 例数 Peak VO2(ml/min) VEmax(L/min) VE/VCO2 at AT治疗前 治疗12周后 治疗前 治疗12周后 治疗前 治疗12周后对照组 30 1 356.01±99.72 1 425.27±123.30a 34.64±3.72 35.78±3.61a 43.18±3.41 42.01±3.46a试验组 29 1 346.13±111.55 1 567.06±201.82a 33.75±3.94 40.46±6.30a 41.92±3.53 36.93±3.74a t值 0.359 0.160 0.891 -3.512 1.394 5.415 P值 0.721 0.002 0.377 0.001 0.169 <0.001
2.3 治疗前后两组COPD稳定期患者血清炎性因子水平变化情况 治疗前两组受试者IL-10、IL-17、MMP-9水平比较,差异无统计学意义(P>0.05)。治疗12周后,对照组及试验组IL-10水平较治疗前升高(P<0.05),IL-17、MMP-9较治疗前下降(P<0.05);且第12周试验组IL-10水平高于对照组,IL-17、MMP-9水平低于对照组,差异有统计学意义(P<0.05),见表4。
表4 两组COPD稳定期患者治疗前后外周血IL-10、IL-17、MMP-9水平比较(±s,pg/ml)Table 4 Pre- and post-treatment IL-10,IL-17 and MMP-9 levels in peripheral blood between two groups of patients with stable COPD

表4 两组COPD稳定期患者治疗前后外周血IL-10、IL-17、MMP-9水平比较(±s,pg/ml)Table 4 Pre- and post-treatment IL-10,IL-17 and MMP-9 levels in peripheral blood between two groups of patients with stable COPD
注:IL-10=白介素10,IL-17=白介素17,MMP-9=基质金属蛋白酶9;a表示与同组治疗前比较,P<0.05
组别 例数 IL-10 IL-17 MMP-9治疗前 治疗12周后 治疗前 治疗12周后 治疗前 治疗12周后对照组 30 46.35±6.06 55.13±7.30a 55.80±6.26 53.87±7.27a 67.89±8.37 61.63±10.11a试验组 29 46.66±6.14 62.65±10.32a 55.61±6.12 36.31±5.88a 66.63±6.95 53.88±10.37a t值 -0.194 -3.239 0.113 10.181 0.631 2.906 P值 0.847 0.002 0.910 <0.001 0.531 0.005
3 讨论
COPD是临床上常见的一种呼吸系统疾病,老年人多发,常年反复发作,导致患者出现不可逆的、进行性加重的呼吸受限和运动耐力降低,可进一步发展为慢性肺源性心脏病和呼吸衰竭,危及生命。随着国家步入老龄化社会,COPD发病率逐年上升,全球40岁以上发病率已高达9%~10%[9],因此认识该病的发病机制对于治疗和改善长期预后尤为重要。研究发现,COPD患者外周血清中可以检测出炎性因子的变化,这种变化与肺部炎性改变相一致[10],炎性因子在该病的发展过程中担当着重要的中介角色。活化的炎性细胞不断增多,激活的炎性因子和炎性递质(如IL-10、IL-17、MMP-9)不断释放,并对中性粒细胞和肺泡巨噬细胞等有趋化作用,致使炎性反应一步步放大,最终造成气道、肺实质和肺血管的慢性炎性反应[11]。MMP是一组主要降解基底膜和细胞外基质的蛋白酶家族,MMP-9在整个家族中占据主导地位,当肺脏受到炎性因子、致炎蛋白酶等侵害时,受损的血管内皮细胞、激活的中性粒细胞和肺泡巨噬细胞均可诱导MMP-9的表达,致使基底膜的IV型胶原酶降解,胶原沉积,且受损后的成纤维细胞开始增生,两方面共同作用导致气道重塑[12]。另外,MMP-9降解后的基底膜碎片对多种炎性因子有趋化作用,不断诱导其向炎性病变部位聚集,炎性反应持续放大,肺部损害持续存在。多种细胞因子可调控MMP-9的表达,白介素6(IL-6)、白介素8(IL-8)、IL-17等可诱导其高表达,而白介素4(IL-4)、IL-10等可下调其表达。IL-17由T细胞分泌产生,作为启动T细胞介导炎性反应的开关,诱导IL-6、IL-8等大量的炎性因子活化,还可上调MMP-9的表达,使气道内中性粒细胞的活化和聚集进一步加重,同时,增强肺泡弹性蛋白的活性使气道内分泌物大大增加[13]。这种持续放大的炎性反应是导致气道结构改变和COPD病情持续进展的重要原因[14-15]。机体在炎性反应放大和失衡的同时会代偿性启动抗感染反应,抗感染因子IL-10激活,通过抑制中性粒细胞、肺泡巨噬细胞表达MMP-9、IL-6等,直接抑制炎性反应免疫应答,使炎性因子和抗感染因子保持平衡状态,降低机体肺部的炎性水平,减轻肺损伤。
现阶段COPD的治疗仅停留在急性发作期的药物干预上,治疗效果有限,针对稳定期的慢性炎性反应和患者肺功能的恶化,尚无长期有效的治疗手段。以往研究表明,COPD患者普遍存在呼吸肌疲劳或者麻痹、肌肉耐力下降等现象[16]。而长期规律负荷的有氧运动可以改善呼吸肌的收缩和舒张功能,降低肌肉易疲劳性,增强肌肉的力量和耐力,同时可以有效缓解慢性炎性反应[17]。由此可见,作为肺康复的核心内容,有氧运动可为稳定期患者带来直接临床效果,并且改善预后。本文探讨了常规治疗基础上联合有氧运动对COPD患者提升心肺运动功能、抑制炎性反应的作用机制及临床应用效果。研究发现,COPD患者外周血清中IL-17水平较健康者升高,且其上调表达的MMP-9水平也呈现出升高趋势,而IL-10的表达明显降低,表明COPD患者体内存在着放大和失衡的炎性反应,介导炎性反应免疫应答的致炎因子表达增加,抗感染效应减弱[18]。经过药物常规治疗和12周脚踩功率自行车训练后,试验组IL-17、MMP-9水平较治疗前及对照组明显下降,IL-10水平较治疗前及对照组明显升高,表明抗感染效应增强,与炎性因子的表达趋于平衡,慢性炎性反应得到缓解。试验组在第12周测得的6MWD、SGRQ、Peak VO2和VEmax指标均较治疗前及对照组升高,而VE/VCO2at AT指标低于治疗前及对照组,表明规律负荷的有氧运动可有效缓解呼吸困难症状,增加心肺功能储备和运动耐量,生活质量随之提升。其机制可能与通过抗感染效应的增强,机体抵抗炎性反应免疫应答的能力提高有关[19]。通过本试验可以发现,药物常规治疗加上运动锻炼形式的有氧运动能够明显减轻慢性炎性水平,改善机体的健康状态,延缓COPD的病情进展,使稳定期患者从中明显受益。
本研究的局限性:临床实际工作中稳定期COPD患者住院率并不高,大多数COPD急性发作患者在解除诱因及改善症状后急于出院,部分患者依从性不高,出院后不愿继续完成心肺运动试验长时间的运动训练,数据收集困难。另外,心肺运动试验过程中,部分患者虽然按照指导脚踩功率自行车,但如踩踏自行车时只用脚尖而不用脚掌,自行车座椅高度与患者身高不匹配等,患者易疲劳,以致转速减慢而提前中止试验,影响试验指标结果,患者对试验细节的配合程度会对试验的有效性产生影响,因此试验前专业的操作人员可先进行示范动作,嘱患者提前练习,训练中操作者可口喊加油等话语,给患者足够的鼓励。
综上所述,早期启动、长期坚持规律的运动锻炼,可以明显改善COPD患者失衡的慢性炎性反应,增加呼吸肌耐力和肺泡通气量,使气体交换得以充分进行,缓解呼吸受限,提升生活质量和机体免疫力,因此临床上,有氧运动作为稳定期COPD患者一线的非药物治疗值得推广。
作者贡献:黄鑫、王静华负责文章的构思与设计;黄鑫负责文章的统计学处理、论文撰写;钱钧、陈法余负责研究的实施与可行性分析;黄鑫、郝建负责数据收集;黄鑫、姚燕妹负责数据整理;陈法余负责结果的分析与解释、文章的质量控制及审校;朱世飞负责论文的修订;王静华对文章整体负责,监督管理。
本文无利益冲突。

