血浆同型半胱氨酸在高龄慢性心衰患者中的表达及其与心室重构的相关性
王丽杰 刘宇翔
慢性心力衰竭(chronic cardiac failure,CHF)是多种心脏器质性病变进展到终末阶段表现出的一种临床综合征,患病率随着年龄增长而增加,70岁以上人群患病率已超过10%[1]。现已明确心室重构是促使慢性心力衰竭发展的基本机制,存在于心力衰竭的各个阶段[2]。血浆同型半胱氨酸(homocysteine,Hcy)作为一种损伤介质,参与了慢性心力衰竭的病理生理过程,其水平变化和心力衰竭的严重程度及预后密切相关[3]。本研究通过分析血浆Hcy在高龄慢性心力衰竭患者中的表达,探讨其在慢性心力衰竭发生发展中的作用及与心室重构的相关性。
1.资料与方法
1.1 研究对象 选取2018年1月至2020年1月辽宁省金秋医院收治的高龄(≥80岁)慢性心力衰竭患者115例为病例组,其中男性69例,女性46例,平均年龄(86.57±6.13)岁。纳入标准:符合《2018年中国心力衰竭诊断和治疗指南》中的相关标准[4]:具有疲劳、踝部水肿、呼吸困难等临床症状,具有心尖搏动移位、肺部啰音、颈静脉充盈等临床体征,心动图、超声心动图等相关检查提示心脏结构和(或)功能异常。将病例组患者分为Hcy正常组(Hcy<15μmol/L)43例和Hcy升高组(Hcy>15μmol/L)72例。对照组选取同期收治的心功能正常患者66例,其中男性35例,女性31例,平均年龄(86.98±4.20)岁。排除标准:先天性心脏病、肥厚性心肌病、严重心脏瓣膜病、3个月内新发急性心肌梗死、肺源性心脏病及肺栓塞、严重肝肾功能异常、恶性贫血、甲状腺疾病、恶性肿瘤等。此项研究经辽宁省金秋医院伦理委员会审查批准后开展。
1.2 方法 对入组病例信息进行回顾性统计,包括性别、年龄、身高、体重、合并基础疾病(如糖尿病、高血压、冠心病等),并计算体质量指数(BMI)。所有入组病例均在入院24小时内采集晨起空腹静脉血4ml,高速离心后取上清液检验。采用全自动生化分析仪(迈瑞BC-6800)循环酶法检测血浆Hcy浓度,由检验科人员严格按照流程规范操作。血浆Hcy正常值范围为≤15μmol/L。
超声心动图指标按照美国超声心动图协会(American Society of Echocardiography,ASE)推荐的操作标准,使用GE Vivid E9彩色多普勒超声诊断仪,在患者入院1周内行心脏超声检查,测定同一心动周期心脏左室射血分数(Left ventricular ejection fraction,LVEF)、左室舒张末内径(left ventricular end diastolic diameter,LVEDd)、左室后壁厚度(posterior wall thickness,PWT)、室间隔厚度(interventricular septal thickness,IVST)。左室质量(left ventricular mass,LVM)。依据Devereux公式计算[5],LVM(g)=1.04([(IVST+PWT+LVEDd)3-(LVEDd)3]-13.6,左心室质量指数(left ventricular mass index,LVMI)=LVM/体表面积,用以评价心室重构。
1.3 统计学方法 采用SPSS 20.0统计软件进行t检验、χ2检验或Fisher确切概率法、Pearson相关性分析。以P<0.05为差异有统计学意义。
2.结果
2.1 研究对象一般资料比较 病例组与对照组患者年龄、性别、BMI、合并高血压、冠心病、糖尿病发生率比较,差异均无统计学意义(P>0.05),资料具有可比性,见表1。
2.2 病例组和对照组血浆Hcy水平及超声心动图参数比较 病例组患者血浆Hcy、LVEDd、LVMI水平分别高于对照组,LVEF水平低于对照组,差异均有统计学意义(P<0.05),见表1。
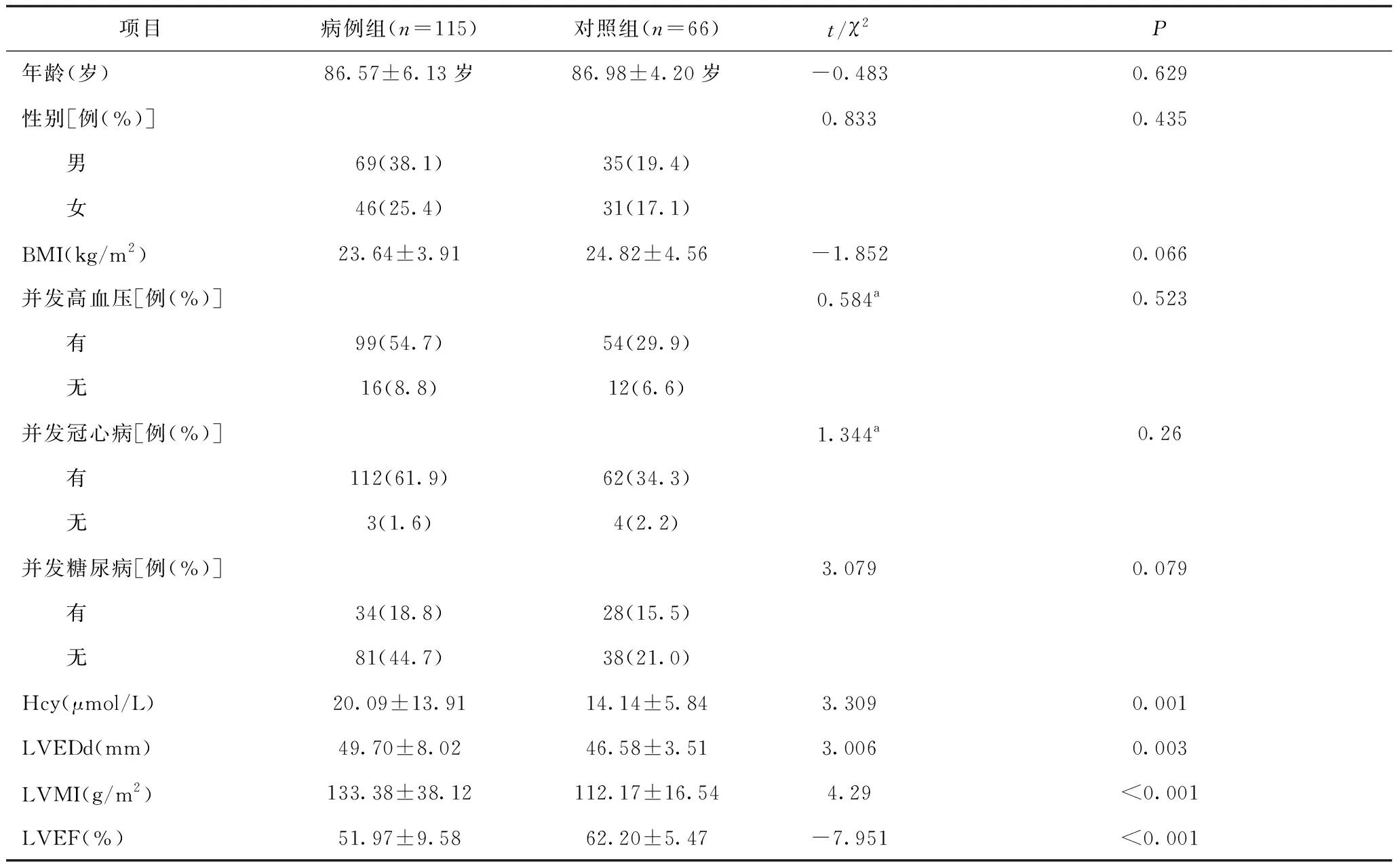
表1 病例组与对照组临床资料比较
2.3 慢性心力衰竭患者血浆Hcy不同分组间超声心动图参数比较 与Hcy正常组比较,Hcy升高组LVEDd、LVMI均显著升高,差异有统计学意义(P<0.05),LVEF差异无统计学意义(P>0.05),见表2。
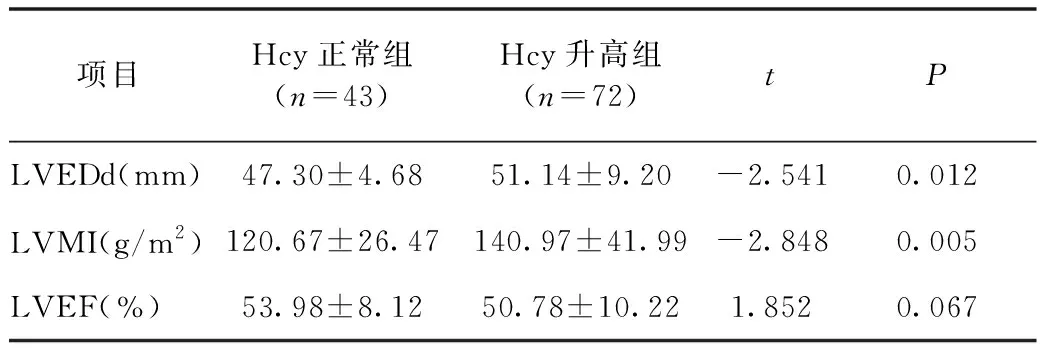
表2 病例组Hcy不同分组间LVEDd、LVMI、LVEF比较
2.4 病例组血浆Hcy水平与LVEDd、LVMI、LVEF相关性分析 经Pearson相关性分析显示,高龄CHF患者血浆Hcy与LVEDd(r=0.216,P<0.05)、LVMI(r=0.270,P<0.01)均呈正相关,与LVEF(r=-0.185,P<0.05)呈负相关,见表3。
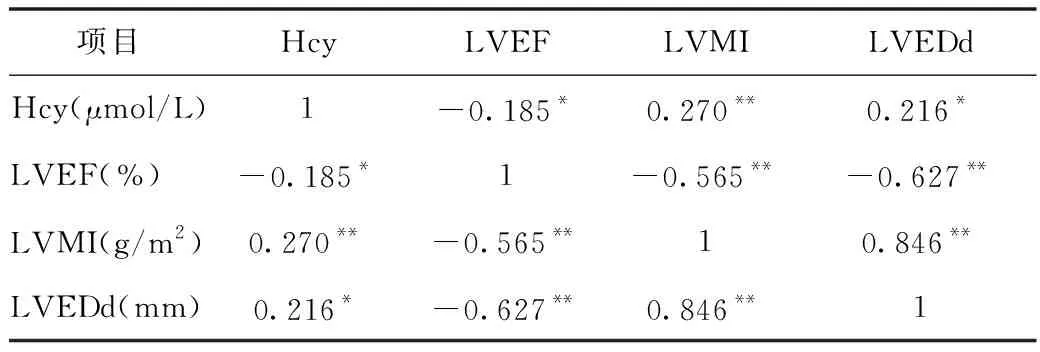
表3 病例组Hcy与超声心动图参数的相关性
3.讨论
慢性心力衰竭是以左心室充盈压升高和器官灌注不足为特征的一种临床综合征,具有以下特征:引起运动耐量受限的呼吸困难和疲乏,以肺淤血和肢体水肿为主要表现的液体潴留,具有诊断心力衰竭的客观依据-静息时心脏结构或功能异常[6]。随着社会人口老龄化进程加速,老年CHF患者人数逐渐增多,其再住院率和死亡率均较高[7],严重影响老年人的生活质量和生命安全。根据美国心脏病协会/美国心脏学会(ACC/AHA)制定的心力衰竭分期标准,心力衰竭B期时患者没有明显的心力衰竭症状,但已具有结构性心脏病,此时干预可延缓心衰进展。由于慢性心力衰竭早期临床症状不典型,高龄患者常合并高血压病、心房颤动等多种疾病,可能掩盖心衰的症状表现,而且患者往往在出现明显症状和体征时才到医院就诊,此时心力衰竭分期已达C期或以上,患者生活质量和生存率大幅度下降,因此早期识别和诊断慢性心力衰竭并采取积极干预治疗对降低慢性心力衰竭病死率、改善患者预后非常重要。
当患者出现慢性心力衰竭时,由于交感神经系统、肾素-血管紧张素-醛固酮系统、免疫因子、基质金属蛋白酶系统、内皮源性激素等一系列复杂的机制长期单独或共同作用于心肌细胞以及细胞外基质,导致心室重构的发生和发展,表现为心室肌增重、心室容量增加和心室形状的改变[8]。早期的心室重构,即无症状的心脏结构异常是机体代偿性改变,但长期慢性的心室重构必将导致心功能不全和失代偿期心力衰竭的发生[9]。因此,能够早期诊断慢性心力衰竭和提示心室重构的血清生物标志物对老年CHF防治非常重要。
血浆同型半胱氨酸是一种含硫氨基酸,为体内蛋氨酸向半胱氨酸转换过程中的重要中间产物,遗传缺陷和环境因素代谢异常是形成高同型半胱氨酸血症(HHcy)的主要原因。血浆Hcy水平升高是慢性心力衰竭的独立危险因素,且与心力衰竭严重程度有关[10]。目前研究表明,血浆Hcy可以通过多种途径降低心功能、促进心室重构,从而导致慢性心力衰竭的发生,主要包括:①Hcy通过降低机体抗氧化能力,增强氧化应激,损伤血管内皮细胞,造成心脏微循环障碍,影响心肌血液供应,最终导致心肌细胞缺血损伤[11],这是Hcy引起心室重构的主要病理机制。②高Hcy可通过上调转化生长因子β1表达,影响金属蛋白酶组织抑制因子1/基质金属蛋白酶1(TIMP1/MMP1)比例,导致心肌细胞外基质降解失调,引起心肌间质纤维化,促进心室重构和心力衰竭的发生[12]。③高Hcy通过增加细胞内一氧化氮、钙离子、活性氧而引起心肌细胞自噬、凋亡[13]。④Hcy水平异常升高打乱了蛋氨酸代谢平衡,影响DNA甲基化,导致凋亡因子Bax等表达上调,凋亡抑制因子表达减少,促进心肌细胞凋亡和损伤[14]。赵艳等[15]研究表明血浆Hcy与左心室质量指数、左室舒张末期内径、左室后壁厚度、室间隔厚度呈正相关,在校正年龄、性别、血细胞比容后,Hcy与左心室质量指数仍相关,表明血浆Hcy水平变化在心室重构过程中发挥重要作用。
本研究结果显示,高龄慢性心力衰竭患者血浆Hcy、LVEDd、LVMI水平均高于心功能正常患者,差异有统计学意义(P<0.05),说明血浆Hcy水平升高与高龄患者慢性心力衰竭发生、发展密切相关,血浆Hcy可以作为高龄患者CHF临床辅助诊断的一个依据。临床针对高龄慢性心力衰竭患者,应积极进行血浆Hcy检测,有助于早期明确诊断,及时予以对症干预治疗。本研究也发现,HHcy合并慢性心力衰竭患者LVEDd、LVMI均显著高于正常Hcy合并慢性心力衰竭患者,差异有统计学意义(P<0.05),Pearson相关性分析显示,高龄CHF患者血浆Hcy与LVEDd(r=0.216,P<0.05)、LVMI(r=0.270,P<0.01)均呈正相关性,与LVEF(r=-0.185,P<0.05)呈负相关性,差异均有统计学意义,提示随着血浆Hcy水平升高,左心室体积呈扩大趋势,心肌重量增加,心室重构程度增加,这与以往研究结果一致[16],血浆Hcy水平检测有助于评估高龄慢性心衰患者心室重构,为临床诊断和相关干预治疗提供参考。
综上所述,血浆同型半胱氨酸在高龄慢性心力衰竭患者中表达水平明显升高,为临床早期诊断高龄患者CHF提供了新的生物学指标。血浆Hcy能够提示高龄CHF患者心室重构的发生,与超声心动图联合检测可以更加准确地判断心室重构,指导实施针对性治疗,改善患者预后。

