4种检测技术对艾滋病合并肺结核的诊断效能比较*
蒋 玲,钱春芳,李同心,彭羽静
重庆市公共卫生医疗救治中心:1.结核二科;2.实验室;3.结核四科,重庆 400000
艾滋病使人体丧失免疫功能,其患者极易合并各种机会性感染。肺结核是艾滋病患者最常合并的机会性感染之一,是艾滋病患者疾病进展的重要影响因素,也是艾滋病患者死亡的重要原因。艾滋病合并肺结核临床表现不典型,且可能还合并多种其他机会性感染,使病情更加复杂,因此,艾滋病合并肺结核的诊断相对较困难。目前,病原学检测仍是艾滋病合并肺结核诊断的主要依据,常用的检测技术有痰涂片抗酸染色镜检(简称“涂片法”)、BACTEC MGIT 960液体培养法(简称“MGIT960培养法”)、RNA恒温扩增技术快速检测法(简称“TB-SAT法”)、Gene-Xpert MTB/RIF检测法(简称“Gene-Xpert法”)。本研究采用以上4种实验室检测技术对艾滋病合并肺结核患者的痰标本进行病原学检测,比较4种检测技术的诊断效能。
1 资料与方法
1.1一般资料 收集2020年1-12月重庆市公共卫生医疗救治中心感染科收治的107例通过实验室病原学检测、影像学检查和临床综合分析诊断为艾滋病合并肺结核的患者为研究对象,其中男86例,女21例;平均年龄(47.12±15.21)岁。所有痰标本采集前未使用过抗结核药物,所有痰标本均进行了涂片法、MGIT960培养法、Gene-Xpert法、TB-SAT法4种实验室检测技术检验。
1.2诊断标准 根据《国家肺结核诊断标准:WS288-2017》[1]《临床结核病学(第2版)》[2]《结核菌/艾滋病病毒双重感染防治政策指南——适用于国家规范和利益攸关方》[3]和《HIV合并结核分枝杆菌感染诊治专家共识》[4],结合本研究的全部检测方法,对艾滋病确诊患者进行结核病诊断,如判定为活动性肺结核再进一步确定为临床诊断病例或确诊病例。
1.3仪器与试剂 抗酸染色液购自珠海贝索生物技术有限公司,显微镜购自日本Olympus公司;BACTEC MGIT 960分枝杆菌培养系统及MGIT960分枝杆菌培养管购自美国BD公司;RNA恒温扩增检测试剂盒(TB-SAT试剂)购自上海仁度生物科技有限公司;Gene-Xpert检测仪及试剂盒购自美国Cepheid公司;H37RV结核分枝杆菌标准菌株由中国疾病预防控制中心国家结核病参比实验室提供。
1.4检测方法 收集107例艾滋病合并肺结核患者的晨痰标本5~6 mL于无菌痰杯中送检,每份标本同时采用涂片法、MGIT960培养法、TB-SAT法和Gene-Xpert法检测。
1.4.1涂片法 采用萋-尼抗酸染色,按照《结核病实验室检验规程》(简称“规程”)[5]进行涂片法检测和结果判读。
1.4.2MGIT960培养法及菌种鉴定 严格按照 BACTEC MGIT960分枝杆菌培养系统操作说明书进行操作,吸取0.5 mL痰标本加入50 mL圆底离心管内,再加入1~2 mL前处理液,振荡消化15 min,加入40 mL磷酸盐缓冲液(PBS)中,离心(3 000×g离心18 min),弃上清液,加1 mL的PBS进行重悬沉淀,取0.1 mL接种到准备好的培养管内,放入BACTEC MGIT960分枝杆菌培养系统中培养,按照说明书进行结果判读。
1.4.3TB-SAT法 严格按照TB-SAT试剂说明书操作,取1 mL痰标本采用13 000 r/min离心5 min,弃上清液,再用1 mL无菌生理盐水洗涤一次后加入50 μL TB裂解液重悬,超声(功率300 W)处理15 min。取2 μL处理后的标本加入含30 μL扩增检测液的微量反应管中,将微量反应管置于干热恒温器上60 ℃保温10 min,再置于42 ℃保温5 min,同时将反应酶预热至42 ℃,最后向每支反应管中加入10 μL反应酶,迅速混匀并转至荧光定量PCR仪进行检测。反应程序:荧光通道设定为FAM,每个循环为42 ℃、1 min,共40个循环;荧光信号收集每分钟1次,共检测40次。阳性结果判读标准:标本曲线与阈值线交叉点的横坐标读数(检测时间)<40 min。每次检测都必须做阴性和阳性对照。
1.4.4Gene-Xpert法 取1 mL标本加入前处理管内,视标本性状加入2倍标本处理试剂(SR),涡旋振荡15~30 s,静置15 min;取2 mL处理后标本加入Gene-Xpert的反应盒,自动进行PCR检测所需的3个步骤(标本核酸提取、扩增和检测)。采用Gene-Xpert检测系统,针对结核分枝杆菌利福平耐药基因rpoBde 81bp利福平核心区进行检测,以确定是否发生基因突变。
1.5统计学处理 采用SPSS17.0统计软件进行数据处理及统计分析,计数资料以例数或百分率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。采用Kappa检验将涂片法、TB-SAT法、Gene-Xpert与MGIT960培养法进行一致性检验,当Kappa≤0.4时,表示一致性较差,当0.4
2 结 果
2.14种方法检测结果 107例患者痰标本同时进行4种方法检测的阳性率由低到高依次为涂片法、TB-SAT法、Gene-Xpert法、MGIT960培养法,分别为30.84%(33/107)、35.51%(38/107)、49.53%(53/107)、51.40%(55/107)。TB-SAT法阳性率(35.51%)虽高于涂片法阳性率(30.84%),但差异无统计学意义(χ2=0.764,P=0.382),MGIT960培养法阳性率(51.40%)高于涂片法阳性率(30.84%),差异有统计学意义(χ2=10.246,P=0.001);MGIT960培养法阳性率(51.40%)高于TB-SAT法阳性率(35.51%),差异有统计学意义(χ2=5.496,P=0.019);Gene-Xpert法阳性率(49.53%)低于MGIT960培养法阳性率(51.40%),但差异无统计学意义(χ2=0.075,P=0.078);Gene-Xpert法阳性率(49.53%)高于TB-SAT法阳性率(35.51%),差异有统计学意义(χ2=4.302,P=0.038)。
2.2检测结果一致性分析 以MGIT960培养法检测结果为金标准,检验涂片法、TB-SAT、Gene-Xpert法与MGIT960培养法检测结果的一致性,3种检验方法结果与MGIT960培养法检验结果进行比较,见表1。通过Kappa值判定3种检验方法与MGIT960培养法的一致性:涂片法Kappa值为0.445,两者一致性中等;TB-SAT法Kappa值为0.648,两者具有较高的一致性;GeneXpert法Kappa值为0.851,两者一致性良好。见表2。
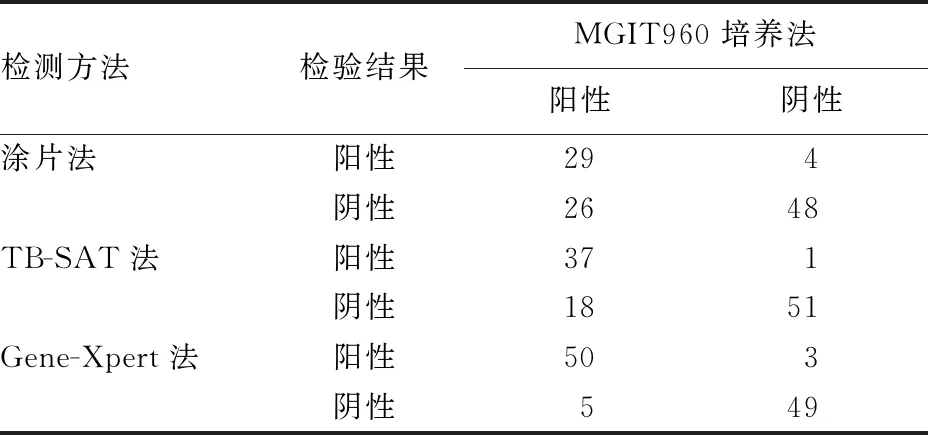
表1 其他3种检测方法与MGIT960培养法检验结果(n)

表2 以MGIT960培养法为金标准判定其他3种检测方法的诊断效能
3 讨 论
2019年全球结核病报告显示,全球范围约有1 000万例结核病新发病例,其中8.6%为人类免疫缺陷病毒(HIV)阳性患者,且约25.1万例艾滋病患者相关死因是由于结核病所致[6]。中国是结核病高负担国家,HIV感染者的艾滋病患者中结核病的患病率分别为7.2%和22.8%[7]。与单纯的结核病诊断相比,艾滋病合并结核病患者诊断相对困难,容易误诊、漏诊和延迟诊断。因此,世界卫生组织推荐对于艾滋病患者中疑似有结核分枝杆菌感染者要使用包括分子生物学诊断工具、培养和影像诊断在内的所有手段,缩短艾滋病合并结核病的诊断时间,以降低患者病死率[4]。
MGIT960培养法及菌种鉴定为结核病诊断的金标准,还能进行药物敏感性试验;在本研究中,MGIT960培养法阳性率高于其他3种方法,是临床诊断中不可或缺的检验技术,但该技术操作繁琐,培养周期长,艾滋病患者因免疫力低下,病情进展迅速导致不良结局风险高,若仅采用此方法诊断,容易造成艾滋病合并肺结核患者的延迟诊断。
涂片法简单便捷,成本低,易普及,目前,仍是国内结核病最主要的初筛方法和随访时监测疗效手段[8-9]。但涂片法阳性率低,本研究中,艾滋病合并肺结核患者中涂片法检测阳性率为30.84%,难以满足临床诊断的需求。若仅采用涂片法进行艾滋病合并肺结核的诊断,容易造成艾滋病合并肺结核患者漏诊。
TB-SAT法的操作简单,2 h内可获得检测结果[10],对于RNA转录活跃的病原体,是一项较好的诊断指标[11],且可以区分结核分枝杆菌有无生命力,试验过程中交叉污染较少,可为结核病患者的治疗效果提供参考。本研究中,TB-SAT法阳性率为35.51%,高于王静等[12]报道的阳性率(7.6%);灵敏度为67.27%,低于安东成等[13]报道的灵敏度(88.1%)。该方法与MGIT960培养法具有较高的一致性,推荐用于诊断艾滋病合并肺结核,同时可采用此方法评价患者的治疗效果。
Gene-Xpert法将MGIT960培养至少需要3周才能完成的结核分枝杆菌检测时间缩短为2 h,且该技术操作简单,实验室人员容易掌握,整个实验手动操作时间不超过5 min,整个检测在一个密闭的环境中进行,对实验室人员有较好的保护[14]。本研究中,Gene-Xpert法灵敏度较涂片法、TB-SAT法都高,与MGIT960培养法具有良好的一致性,可以用来代替MGIT960培养法诊断艾滋病合并肺结核。
综上所述,笔者建议在诊断艾滋病合并肺结核时优先选用Gene-Xpert法;可选用TB-SAT法进行该类患者诊断及治疗效果的评估;选用MGIT960培养法做菌种鉴定,便于进行药物敏感试验,明确该类患者是否耐药;条件有限的基层实验室仍可选用涂片法进行初筛和疗效评估。

